磷化锡空心球的制备、表征及其性能研究
刘淑玲, 张红哲, 仝建波
(陕西科技大学 化学与化工学院, 陕西 西安 710021)
磷化锡空心球的制备、表征及其性能研究
刘淑玲, 张红哲, 仝建波
(陕西科技大学 化学与化工学院, 陕西 西安710021)
摘要:以二水氯化亚锡(SnCl2·2H2O)作为主要原料,乙二醇(EG)作为溶剂,采用十六烷基三甲基溴化铵(CTAB)辅助的溶剂热法成功地制备了磷化锡(Sn4P3)空心纳米球.X射线粉末衍射(XRD)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)分别对所制备样品的结构、形貌进行了表征.结果表明:所制备的Sn4P3具有纯的六方相结构,形状为空心球,其直径介于300~800 nm之间.十六烷基三甲基溴化铵用量及反应时间对样品尺寸、形貌及空心球形成过程等均有一定的影响.通过对比实验得出:Sn4P3空心球的最佳制备条件是十六烷基三甲基溴化铵的质量百分数为0.79%,反应温度为180 ℃,反应时间16 h.最后通过紫外可见分光光度计对其光学性能进行了研究.
关键词:磷化锡; 空心球; 溶剂热
0引言
过渡金属磷化物是一种有着很大潜力的材料,具有独特的物理化学性能,其在催化[1]、电极材料[2,3]、光电子器件[4,5]、磁学[6]等领域有着潜在的应用,从而受到了人们的广泛关注.
在Sn-P二元体系中,存在多个复杂的化学计量相,例如:SnP3、Sn3P、SnP和Sn4P3[7-10].其中磷化锡(Sn4P3)由于特殊的层状结构使它展现出良好的性能,尤其是在电极材料[11]和催化[12]领域.目前,制备磷化锡的方法较多,如:(1)在高温下,元素锡和红磷在真空的石英管中直接反应[13];(2)化学气相沉积法制备 Sn4P3膜[14];(3)水热/溶剂热法[15];(4)机械化学合成法[16].上述制备方法中大多需要高温、高压、非常昂贵的试剂或者需要特殊的设备和使用有毒的原料,反应条件比较苛刻,不便于过渡金属磷化物的制备.所以设计一种简单、低温的合成方法来合成新形貌的磷化锡,现在仍然是一个难题.溶剂热法[17]具有操作简单,制备条件温和,反应时间短等特点,成为了一种具有发展前景的合成方法.通过溶剂热法,不仅可以制备出多种不同形貌和结构的磷化物纳米材料,如枝晶Cu3P[18]、空心球Ni2P[19]、豆荚状Ni12P5[20]等;而且还可以增加体相催化剂的比表面积、分散活性组分或暴露更多具有催化活性的晶面,从而使得过渡金属磷化物的光催化降解性能、电化学性能得到更好地发挥[21].
本文以二水氯化亚锡(SnCl2·2H2O)作为主要原料,乙二醇(EG)作为溶剂,采用十六烷基三甲基溴化铵(CTAB)辅助的溶剂热法,在180 ℃下反应16 h成功地制备出了磷化锡(Sn4P3)空心纳米球.探讨了各个反应参数对磷化锡(Sn4P3)空心纳米球形成的影响,并且对其紫外性能进行了研究.
1实验部分
1.1 实验试剂
氯化亚锡(SnCl2·2H2O)(AR,天津市化学试剂三厂);硼氢化钠(NaBH4)(AR,西安化学试剂厂);乙二醇(EG)(AR,天津化学试剂有限公司);白磷(P4)(AR,西安怡鑫化工公司);十六烷基三甲基溴化铵(CTAB)(天津市红岩化学试剂厂);苯(AR,天津市红岩化学试剂厂);乙醇(AR,天津化学试剂有限公司).
1.2 样品制备
称取0.226 g氯化亚锡(SnCl2·2H2O;1 mmol)溶于40 mL的乙二醇(EG)溶液中,搅拌20 min;然后再加入0.037 g硼氢化钠(NaBH4;1 mmol)继续搅拌10 min,然后加入0~0.50 g十六烷基三甲基溴化铵(CTAB),充分搅拌后加入0.248 g白磷(P4;2 mmol),将反应釜封紧混合均匀后将溶液转入到50 mL聚四氟乙烯的不锈钢反应釜中,拧紧釜盖,于恒温180 ℃连续反应16 h.反应结束后取出反应釜,自然冷却到室温.将所得黑色沉淀进行抽滤,先用苯洗涤数次,然后依次用乙醇、蒸馏水、乙醇等洗涤,最后将所得产物在60 ℃下真空干燥 6 h.
1.3 样品表征
产品的物相和纯度通过德国Bruker D8型X射线粉末衍射仪(X-ray powder diffraction,XRD)进行检测,采用Cu Kα(λ= 0.154 18 nm),测试电压40 kV,测量角度2θ为20 °~60 °, 样品的形貌分析利用日本 Hitachi S-4800型场发射扫描电镜(FE-SEM)和 JEM-2011 型透射电子显微镜(TEM)进行观察.X-射线衍射分析和环境扫描电子显微镜所用样品均为所获得样品直接测试,不需研磨.透射电子显微镜所用样品为所获得样品加乙醇超声在铜箔上制样后测试,利用美国哈希公司的DR-5000紫外可见分光光度计对其光学性质进行检测.
2结果与讨论
2.1 物相分析
图1为通过溶剂热法合成的磷化锡(Sn4P3)的X-射线衍射图谱.从图1中可以看出,所合成的二氧化锡表征为纯的磷化锡,其中2θ为26.43 °、27.86 °、28.87 °、30.34 °、31.46 °、44.51 °、45.69 °、55.84 °、56.52 °处的峰分别对应于标准六方相磷化锡(JCPDS card No.20-1294,晶格常数分别a=0.396 7 nm,c=3.533 nm)中的(012)、(104)、(015)、(0012)、(107)、(0114)、(110)、(1112)和(027)衍射晶面.从图1中a、 b、 c曲线可以看出,磷化锡的主要峰形比较尖锐,显示好的结晶性.而且在磷化锡产物中由于低的含量或者结晶性,并没有观察到其它相或者可能出现的杂质,例如单质锡,单质磷以及其他的磷化物.然而当时间增加到24 h时,从图1中d曲线可以看出磷化锡衍射峰的强度有所减弱,表明了结晶性的下降.
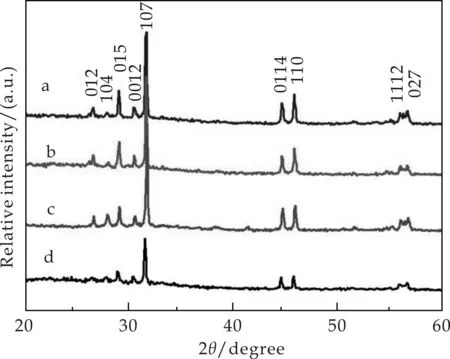
a:不加CTAB于180 ℃反应16 h; b、 c、 d:加入CTAB于180 ℃下分别反应10 h、16 h、24 h图1 磷化锡 (Sn4P3)的X-射线衍射图谱
2.2 形貌分析
产物的形貌和尺寸利用扫描电子显微镜进行观察,如图2(a)所示.从图2(a)中可以看出产物的形貌主要是由大部分的球形结构和小部分的纳米小颗粒组成,球形结构比例在80%左右,球形结构的尺寸不是很均一,其尺寸介于300~800 nm之间.而且球形结构的表面不是很光滑,其表面有一些颗粒.结果表明球形结构是由许多纳米颗粒组成.
图2(b)是合成的Sn4P3的透射电子显微镜图片.从图2(b)中明暗区域的对比可以看出,合成的磷化锡具有空心的结构.大多数空心球的尺寸和外围厚度分别为500 nm和200 nm.而且可以看出空心球的表面不是很光滑,这与SEM观察的结果一致.与此同时,生成的磷化锡空心球不是很分散,有些团聚,原因可能是一些小颗粒由于小尺寸效应和高的表面能很容易团聚组装成为较大的二次粒子.

(a)磷化锡(Sn4P3)空心球的扫描电镜照 (b)磷化锡(Sn4P3)空心球的透射电镜照图2 磷化锡 (Sn4P3)的扫描和透射电镜照
为了考察反应中,各个反应参数对磷化锡(Sn4P3)形貌和尺寸的影响,我们做了单因素影响实验,即保持各个实验条件不变,只变化其中的一种因素.下面进行了单因素十六烷基三甲基溴化铵(CTAB)、时间的实验.
2.3 反应参数对产物形貌和尺寸的影响
2.3.1CTAB的用量对Sn4P3形貌和尺寸的影响
表面活性剂具有定向吸附于物质表面,使其表面性质发生变化的性质[22].在实验过程中发现,CTAB的量对于Sn4P3空心球的形成起着关键作用.众所周知,CTAB是一种比较常用的阳离子表面活性剂,具有较好的表面活性、稳定性和亲和性,它在溶液中可以完全电离,在产物生长初期,CTAB可以通过静电作用吸附在产物颗粒中心核的表面,随后生成的颗粒以CTAB为模板逐渐自组装覆盖生长在磷化锡晶体上,控制了产物在结晶体系中生长的习性,最终充分的发挥形貌调控剂CTAB调控粉体材料形貌的形成,最终形成球形结构.
图3(a)是没有CTAB辅助条件下,所得到的产物的透射电镜图片.正如图3(a)所示,当没有CTAB辅助时,产物由大量的尺寸在300 nm左右的不规则颗粒组成.当加入CTAB 0.18 g时,从图3(b)可以看出产物由一些实心球和空心球组成.图3(c)为在最佳CTAB条件下所得产物的透射电镜图片,当CTAB的量为0.35 g时,从图中可以看出大量的空心球和少量的纳米颗粒.然而,当CTAB的量继续增加到0.50 g时,产物有大量的团聚体组成.因此,实验中CTAB对于Sn4P3空心球的形成确实有着不可或缺的作用.增加或减少CTAB的用量都不能出现这样的结果.这可能是由于CTAB的用量少,起不到辅助的作用;而CTAB的用量大,则溶液的粘度变大,反应的传质受阻,导致形状不均匀,甚至部分颗粒团聚.

(a)0 g (b)0.18 g

(c)0.35 g (d)0.50 g图3 不同CTAB用量下的磷化锡(Sn4P3)空心球的透射电镜照
2.3.2反应时间对Sn4P3形貌和尺寸的影响
通过实验发现反应时间对Sn4P3空心球的形成也有重要的影响.为了研究反应时间对空心结构形成的影响,通过保持其它实验条件不变,只改变反应时间这个条件,做了一系列的对比实验.
图4所示为反应温度为180 ℃时,不同反应时间条件下得到的产品的TEM图片.图4(a)是体系恒温反应6 h的透射电镜图片.从图4(a)中可以看出,一些不规则的颗粒团聚形成较大的固体颗粒,这些生成的颗粒接近于球形.当反应时间延长至10 h时,如图4(b)所示,大量的实心球生成,球的直径约为500 nm,产物不是很分散,有些团聚.随着反应时间延长到16 h时,大量的空心球完全形成,当反应时间继续增加到24 h时,伴随着空心球结构的减少,大量的颗粒生成.因此,时间对于Sn4P3空心球的形成有着重要的影响.通过上述实验,可以确定最佳反应时间是16 h.

(a)6 h (b)10 h

(c)16 h (d)24 h图4 不同反应时间条件下所制备Sn4P3的透射电镜图片
2.4 溶剂热合成Sn4P3机理的初步分析
基于上述的实验研究,可以推测出Sn4P3空心球的形成机理,生长过程依赖于Ostwald熟化机理,而且随着反应时间的增加,经历了从实心球向空心球转变的过程.Sn4P3空心球的形成过程类似于以往文献中的报道[23].首先,NaBH4将溶液中的Sn2+还原成为Sn单质,新生成的Sn单质立即与白磷作用生成Sn4P3中心核,接着生成的Sn4P3中心核继续自组装生成实心球,在Ostwald熟化时期,由于表面能的不同,内部的实心球逐渐被分解,并且被外围的粒子所覆盖,同时实心球逐渐转变成空心球.所以大致的反应过程如下所示:

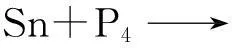


2.5 光学性质
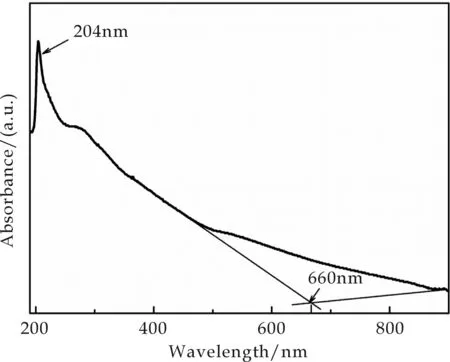
图5 磷化锡(Sn4P3)的紫外-可见吸收图谱
图5为所得产物Sn4P3空心球的紫外-可见吸收光谱图,测试所用样品为获得的样品通过乙醇超声分散后得来.分析图5可知,Sn4P3的最大吸收波长为204 nm,带宽吸收在660 nm处.
3结论
本文采用溶剂热法在180 ℃条件下成功地制备出了直径约为300~800 nm的磷化锡Sn4P3空心球.通过研究发现:十六烷基三甲基溴化铵(CTAB)的用量、温度和时间等对产品的形貌和尺寸均有一定的影响.结果显示,制备磷化锡Sn4P3空心球的最佳条件为温度180 ℃、反应时间16 h、十六烷基三甲基溴化铵(CTAB)的质量分数为0.79 %.最后对空心球的形成机理和其光学性能进行了研究探讨.
参考文献
[1] Feng L,Vrubel H,Bensimon M,et al.Easily-prepared dinickel phosphide (Ni2P) nanoparticles as an efficient and robust electrocatalyst for hydrogen evolution[J].Physical Chemistry Chemical Physics,2014,16(13):5 917-5 921.
[2] Alcantara R,Tirado J,Jumas J,et al.Electrochemical reaction of lithium with CoP3[J].Journal of Power Sources,2002,109(2):308-312.
[3] Liu S L,Yan L,Li H L.Solvothermal synthesis of flower-like Co2P nanostructures and its electrochemical performance[J].Science of Advanced Materials,2014,6(4):746-750.
[4] Liu S L,Yan L,Tong J B,et al.Synthesis of 3D flower-like Cd3P2microstructures and their optical properties[J].Micro & Nano Letters,2012,7(10):1 019-1 022.
[5] Lovingood D D,Strouse G F.Microwave induced in-situ active ion etching of growing InP nanocrystals[J].Nano Letters,2008,8(10):3 394-3 397.
[6] Zheng X,Yuan S,Tian Z,et al.Nickel/Nickel phosphide core-shell structured nanoparticles:Synthesis,chemical,and magnetic architecture[J].Chemistry of Materials,2009,21(20):4 839-4 845.
[7] Donohue P C.Synthesis,structure,and superconducting properties of new high-pressure forms of tin phosphide[J].Inorganic Chemistry,1970,9(2):335-337.
[8] Eckerlin P,Kischio W.Darstellung und Kristallstruktur der Phasen“Sn4P3” und “Sn4As3”[J].Zeitschrift Für Anorganische und Allgemeine Chemie,1968,363(1-2):1-9.
[9] Gullman J.The crystal structure of SnP[J].Journal of Solid State Chemistry,1990,87(1):202-207.
[10] Olofsson O.X-ray investigation of the tin-phosphorus system[J].Acta Chem Scand,1970,24(4):1 153-1 162.
[11] Wu J J,Fu Z W.Pulsed-laser-deposited Sn4P3electrodes for lithium-ion batteries[J].Journal of the Electrochemical Society,2009,156(1):22-26.
[12] Liu S L,Li S,Li M M,et al.Synthesis of tin phosphides (Sn4P3) and their high photocatalytic activities[J].New Journal of Chemistry,2013,37(3):827-833.
[13] Haggstrom L,Gullman J,Ericsson T,et al.Mössbauer study of tin phosphides[J].Journal of Solid State Chemistry,1975,13(3):204-207.
[14] Binions R,Blackman C S,Carmalt C J,et al.Tin phosphide coatings from the atmospheric pressure chemical vapour deposition of SnX4(X= Cl or Br) and PRxH3-x(R=Cyc hex or phenyl)[J].Polyhedron,2002,21(19):1 943-1 947.
[15] Xie Y,Su H,Li B,et al.Solvothermal preparation of tin phosphide nanorods[J].Materials Research Bulletin,2000,35(5):675-680.
[16] Zhou W,Yang H,Shao S,et al.Superior high rate capability of tin phosphide used as high capacity anode for aqueous primary batteries[J].Electrochemistry Communications,2006,8(1):55-59.
[17] Lu Y,Tu J P,Xiong Q Q,et al.Large-scale synthesis of porous Ni2P nanosheets for lithium secondary batteries[J].Cryst Eng Comm,2012,14(24):8 633-8 641.
[18] Liu S L,Li S,Wang J,et al.Surfactant-assisted synthesis and electrochemical performances of Cu3P dendrites[J].Materials Research Bulletin,2012,47(11):3 352-3 356.
[19] Wang X,Wan F,Gao Y,et al.Synthesis of high-quality Ni2P hollow sphere via a template-free surfactant-assisted solvothermal route[J].Journal of Crystal Growth,2008,310(10):2 569-2 574.
[20] Zhang H,Feng Y,Zhang Y,et al.Peapod-like composite with nickel phosphide nanoparticles encapsulated in carbon fibers as enhanced anode for Li-Ion batteries[J].Chem Sus Chem,2014,7(7):2 000-2 006 .
[21] Liu S L,Qian Y T,Xu L Q.Synthesis and characterization of hollow spherical copper phosphide (Cu3P) nanopowders[J].Solid State Communications,2009,149(11):438-440.
[22] 金盈,吴友吉,陶锋.硫化铋纳米晶的水热合成及表征[J].安徽工程科技学院学报(自然科学版),2010,25(3):9-11.
[23] Su H,Xie Y,Li B,et al.A novel one-step solvothermal route to nanocrystalline Sn4P3[J].Journal of Solid State Chemistry,1999,146(1):110-113.
【责任编辑:蒋亚儒】
Synthesis,characterization and property of
Sn4P3hollow nanospheres
LIU Shu-ling, ZHANG Hong-zhe, TONG Jian-bo
(College of Chemistry and Chemical Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:In this article,the Sn4P3hollow nanospheres were prepared through a solvothermal method,SnCl2·2H2O was used as the main raw material,using ethylene glycol (EG) as the solvent, and cetyl trimethyl ammonium bromide (CTAB) as the surfactant.The as-obtained samples were characterized by means of the X-ray powder diffraction (XRD),scanning electron microscopy (SEM) and transmission electron microscopy (TEM).The results show that the as-prepared products with pure hexagonal phase were hollow nanospheres and the diameter was about 300~800 nm.In addition, the effects of reaction temperature,reaction time and the amount of surfactant were studied.It was found that the optimum reaction condition were that the amount of cetyl trimethyl ammonium bromide was 0.79%,reaction temperature was 180 ℃ and reaction time was 16 h.Finally, the optical property was investigated by the UV-Vis spectroscopy (UV-Vis).
Key words:Sn4P3; hollow nanospheres; solvothermal
中图分类号:O611.4; TQ110.3
文献标志码:A
文章编号:1000-5811(2016)01-0086-04
作者简介:刘淑玲(1974-),女,山西大同人,副教授,博士,研究方向:功能纳米材料合成
基金项目:国家自然科学 (21301113)
收稿日期:*2015-11-16

