HPLC法测定通络降脂胶囊中总黄酮醇苷的含量
倪玉佳,吴晓燕,金 婷,瞿发林
HPLC法测定通络降脂胶囊中总黄酮醇苷的含量
倪玉佳,吴晓燕,金婷,瞿发林*
[摘要]目的建立以高效液相色谱法测定通络降脂胶囊中总黄酮醇苷含量的方法。方法色谱柱为Lichrospher C18(150 mm×4.6 mm,5 μm),流动相为甲醇-0.4%磷酸-乙腈(39∶56∶5),流速为1.0 mL/min,检测波长为360 nm,进样量20 μL,柱温为30 ℃。结果槲皮素、山柰素、异鼠李素分别在4.548×102~4.548×103ng、3.46×102~3.46×103ng、65.6~656 ng进样量范围内呈良好的线性关系(r=0.999 9、r=0.999 8、r=0.999 2,n=5),平均加样回收率分别为101.0% (RSD=1.90%)、97.2% (RSD=1.66%)、97.8% (RSD=1.86%)。结论所建立的方法简便、准确、重复性好,可用于通络降脂胶囊中总黄酮醇苷的含量测定。
[关键词]通络降脂胶囊;高效液相色谱法;槲皮素;山柰素;异鼠李素
[Abstract]ObjectiveTo establish an HPLC method for the determination of total flavonoid glycoside in tongluojiangzhi capsules.MethodsThe method was used with the chromatographic conditions of a Lichrospher C18column and methanol-0.4% phosphoric acid-acetonitrile (39∶56∶5) as the mobile phase,the flow rate was 1.0 mL/min,the column temperature was 30 ℃ and the detection wavelength was 360 nm.ResultsThe linear ranges of quercetin,kaempferol and isorhamnetin were 4.548×102~4.548×103ng (r=0.999 9,n=5),3.46×102~3.46×103ng (r=0.999 8,n=5),65.6~656 ng (r=0.999 2,n=5),respectively.The average recoveries of quercetin,kaempferol and isorhamnetin were respectively 101.0%,97.2%,97.8%.ConclusionThe method is simple,accurate and specific,which can be used for the determination of total flavonoid glycoside in tongluojiangzhi capsules.
收稿日期:2015-02-10
DOI:10.14053/j.cnki.ppcr.201510027
Determination of total flavonoid glycoside in tongluojiangzhi capsules by HPLCNI Yu-jia,WU Xiao-yan,JIN Ting,QU Fa-lin*(The 102ndHospital of PLA,Changzhou 213003,China)
Key words:Tongluojiangzhi capsules;HPLC;Quercetin;Kaempferol;Isorhamnetin
0引言
通络降脂胶囊为我院非标准制剂,是由银杏叶提取物、绞股蓝总皂苷制成的复方制剂,具有活血化瘀、通络降脂的功效。银杏叶中的主要活性成分为黄酮类化合物和萜类内酯化合物[1]。药理研究表明,黄酮类化合物具有扩张血管、抗氧化、抗肿瘤和抑制血小板活化因子等作用[2]。黄酮类化合物也是评价银杏生药及其相关制剂质量好坏的重要指标[3]。目前黄酮类化合物的含量测定主要有络合分光光度法[4-5]、双波长吸光光度法[6]、荧光分光光度法[7]、紫外分光光度法[8-9]、高效液相色谱法[10-11]等,其中高效液相色谱法应用最多。通络降脂胶囊中总黄酮的含量测定现采用比色法,即以芦丁为对照品,根据黄酮在碱性条件下与铝离子形成络合物的原理测定其吸收度。但因络合物遇光不稳定,使测量结果误差大;且芦丁水解产物仅为槲皮素,但银杏叶提取物中黄酮苷类化合物水解产物有槲皮素、山柰素及异鼠李素等黄酮苷元,若仅以单一槲皮素含量来评价总黄酮醇苷的含量不够准确。故本文参考文献[12]以槲皮素、山柰素以及异鼠李素为测定指标,采用高效液相色谱法测总黄酮醇苷的含量,较比色法更能准确反映通络降脂胶囊的质量。
1仪器与试药
1.1仪器Waters系列高效液相色谱仪,WatersCapLC2487双λ吸光度检测器,Empower2数据处理系统(美国Waters公司);FA1004电子天平(上海精密科学仪器有限公司·天平仪器厂);XS105分析天平(梅特勒-托利多仪器有限公司);KH2200DB型数控超声波清洗器(昆山禾创超声仪器有限公司);电热恒温水浴锅(上海医疗器械五厂)。
1.2试药槲皮素、山柰素、异鼠李素对照品(购自中国食品药品检定研究院,批号:100081-200907、110861-201209、110860-201109,供含量测定用),绞股蓝(浙江惠松制药有限公司购入,批号:130805,含量:98%),通络降脂胶囊(解放军第102医院制剂中心自制,批号:20141212、20140813、20140212,规格:0.2 g/粒);甲醇与乙腈为色谱纯,水为纯化水,磷酸与盐酸为分析纯。
2方法与结果
2.1色谱条件色谱柱:Lichrospher C18(150 mm×4.6 mm,5 μm);流动相:甲醇-0.4%磷酸-乙腈(39∶56∶5);流速:1.0 mL/min;检测波长:360 nm;进样量:20 μL;柱温:30 ℃。
2.2溶液的制备
2.2.1对照品储备液分别精密称取槲皮素、山柰素、异鼠李素对照品11.37、8.65、1.64 mg置50 mL量瓶中,加甲醇定容,即得。
2.2.2对照品溶液精密量取对照品储备液2 mL,置10 mL量瓶中,甲醇定容,用有机滤膜(0.45 μm)滤过,弃去初滤液,即得。
2.2.3供试品溶液取本品10粒,精密称重,倒出其内容物,研细混匀,精密称取胶囊内容物0.404 3 g,置具塞锥形瓶中,精密加入甲醇20 mL,密塞,称定重量,超声处理20 min,取出,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液10 mL,置100 mL锥形瓶中,加甲醇10 mL、25%盐酸溶液5 mL,摇匀,置水浴中加热回流30 min,迅速冷却至室温,转移至50 mL量瓶中,加甲醇稀释至刻度,摇匀,用有机滤膜(0.45 μm)滤过,取续滤液,即得。
2.2.4阴性样品溶液按处方组成制备不含绞股蓝皂苷的通络降脂胶囊,按“2.2.3”项下方法制得阴性样品溶液。
2.3专属性试验取对照品溶液、供试品溶液和阴性样品溶液,按“2.1”项下色谱条件测定,得HPLC图。结果表明,处方中其他成分对测定槲皮素、山柰素、异鼠李素没有干扰,见图1。
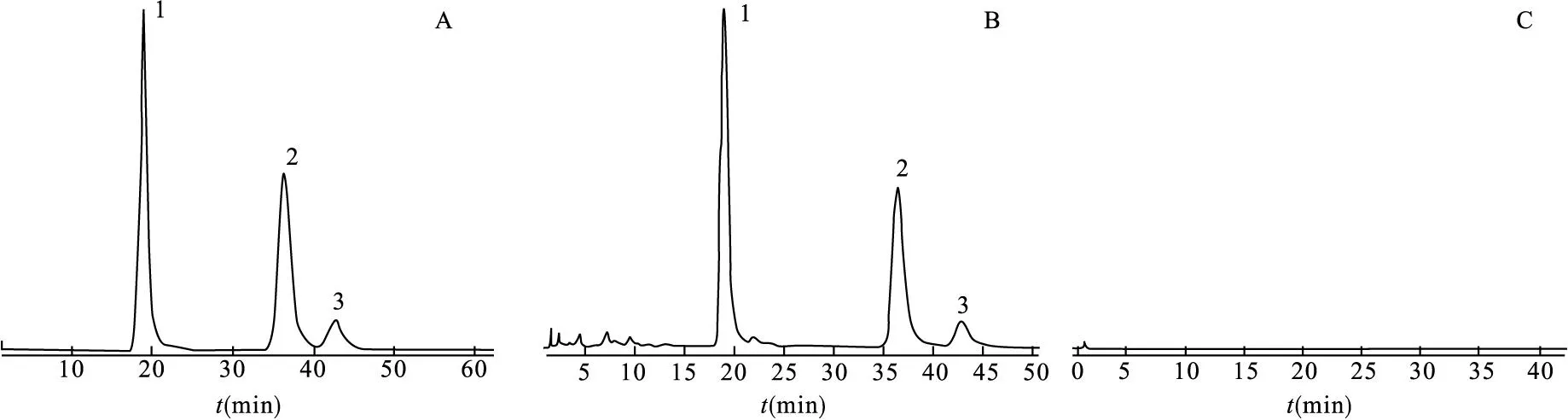
图1 高效液相色谱图
2.4线性关系考察分别精密量取对照品储备液1、2、3、5、10 mL置10 mL量瓶中,甲醇定容,制成不同浓度的对照品溶液。按“2.1”项下色谱条件依次进样,以进样量为横坐标、峰面积为纵坐标,以最小二乘法进行线性回归,得槲皮素回归方程Y=1.38×109X-5.78×106,r=0.999 9 (n=5);山柰素回归方程Y=1.46×109X-4.4×106,r=0.999 8 (n=5);异鼠李素回归方程Y=1.53×109X-3.89×106,r=0.999 2 (n=5)。结果表明,槲皮素、山柰素、异鼠李素分别在4.548×102~4.548×103ng、3.46×102~3.46×103ng、65.6~656 ng进样量范围内呈良好的线性关系。
2.5精密度试验按“2.2.3”项制备供试品溶液,然后量取供试品溶液,按“2.1”项下色谱条件重复进样6次,测得槲皮素、山奈素及异鼠李素的平均峰面积和RSD分别为3 169 850,0.93%;2 521 532,1.61%;339 294,1.34%。结果表明供试液精密度良好。
2.6稳定性试验按“2.2.3”项制备供试品溶液,然后量取供试品溶液,分别于0、3、6、9、12、15 h后按“2.1”项下色谱条件进样,记录峰面积,测得槲皮素、山奈素及异鼠李素平均峰面积和RSD分别为3 166 873,0.85%;2 503 003,1.38%;342 459,1.44%。结果表明,供试液稳定性良好。
2.7重复性试验取同批号样品(批号:20140212)6份,按“2.2.3”项下方法制备供试品溶液,同法测得槲皮素、山柰素、异鼠李素含量的RSD分别为1.87%、1.75%、1.66%。结果表明,供试液重复性良好。
2.8回收率试验精密称定已知含量的供试品(批号:20140212)9份,每份约0.2 g,按表1精密加入对照品,按“2.2.3”项下方法制备供试液,同法测定,测得槲皮素平均回收率为101.0%,RSD为1.90%;山柰素平均回收率为97.2%,RSD为1.66%;异鼠李素平均回收率为97.8%,RSD为1.86%。见表1。

表1 加样回收率测定结果(n=9)
2.9样品含量测定见表2。
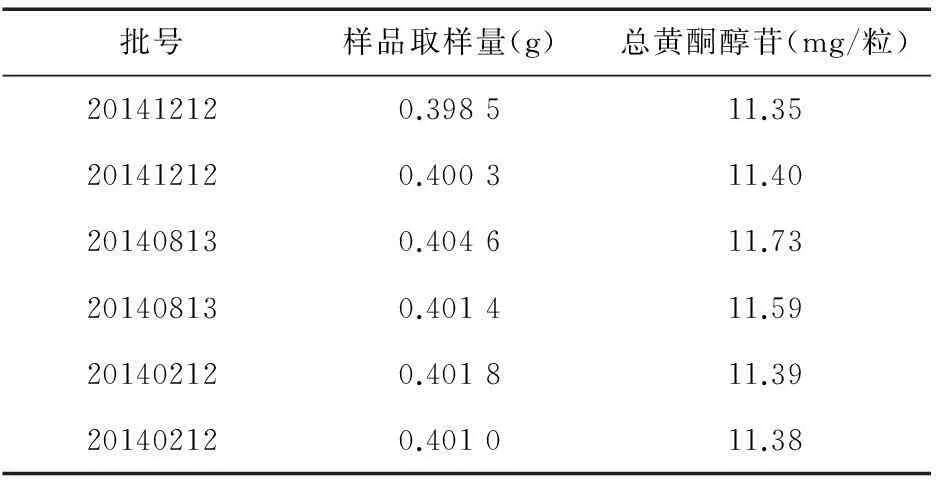
表2 样品含量测定结果(n=3)
3讨论
笔者分别选择了甲醇-0.4%磷酸水溶液(45∶55)[13]、甲醇-0.4%磷酸水溶液(50∶50)[14-15]、甲醇-0.4%磷酸水溶液(52∶48)[12]、甲醇-0.4%磷酸水溶液(55∶45)[16-17]、甲醇-0.4%磷酸水溶液(68∶32)、甲醇-水(50∶50)(用磷酸调pH值为2.5)[18]上述6种流动相进行流动相的筛选,都不能使三者完全分离,但从试验中观察到,随着流动相中甲醇比例的降低,分离度逐渐增大,当甲醇-0.4%磷酸比例达到40∶55时能较好分离,但保留时间较长,故在此基础上适当加入乙腈以缩短保留时间,同时微调流动相比例使三者达到完全分离,最后选用甲醇-0.4%磷酸-乙腈(39∶56∶5)为流动相,三者完全分离、峰形完好且无拖尾现象。
参考文献:
[1]曾献,喻林华.银杏叶的生物活性成分及其在功能性食品中的应用[J].中国西部科技,2007,12:22-26.
[2]朱红,高尔,王德伟,等.银杏黄酮的药学研究进展[J].食品与药品,2005,7(2A):4-7.
[3]张敏,曹庸,唐纯翼,等.Al3+-芦丁二元络合物荧光光度法测定银杏叶中总黄酮的含量[J].分析科学学报,2005,21(2):188-190.
[4]雷天乾,叶新兰,项立红,等.银杏叶及提取物总黄酮含量测试方法研究[J].中国医药工业杂志,2002,33(2):70-71.
[5]上官小东,王党社.ALC13-分光光度法测定银杏黄酮的含量[J].宝鸡文理学院学报:自然科学版,2004,24(2):273-275.
[6]程亚倩,陶月良,张锋,等.双波长吸光光度法测定植物中黄酮含量[J].理化检验:化学分册,2002,38(1):21.
[7]郭玉梅,杨景和,吴霞.银杏叶提取物中总黄酮含量的分析方法研究[J].山东大学学报:理学版,2009,44(5):40-44.
[8]王严国,许勇,凌娟,等.紫外分光光度法测定复方银杏叶胶囊总黄酮含量[J].东南国防医药,2005,7(3):206-207.
[9]王卫华,彭婷婷,晁建敏,等.紫外分光光度法测定银杏叶中总黄酮的含量[J].菏泽医学专科学校学报,2011,23(2):16-17.
[10]齐惠珍,周霞瑾,王明霞.高效液相色谱法3种不同剂型银杏叶制剂总黄酮醇苷含量测定[J].河北中医,2013,35(5):752-753.
[11]吴凯,李璐,张庆伟.银杏叶提取物注射液总黄酮苷含量测定方法的研究[J].药品评价,2010,7(24):11-16.
[12]李小燕,潘洪平.高效液相色谱法测定复方银杏叶片中总黄酮的含量[J].时珍国医国药,2007,18(7):1599-1600.
[13]罗瑛,高秋芳.高效液相色谱法测定银杏磷脂胶囊中总黄酮醇苷的含量[J].中外健康文摘(临床医药版),2007,4(10):16-17.
[14]宋伟峰,李瑞明.HPLC测定银杏叶茶中总黄酮的含量[J].中国中医药现代远程教育,2011,9(2):213-214.
[15]余启荣,晏利芝,谭湘湘.HPLC法测定银杏叶提取物中总黄酮醇苷的含量[J].首都师范大学学报(自然科学版),2009,30(2):32-34.
[16]吴凯,李璐,张庆伟.银杏叶提取物注射用总黄酮醇苷含量测定方法的研究[J].药品评价,2010,7(24):11-16.
[17]郑启波.银杏叶提取物总黄酮含量分析方法的研究[J].哈尔滨医药,2011,31(6):418-419.
[18]叶秀波,岑帼英,李瑞明.HPLC法测定银杏叶软胶囊中总黄酮的含量[J].中国医药导报,2010,7(33):29-30.
作者单位:湖南省儿童医院,长沙 410007

