非诺贝特片和胶囊的溶出度评价
非诺贝特片和胶囊的溶出度评价
赵婷1,余晓娟2,耿东升3*
(1.新疆医科大学,乌鲁木齐830054;2.新疆军区第五干休所,乌鲁木齐830002;3.新疆军区联勤部药品仪器检验所,乌鲁木齐830063)
摘要:目的利用光纤药物溶出度仪(FODT-601)实时测定非诺贝特片(胶囊)的溶出度,并通过比较溶出曲线评价其制剂工艺和内在质量的差异。 方法采用FODT-601仪,以《中国药典》2010年版规定的溶出度测定条件实时监测非诺贝特制剂的溶出曲线;并采用直观分析、Weibull分布模型拟合以及f2相似因子法比较不同剂型、不同厂家、不同批号间的溶出曲线。 结果《中国药典》2010年版规定非诺贝特片及胶囊溶出度标准是:60 min时取样,其限度为标示量的60%,所选的所有药物均在20 min时就满足其限度规定。非诺贝特片与胶囊原创厂家的溶出行为较为一致,但国产厂家的非诺贝特片与胶囊溶出行为不一致;非诺贝特片国产厂家的溶出行为与原创厂家溶出行为差异较大,但非诺贝特胶囊国产厂家的溶出行为与原创厂家溶出行为较为一致;Weibull分布模型拟合法和f2相似因子法评价结果基本一致。 结论用FODT-601仪测定非诺贝特制剂,操作简单,得到的数据信息完整,其溶出曲线用Weibull分布模型或f2相似因子法评价均可。
关键词:非诺贝特片;非诺贝特胶囊;溶出曲线;光纤溶出度实时测定法
doi:10.3969/j.issn.1004-2407.2015.03.016
中图分类号:R944
文献标志码:A
文章编号:1004-2407(2015)03-0270-05
Abstract:ObjectiveThe dissolution parameters of Fenofibrate Tablets and Capsules were determined with fiber optic medicament dissolution rate real time test instrument (FODT-601), and its preparation process and inner quality difference were evaluated through the comparison of the dissolution curves. Methods The FODT-601 meter to real-time monitor was used to determine the dissolution of fenofibrate under the dissolution determination conditions of Chinese Pharmacopoeia 2010. Visual analysis, Weibull distribution model fitting and f2 similarity factor method were used to evaluate the different types, different manufacturers, and different batches′dissolution curves. ResultsChinese Pharmacopoeia 2010 edition requests the dissolution is 60% of the labeled amount at 60 min. All drugs tested met the specified limits at the time of 20 min.Fenofibrate Tablets and Capsules dissolution behavior of the original manufacturer was consistent, but dissolution behavior of Fenofibrate Tablets and Capsules for domestic manufacturers was inconsistent. Fenofibrate Tablets of original manufacturer and domestic manufacturers were different. The evaluation results of Weibull distribution model fitting and f2 similarity factor method were basically identical. Conclution Using FODT-601 meter to measure the dissolution of fenofibrate preparation is simple, and the data information is complete. The evaluation of dissolution curve with the Weibull distribution model is same to the f2 similarity factor method.
基金项目:新疆维吾尔自治区自然科学基金(编号:2013211A119)
作者简介:赵婷,女,硕士研究生
收稿日期:(2014-10-28)
Invitroevaluation of dissolution of Fenofibrate Tablets and Capsules
ZHAO Ting1, YU Xiaojuan2,GENG Dongsheng3*(1.Xinjiang Medical University, Urumqi 830054,China; 2. the Fifth Retired Cadres of Xinjiang Military Region; 2.Xinjiang Military Region Lianqinbu Medicine Instrument Institute, Urumqi 830063,China)
Key words: Fenofibrate Tablets; Fenofibrate Capsules; dissolution curve;optical fiber dissolution real-time measurement
*通信作者:耿东升,男,主任药师
非诺贝特(fenofibrate)为第二代苯氧芳酸类药物,与吉非贝齐、苯扎贝特同属于贝特类调脂药物,于1998年在美国开始上市,在临床上得到了广泛应用[1]。非诺贝特片(胶囊)的体外溶出度检测是评价其临床疗效的重要指标之一,本实验采用光纤药物溶出度实时测定仪(fiber-opic in situdissolution testing,FODT)[2-3]对不同厂家、不同批号的非诺贝特片与胶囊在线实时监测,旨在探讨《中国药典》2010年版有关非诺贝特片和胶囊溶出限度的合理性及溶出行为的评价方法,以期为其仿制药的质量控制提供理论依据。
1仪器与试药
1.1仪器光纤药物溶出度实时测定仪(FODT-601,新疆富科思分析仪器有限公司);梅特勒电子天平(AG285,梅特勒-托利多仪器(上海) 有限公司);紫外分光光度仪(UV-2450,日本岛津制作所)。
1.2试药非诺贝特对照品(中国食品药品检定研究院提供,批号100733-200401,含量99.9%);进口非诺贝特片(法国利博福尼制药公司, 规格0.16 g,批号19877,标注为A);国产非诺贝特片(上海信宜万象药业股份有限公司,规格0.1 g,批号110504,110602,09120902,标注为B1,B2,B3;江苏神龙药业有限公司,规格0.1 g,批号110907, 标注为C);进口非诺贝特胶囊(法国利博福尼制药公司, 规格0.2 g,批号18858,19285,20271, 标注为D1,D2,D3);国产非诺贝特胶囊(广东先强药业有限公司,规格0.1 g,批号120804,130105,130107,标注为E1,E2,E3;北京京丰制药有限公司,规格0.1 g,批号120901, 130102, 130403,标注为F1,F2,F3);溶出用水为经脱气的蒸馏水;其他试剂均为分析纯。
2方法与结果
2.1储备液的制备分别精密称取非诺贝特对照品150.00,200.03,295.94和320.08 mg,置于250 mL量瓶中,加少量无水乙醇溶解,加溶出介质[10 g·L-1的十二烷基硫酸钠溶液(SDS)]稀释定容至刻度,摇匀,依此得到质量浓度为0.600 0,0.801 2,1.183 8和1.280 3 mg·mL-1的储备液。
2.2检测波长及光程的选择称取非诺贝特对照品约16.644 mg,加少量无水乙醇溶解,加入10 g·L-1的SDS稀释至50 mL,吸取25 mL,用10 g·L-1的SDS稀释至50 mL,相当于非诺贝特片溶出104.02 %时的质量浓度,以10 g·L-1的SDS为空白,于UV-2450上扫描其紫外吸收光谱,结果显示,在206 和290 nm处有强吸收峰,在550 nm处无吸收。考虑到FODT仪的波长范围为220~600 nm,选择290 nm作为测定波长, 550 nm作为参比波长(参比波长可消除溶液中辅料的干扰)。根据L-B定律和仪器有效吸光度范围,选择2 mm规格探头。
2.3溶出度实验条件按照《中国药典》2010年版(二部)规定的非诺贝特片(胶囊)溶出度测定条件:采用桨法;转速:100 r·min-1(非诺贝特片),120 r·min-1(非诺贝特胶囊);溶出介质:10 g·L-1的十二烷基硫酸钠溶液(取10 g十二烷基硫酸钠,加水至1 000 mL);溶出体积:1 000 mL;温度:36.5~37.5 ℃。
2.4标准曲线的建立精密量取2.1项下对照品储备液适量,分别用10 g·L-1的SDS稀释,制成含非诺贝特约20~250 μg·mL-1的不同质量浓度的系列标准溶液,摇匀。将该系列标准溶液分别加入1~6 号10 mL烧杯中,六根光纤探头同时浸入标准溶液中,扫描系列标准溶液得到吸收光谱,并采集得到在各通道测定各组溶液的吸光度,以溶出百分比C与吸光度A进行线性回归,结果见表1。结果表明,在20~250 μg·mL-1范围内线性关系良好。
表1实时测定线性方程及相关系数
Tab.1 The real-time equations and correlation coefficients

( n=7)
2.5精密度实验分别配制相当于不同规格非诺贝特片(胶囊)溶出30%,50%和80%的系列非诺贝特对照品溶液,采用FODT-601仪测定,于1,4,7,9和12 h时,测定日内精密度,其RSD分别为1.02%,0.87%和1.23% (n= 6),说明仪器的精密度较高,实验数据可靠。
2.6回收率实验分别将A、B、D、E各1片(粒),溶于1 000 mL的10 g·L-1的SDS中,从中精密吸取25 mL,置于100 mL量瓶中,相当于溶出25%。分别精密加入溶出百分率为:①56.05 %,75.55 %和95.04%;②56.08 %,76.11 %和96.14%;③53.27%,73.98 %和94.70%;④54.00 %,75.00 %和96.00%的非诺贝特对照品,用FODT-601测定,并计算回收率。结果平均回收率分别为95.86%,96.84%,97.44%和97.39%;RSD值分别为1.10%,1.55%,0.85%和0.40% (n= 6)。
2.7溶出过程的测定及溶出曲线的直观分析采用FODT-601仪,照2.3项下溶出度实验参数,测定非诺贝特片和胶囊的实时溶出曲线及数据。记录5,10,15,20,30,45和60 min的药物累积溶出百分率,结果见表2,并以取样时间(t)-平均累积溶出量(%)做图,结果见图1,直观比较非诺贝特同一剂型不同厂家、不同规格和不同剂型的药物溶出曲线类型(形状)。结果发现:非诺贝特片原创厂家溶出速度明显快于国产厂家(A厂家片剂18 min累积药物溶出量达到了100 %,B和C厂家片剂60 min累积药物溶出量才达到100 %,A片溶出曲线类似“厂”型,反映开始溶出早,溶出快,短时间即可达到基本溶出,B和C片类似“弧”型,反映溶出缓慢,短时间不能达到基本溶出);非诺贝特胶囊原创厂家溶出速度与国产厂家具有一致性(D、E和F厂家的制剂经30 min累积药物溶出量均达到100 %, D、E和F胶囊溶出曲线类似“S”型,反映开始溶出有迟滞,之后较快溶出);同一个厂家不同批号药品的溶出速度差异较小,溶出曲线形状具有一致性。
表2不同厂家生产的非诺贝特片和胶囊的平均累积溶出百分率
Tab.2 The average cumulative dissolution amount of different manufacturer production of Fenofibrate Tablets and Capsules
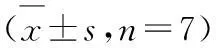

厂家不同厂家生产的非诺贝特片和胶囊不同时间(min)的平均累积溶出百分率(%)5101520304560A14.9±1.754.8±3.088.9±3.4104.9±1.8113.0±2.8113.3±1.9113.4±2.2B125.6±0.743.7±1.055.3±1.863.8±2.177.0±2.789.3±3.497.9±1.5B225.5±1.645.3±1.557.0±1.364.2±2.377.8±1.490.5±1.699.3±1.8B329.8±1.346.5±1.757.9±2.065.6±2.476.9±2.989.3±3.098.0±0.8C30.6±2.249.2±2.961.1±2.969.6±3.580.4±4.492.0±4.999.5±1.9D113.7±2.547.8±7.770.7±5.683.0±3.995.7±2.6104.4±2.2109.7±2.1D214.4±1.853.1±2.074.8±2.185.7±2.097.2±1.7105.0±1.7109.1±1.8D318.9±3.760.4±3.783.2±2.394.1±2.0104.3±1.9110.9±1.9113.5±1.5E13.4±0.630.3±8.671.0±8.495.1±3.8108.8±1.9111.5±2.1112.1±1.8E24.5±0.940.9±9.371.1±6.887.4±4.0100.0±2.4105.9±2.3108.0±2.1E39.1±1.852.1±6.882.3±5.093.6±4.7102.6±4.3107.2±3.9109.1±3.5F113.3±2.656.0±4.481.9±2.293.6±2.7102.0±2.4106.5±3.2109.3±2.8F213.5±3.352.8±5.578.4±2.990.4±2.5101.7±2.1107.1±1.5108.6±1.9F312.7±2.551.3±8.576.9±4.388.6±3.199.3±2.6105.0±2.9107.0±2.2

图1不同厂家、不同剂型、不同批号非诺贝特片与胶囊的溶出曲线比较
Fig.1 Comparison of fenofibrate dissolution curve of different types, different manufacturers, different batches
2.8非诺贝特片与胶囊溶出曲线、溶出参数的评价和比较
2.8.1Weibull分布模型拟合与参数提取根据Weibull分布模型[4],计算体外溶出参数t50(溶出50%的时间),td(药物溶出63.2%的时间),m(形状参数),并对其进行独立设计资料的t检验,结果见表3。结果:非诺贝特片国产厂家开始溶出无时间迟滞,其余厂家制剂开始溶出均有时间迟滞。不同厂家非诺贝特胶囊的m(形状参数),td(min)和t50(min)值差异均无统计学意义(P>0.05);不同剂型的非诺贝特片和胶囊的原创厂家的m(形状参数),td(min)和t50(min)值差异均无统计学意义(P>0.05);非诺贝特片原创厂家和国产厂家的m(形状参数),td(min)和t50(min)值差异均有统计学意义(P<0.05);国产厂家的非诺贝特片和胶囊的m(形状参数),td(min)和t50(min)值差异均有统计学意义(P<0.05)。
表3非诺贝特片(胶囊)体外溶出参数
Tab.3 Dissolution parameters of Fenofibrate Tablets (Capsules)invitro

± s, n=14)
注:τ为位置参数,也称滞留时间,τ=0时,说明药物制剂溶出无时间延滞,τ>0时,说明溶出有时间延迟;m为形状参数,决定所拟合曲线的形状;t0称为尺度参数,表示时间的尺度。
2.8.2相似因子f2评价溶出曲线的相似性实验通过对各时间点变异系数的比较,受试制剂与参比制剂在各时间点均满足以下要求:除0时外,第1个时间点的变异系数未超过20%,从第2个时间点至最后1个时间点溶出结果的变异系数未超过10%;参比制剂与受试制剂含量差异未超过5%。因此,可以使用f2相似因子法作为模型比较其溶出曲线相似性,并以f2因子在50~100范围内则溶出曲线相似为标准。分别以A和D为参比制剂,按2.7项下的实验方法,选取5,10,15和20 min的溶出数据,采用f2相似因子法[5]对供试厂家药品B、C、E和F进行统计分析和比较,结果见表4。
由于非诺贝特片的原研厂制剂A在15 min以内平均溶出率达85%以上,则无需进行曲线比较,而此时,仿制制剂亦应满足此条件,但经测定,仿制制剂B1、B2、B3和C在15 min以内平均溶出率均未达到85%以上,可见非诺贝特片的两个国产厂家的溶出过程与原研厂家的溶出过程不相似。非诺贝特胶囊的原研厂制剂D在15 min内平均溶出率未达85%以上,则需进行溶出过程比较。同一剂型不同厂家对比发现:非诺贝特胶囊原创厂家和国产制剂的溶出曲线相似(只有E1与原创厂家的溶出曲线不相似,考虑到批间差异,可忽略);不同剂型对比结果发现:非诺贝特片和胶囊的原创厂家溶出曲线相似,国产厂家溶出曲线不相似。
表4不同时间点的累积溶出率的相似因子的统计结果
Tab.4 The statistical results of cumulative dissolution rate by similar factors analysis at different time points

厂家Q值f2值相似性Q值f2值相似性D-E1784.842.6 不相似B3-E12001.332.5不相似D-E2316.652.4相似B3-E21320.937.0不相似D-E3118.762.8相似B3-E31839.233.4不相似D-F178.767.1相似B3-F11722.034.1不相似D-F218.281.4相似B3-F21340.736.8不相似D-F316.382.3相似B3-F31205.538.0不相似D-A162.256.5相似
3讨论
非诺贝特为难溶性药物,《中国药典》2010年版规定非诺贝特片及胶囊溶出度标准是60 min时取样,其限度为标示量的60%,所选的所有药物均符合规定。本实验通过FODT-601仪分别实时测定非诺贝特片(胶囊)原创厂家不同批号以及2个国产厂家不同批号的溶出度,发现非诺贝特片原创厂家在15 min平均溶出率达到88.9%±3.4%,而国产厂家15 min平均溶出率才达到57.8%±2.0%,40 min平均溶出率才达到85%,故怀疑国产厂家是否在制定溶出限度时只是为做溶出度而做溶出度,不为疗效只为合格;非诺贝特胶囊的原创和国产厂家在15 min平均溶出率就可以达到76.9%±3.7%,故考虑是否应该提高药典的溶出限度。
溶出曲线的评价方法很多,本文仅使用目前应用最多、使用最广的非模型依赖法——相似因子法和模型依赖法——Weibull分布模型拟合法进行非诺贝特片和胶囊溶出曲线的评价, Weibull分布模型拟合法能用几个可统计比较的参数来描述溶出曲线,较好地拟合和提供溶出度数据,使数据的分析和解释变得容易,但只能进行描述而不能充分地突出药物的溶出动力学性质,没有与药物的溶出速率相关联的参数,不能用于评价体内体外相关性 。相似因子法便于计算,可直接对溶出数据进行分析,无需模型拟合,但该法缺乏统计学依据,只使用各时间点均值,未考虑溶出值变异性以及溶出值与时间的相关性,且f2值易受溶出度取样时间和点数的影响。本文用Weibull分布模型拟合法与相似因子法的判定结果基本一致,因此在非诺贝特片和胶囊的溶出曲线评价时这两种方法均可采用。
按照现有的药物质量标准检验,操作复杂,只检测终点溶出值,无法发现其间的差别,而FODT采用原位过程监测,操作简单,所得数据信息完整,反映了药物在体外溶出的全过程,实现了药物固体制剂溶出度体外测定的自动化分析[6],故应当使其尽早地应用于药品质量检验中。但由于不同厂家药物以及同一厂家不同批号药物的实时溶出行为均可能存在较大差异,如作为一种标准方法收载入药典,并应用于具体药物品种的溶出度测定,应深入实验和比较研究,并统一溶出度的评价指标和方法。
总之,我们有必要改进溶出度评价方法,以及药典的限度要求,全面分析和比较药物的溶出曲线,才能有效地控制固体制剂的质量。本实验结果可为新药典非诺贝特和胶囊溶出度的测定提供实验基础和理论参考,并为临床合理用药提供理论依据。
参考文献:
[1]余俊先,杨春秀,王曼丽,等. 非诺贝特胶囊人体相对生物利用度[J].中国药学杂志,2008,43(15):1175-1178.
[2]张奇洲,陈坚,孔彬,等.过程分析比较不同厂家盐酸吡格列酮片的溶出度[J].西北药学杂志,2008,23(1):41-42.
[3]魏立平,徐闯,武向峰,等. 过程分析比较不同厂家盐酸吡格列酮片的溶出度[J].药物分析杂志,2010,30(3):518-521.
[4]锦辉,刘昌孝.固体药物制剂的体外溶出度的统计学评价分析[J].中国药学杂志,2000,35(2):130-131.
[5]宋英,宋崎,周小初,等. 穿心莲滴丸中穿心莲内酯的体外溶出度研究[J].中国实验方剂学杂志,2008,14(10):10-12.
[6]耿东升.兰建国.陈明.光纤药物溶出仪实时测定布洛芬片溶出度的研究[J].西北药学杂志,2009,24(5):393-395.

