液体甲醛胁迫下天竺葵叶片甲醛代谢途径对甲醛吸收的贡献作用
液体甲醛胁迫下天竺葵叶片甲醛代谢途径对甲醛吸收的贡献作用
韩双, 肖素勤, 孙振, 轩秀霞, 李昆志, 陈丽梅*
(昆明理工大学生命科学与技术学院生物工程技术研究中心,昆明650500)
摘要通过2 mmol/L H13CHO溶液处理天竺葵叶片4、24和48 h,以及用2、4和6 mmol/L HCHO溶液处理天竺葵叶片4 h,13C-NMR分析H13CHO在天竺葵叶片内的具体代谢途径及主要代谢途径对甲醛吸收的贡献。在时间梯度处理中,天竺葵叶片枸橼酸(citric acid,Cit)的含量一直处于上升趋势,在处理48 h后,其相对信号积分达到未处理天竺葵叶片(control,CK)的4.54倍。13C-糖类物质[U-13C]葡萄糖(glucose,Gluc)和[U-13C]果糖(fructose,Fruc)的含量在处理的前4 h下降再上升,最后为CK的1.72和1.94倍。在浓度梯度处理中,Cit的含量随HCHO浓度增大而明显上升,最后为CK的7.58倍,13C-糖类物质[U-13C]Gluc和[U-13C]Fruc的含量随HCHO浓度增大先大幅下降后稍有上升,最后为CK的0.15和0.2倍。结合天竺葵的HCHO吸收曲线,表明在甲醛胁迫的早期(0~24 h),叶片中起作用的主要甲醛代谢途径是从甲醛产生Cit的途径;在胁迫后期(24~48 h),叶片中产生Cit的途径和13C-糖类物质[U-13C]Gluc和[U-13C]Fruc合成途径同时起作用,使这个时期内叶片从溶液中吸收甲醛量显著增加。在这一时期可能还有部分[U-13C]Gluc和[U-13C]Fruc流入糖酵解或三羧酸(tricarboxylic acid,TCA)循环使有机酸的信号峰增强。综上可知,天竺葵主要通过Cit和糖类物质([U-13C]Gluc和[U-13C]Fruc)合成途径来代谢液体甲醛。
关键词天竺葵; 甲醛代谢途径; 液体甲醛胁迫; 甲醛吸收
中图分类号Q 946.92文献标志码A
基金项目:四川省青年科技创新研究团队项目(2013TD0015);国家重大科学仪器设备开发专项(2013YQ49085906);国家科技支撑计划科研条件领域备选项目(2014BAI03B01)。
收稿日期(Received):2014-10-08;接受日期(Accepted):2015-01-22;网络出版日期(Published online):2015-05-19

Contribution of the major HCHO metabolic pathways to HCHO-uptake by geranium leaves under liquid HCHO stress. Journal of ZhejiangUniversity(Agric. & LifeSci.), 2015,41(3):293-301
Han Shuang, Xiao Suqin, Sun Zhen, Xuan Xiuxia, Li Kunzhi, Chen Limei*(BiotechnologyResearchCenter,FacultyofLifeScienceandTechnology,KunmingUniversityofScienceandTechnology,Kunming650500,China)
SummaryGeranium (Pelargoniumsp. Frensham) is an ornamental plant cultivated in the worldwide. In this study, wild type (WT) geranium leaves were first treated with H13CHO solutions in time and concentration-gradient manner to clarify the detailed H13CHO-metabolic pathways in WT geranium leaves and to quantitatively analyze the roles of the major HCHO-metabolic pathways in HCHO-absorption by WT geranium leaves, and then understand the metabolic mechanism of geranium response to liquid HCHO stress.
Geranium was used as the experimental material. In the H13CHO treatment, 2 g geranium fresh leaves were soaked in different concentrations of H13CHO [including 0.1% 2-(N-morpholino) ethanesulfonic acid,MES] solution (100 mL), and then incubated under constant light [100 μmol/(m2·s)] at 25 ℃ for different time with shaking (100 r/min). After incubation, the leaves were washed and used to grind. The extract was transferred into a 5 mm NMR tube and subjected to13C-NMR analysis. Resonance peaks were assigned by comparison with authentic compound’s chemical shifts and confirmed by spiking the kalium phosphate buffer (KPB) extracts with authentic reference standards. For comparison of the relative contents of the metabolites, the target peaks were integrated relatively to the reference. Geranium leaves were treated in H13CHO solution to analyze the detailed HCHO metabolic pathways and the contribution of the major metabolic pathway to HCHO-uptake by geranium leaves.
In the time gradient, the content of citric acid (Cit) was on an upward trend, after treatment 48 h, its relative signal integral reached 4.54-fold of the unprocessed geranium leaves (control, CK). The signal integration of13C-carbohydrate[U-13C]glucose (Gluc) and [U-13C]fructose (Fruc) decreased in the first 4 h treatment and then increased, and finally achieved 1.72 and 1.94-fold of CK. In the concentration gradient, the content of citric acid increased obviously with the increase of HCHO concentration, and finally reached 7.58-fold of CK. The signal integration of13C-carbohydrate[U-13C]Gluc and [U-13C]Fruc slightly increased after decreased dramatically with the increase of HCHO concentration, and finally achieved 0.15 and 0.2-fold of CK. Results suggested that the HCHO-absorption by geranium leaves was a power function in relation with the treatment time. In 2 mmol/L HCHO treatment,during the early stage (0-24 h), the primary functioned metabolic pathway was the Cit produced pathway in geranium leaves. In this period, the geranium leaves absorbed 25% HCHO of total absorption. At the late stage (24-48 h) of HCHO treatment, two major metabolic pathways, the Cit produced pathway and13C-labelled glucide ([U-13C]Gluc and [U-13C]Fruc) generation pathway, functioned simultaneously in geranium leaves. Some13C-labelled glucide might also enter the glycolysis pathway or the tricarboxylate (TCA) cycle, which thereby allowed an enhancement in many organic acid peaks. In this time, the geranium leaves absorbed 50% HCHO of all uptake.
It is concluded that HCHO is eventually converted into glyoxylate which enters into the glyoxylate cycle to produce [3-13C]Cit, and carbohydrates are synthesized via gluconeogenesis pathway, then isocitrate enters into the TCA cycle to produce amino acids, and these metabolic pathways produce various organic acids. Apparently, geranium leaves metabolize liquid formaldehyde mainly through Cit and glucide ([U-13C]Gluc and [U-13C]Fruc) synthesis pathway.
Key wordsgeranium; HCHO metabolic pathway; liquid formaldehyde stress; formaldehyde-uptake
甲醛(HCHO)被广泛用于化工合成﹑工业制造、医药合成等涉及化学的领域及其他工业领域,因此现代化工产品的生产过程中不可避免地要产生大量含液体甲醛的生产废水,这些废水直接排放到环境中将会对人和动物产生危害[1]。另外,人们日常生活中装修所用的材料含有大量HCHO,且会持续不断地释放气态甲醛,这使得气态HCHO成为装修房间中空气污染的主要化学物质之一[2]。利用微生物和植物制备的生物反应器可以净化环境中的液态、固态和气态甲醛污染。
微生物可以通过异化途径和同化途径代谢甲醛。在异化途径中,微生物体内的游离HCHO首先通过与各种辅因子结合而脱毒,这些辅因子在不同微生物中各异,主要有真菌硫醇、还原型谷胱甘肽(glutathione,GSH)、四氢甲基喋呤及四氢叶酸(tetrahydrofolic acid,THFA)等[3-4],加合反应产生的HCHO加合物主要被氧化生成CO2并再生辅因子,同时提供能量供微生物生长。至今在微生物体内已经发现的甲醛同化途径有核酮糖单磷酸途径(ribulose monophosphate pathway,RuMP)、丝氨酸途径、木酮糖单磷酸途径(xylulose5-P monophosphate pathway,Xu5P)及核酮糖单磷酸的环状氧化途径,微生物利用同化途径把HCHO转变为细胞的组成成分。对一些植物包括吊兰、绿萝[5]、垂叶榕[6]、拟南芥[7]、香蕉[8]及常春藤[9]等甲醛代谢的研究结果表明植物的甲醛代谢机制和微生物相似,同一种植物体内也存在多个甲醛代谢途径:甲醛可以和GSH、THFA或氨基酸形成加合物而脱毒,甲醛与GSH产生的加合物进入甲醛氧化途径被氧化为甲酸,甲酸可进一步被氧化为CO2,CO2可以通过卡尔循环同化为糖类物质;甲酸也可以进入C1代谢被同化为有机酸;甲醛与THFA产生的加合物可通过C1代谢同化为氨基酸。甲醛同化产生的糖类物质、有机酸或氨基酸最终可以被整合进入植物的细胞组成成分如纤维素和蛋白质中。此外,植物的甲醛代谢途径也呈现一定程度的多样性,如甲醛还原为甲醇和甲醛代谢产生甲硫氨酸的途径仅在气体甲醛胁迫的常春藤中观察到,甲醛代谢产生枸橼酸的途径仅在液体甲醛胁迫的香蕉叶片中出现,甲醛进入光呼吸途径产生甘氨酸和丝氨酸同时进入三羧酸循环产生氮转运氨基酸的代谢途径只在液体甲醛胁迫的拟南芥中起作用。
天竺葵(Pelargoniumsp. Frensham)是在全世界范围内栽培的观赏植物,本实验室徐迪[10]的研究表明天竺葵叶片对液体甲醛具有一定的吸收能力;Song等[11]在转基因天竺葵的叶绿体中过量表达RuMP途径的HPS-PHI(6-磷酸己酮糖合成酶,HPS;6-磷酸果糖异构酶,PHI)融合蛋白,成功地构建了一个甲醛光合同化途径,同时还发现液体H13CHO胁迫处理未转基因的野生型(wild type,WT)天竺葵叶片中有一些未鉴定的特殊代谢产物。为了更好地了解天竺葵应答液体HCHO胁迫的代谢机制,本研究用H13CHO溶液对天竺葵叶片进行时间梯度和浓度梯度处理,通过分析H13CHO在WT天竺葵叶片内的具体代谢产物及各种产物相对含量的变化来推测甲醛在天竺葵叶片内的具体代谢途径及主要代谢途径对甲醛吸收的贡献。
1材料与方法
1.1天竺葵的培养
以无菌条件下生长的天竺葵(Pelargoniumsp. Frensham)植株为实验材料,从盆栽的天竺葵植株上取幼芽经氯化汞表面消毒后,植于固体MS培养基中,于恒温23 ℃/24 h光照的组培室中培养2个月,取叶片用于后续实验。
1.2叶片HCHO吸收能力的测定
从无菌培养天竺葵植株上取叶片2 g,置于含2、4和6 mmol/L的HCHO处理液[100 mL,含5 mmol/L KHCO3、0.1% 2-(N-吗啉)乙磺酸一水合物(2-(N-morpholino) ethanesulfonic acid,MES)]的组培瓶中,同时以不加叶片的相同HCHO溶液为对照(contrast,CK)检测HCHO的挥发和吸附程度。处理样品置于组培室,摇床振荡(100 r/min)培养。在处理的不同时间点(8、16、24、32、40、48和72 h)取样,用Nash[12]法测定处理液中残留的HCHO含量。
溶液剩余甲醛含量/%=处理液中残留甲醛的含量/处理液起始的甲醛含量×100;
CK中甲醛挥发量=处理液起始的甲醛含量-CK中溶液剩余甲醛含量;
死叶片吸附甲醛量/%=(处理液起始的甲醛含量-溶液剩余甲醛含量-CK中甲醛挥发量)/处理液起始的甲醛含量×100;
叶片的甲醛吸收量/%=(处理液起始的甲醛含量-溶液剩余甲醛量-CK中甲醛挥发量-死叶片的甲醛吸附量)/处理液起始的甲醛含量×100。
1.3H13CHO标记处理
从无菌培养的天竺葵植株上取叶片2 g置于组培瓶中,在时间梯度实验中,用2 mmol/LH13CHO处理液(100 mL,含5 mmol/L KHCO3,0.1% MES)处理叶片4、24和48 h;在浓度梯度实验中,用2、4和6 mmol/L处理叶片4 h。在整个处理期,组培瓶放在有24 h光照的25 ℃组培室中,摇床振荡(100 r/min)培养。以相同条件不含H13CHO溶液处理的叶片为CK。处理结束后,用预冷无菌蒸馏水冲洗叶片4~5次,去除叶片表面残留的H13CHO。用无菌吸水纸吸干叶片表面残留水分,液氮速冻,置于-80 ℃冰箱备用。
1.413C-NMR分析
取出于-80 ℃冰箱中冻存的叶片,在液氮中研磨成粉末状,加入3 mL含有10 mmol/L马来酸、100 mmol/L磷酸钾缓冲液(kalium phosphate buffer,KPB,pH 7.4)抽提可溶性代谢产物,经沸水浴加热处理3 min使酶失活,12 000 r/min,4 ℃离心20 min去除细胞碎片。上清液经真空冷冻干燥后,用0.5 mL KPB溶解,离心(12 000×g)3 min后取上清液装入5 mm核磁管中,并在毛细管中封入甲酰胺插入核磁管中作为内参与样品同时进行13C-NMR分析。
13C-NMR分析在布鲁克核磁共振仪(DRX 500-MHz)上进行,13C-NMR分析使用的相关参数:宽带质子去耦,5-ms (90°)脉冲,谱宽37 594 Hz,采样时间0.5 s,延滞时间1.2 s,样品温度保持在25 ℃,每个样品采集32 000个数据点,扫描1 200次,处理数据时线宽为4 Hz。H13CHO标记样品中化学位移参照甲酰胺碳共振峰(166.85)或马来酸碳共振峰(130.41)。NMR谱中共振峰通过和已知化合物13C-NMR谱进行比较鉴定[13-14]。在计算不同样品中各代谢物的相对含量时,目标共振峰以甲酰胺或马来酸为内参进行积分。
1.5数据统计分析
所有的生理生化指标分析均进行3次生物学重复。使用Microsoft Excel 2003计算平均值及误差分析,用DPS 7.5数据处理系统对所得数据进行差异显著性分析(P<0.05)。
2结果
2.1液体甲醛胁迫下天竺葵叶片吸收HCHO的能力
把无菌天竺葵叶片浸没在2、4和6 mmol/L HCHO溶液中,每隔8 h测定1次溶液中剩余HCHO含量,并以溶液中剩余甲醛含量占起始甲醛含量百分比作图(图1A),分析天竺葵对液体HCHO的吸收效率(由于叶片对甲醛的吸附量几乎为零,故忽略不计)。结果表明:随着处理时间的增加,不同处理液中剩余甲醛含量都呈逐渐降低的趋势,这种降低趋势在32 h之后表现更明显;处理到72 h时,天竺葵叶片能完全清除2 mmol/L处理液中的HCHO,4 mmol/L处理液中剩余17%的甲醛,6 mmo/L处理液中还有42%的甲醛剩余。证实了浸没在液体中的天竺葵叶片可以吸收液体甲醛,但天竺葵叶片对不同浓度的液体甲醛吸收效率不同。
不含植物叶片的对照溶液(CK-2 mmol/L、CK-4 mmol/L和CK-6 mmol/L HCHO)在72 h时HCHO的挥发量分别为6.7%、4.1%和3.9%。根据上述方法计算天竺葵叶片对不同浓度液体甲醛的实际吸收量作甲醛的吸收曲线(图1B),结果表明天竺葵对不同浓度液体甲醛的吸收量与时间呈幂函数关系。在18~32 h期间,天竺葵叶片对2、4和6 mmol/L液体HCHO的吸收速率分别为1.49 μmol/(g·h)、0.99 μmol/(g·h)和0.16 μmol/(g·h);在32~40 h期间,每克天竺葵叶片对2、4和6 mmol/L液体HCHO的吸收速率分别上升为3.81 μmol/(g·h)、3.14 μmol/(g·h) 和1.82 μmol/(g·h)。这说明天竺葵叶片对2 mmol/L液体甲醛吸收速率最快,对4 mmol/L液体甲醛吸收速率次之,对6 mmol/L液体甲醛吸收速率最慢。此外,叶片对不同浓度液体甲醛的吸收速率与其对不同浓度液体甲醛的吸收量呈正相关。因此,本研究把2 mmol/L和6 mmol/L的液体HCHO分别定义为低浓度和高浓度HCHO,4 mmol/L的液体HCHO定义为中浓度HCHO。
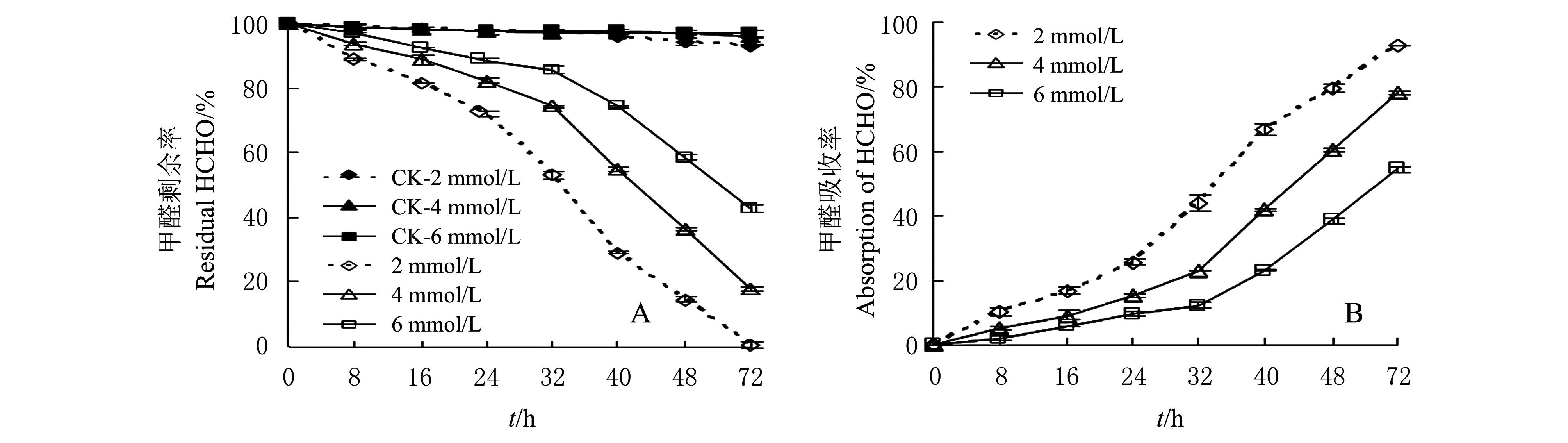
图1 天竺葵吸收不同浓度液体HCHO的动力学曲线 Fig.1 Uptake kinetics of formaldehyde (HCHO) by geranium leaves in HCHO solutions
2.2低浓度液体甲醛胁迫下天竺葵叶片代谢H13CHO产物分析
用13C-NMR分析低浓度(2 mmol/L)液体H13CHO处理天竺葵叶片的代谢谱。结果表明[3-13C]枸橼酸(citric acid,Cit)是天竺葵叶片背景中最强的信号峰,在H13CHO胁迫4 h时,[3-13C] Cit的信号峰(图2A)开始上升,其信号强度约是CK的1.34倍(图2B),此时[2-13C]甘氨酸(glycine,Gly)(图2A,C)和[3-13C]丝氨酸(serine,Ser)(图2H,J)的信号峰也在4 h有所增强;随着H13CHO处理时间的增加,[3-13C]Cit的信号峰继续上升,在24 h和48 h时,分别达到CK的1.83和2.58倍。这表明[3-13C]Cit是低浓度液体甲醛胁迫下天竺葵叶片代谢H13CHO最初出现的主要产物。此外,[1,5-13C]Cit、[6-13C]Cit和[2,4-13C]Cit的信号峰(图2A)及强度(图2B)也在2 mmol/L液体H13CHO的48 h显著增强。
天竺葵叶片内的游离[U-13C]葡萄糖(glucose,Gluc)和[U-13C] 果糖(fructose,Fruc)的信号峰(图2D,E)和强度(图2F,G)也变化明显。经2 mmol/L液体H13CHO胁迫4 h时,游离[U-13C]Gluc和[U-13C]Fruc的所有信号峰都显著降低,它们的相对含量分别降低71%和65%。随着处理时间的增加,游离[U-13C]Gluc和[U-13C]Fruc的含量有所恢复,在胁迫24 h时,[U-13C]Gluc和[U-13C]Fruc的信号强度仍低于CK(图2F,G),当处理至48 h时,[U-13C]Gluc和[U-13C]Fruc碳原子的共振峰强度与CK相比明显增强,二者的相对积分分别为CK的1.72和1.94倍。这些结果说明在2 mmol/L液体H13CHO胁迫下,天竺葵叶片能将吸收的液体甲醛同化为[U-13C]Gluc和[U-13C]Fruc,从而使天竺葵叶片内源[U-13C]Gluc和[U-13C]Fruc信号峰恢复,并高出对照的水平。
在低浓度H13CHO胁迫至48 h时,伴随[U-13C]Gluc和[U-13C]Fruc信号峰的增强,多种有机酸包括[3-13C]丙氨酸(alanine,Ala)、[3-13C]丙酮酸(pyruvic acid,PA)、[2-13C]谷氨酸(glutamic acid,Glu)、[2-13C]谷氨酰胺(glutamine,Gln)、[3-13C]天冬氨酸(aspartic acid,Asp)、[3-13C]天冬酰胺(asparagine,Asn)、[2-13C]苹果酸(malic acid,Mal)信号峰的强度(图2H~L)也显著增强,表明这些化合物也是天竺葵叶片代谢2 mmol/L液体H13CHO的主要产物。
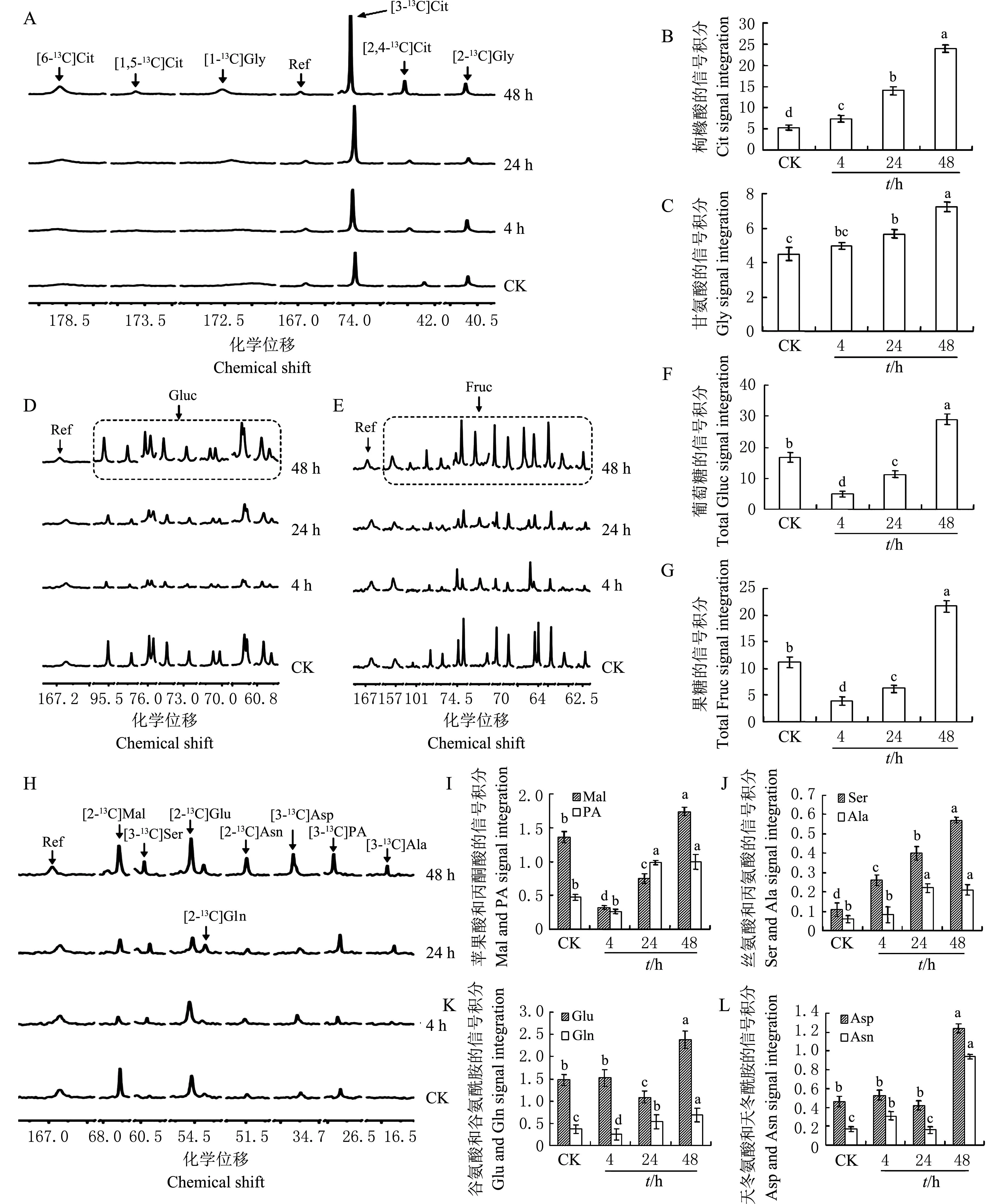
CK:对照;Ref:甲酰胺;Cit:枸橼酸;Gly:甘氨酸;Gluc:葡萄糖;Fruc:果糖;PA:丙酮酸;Mal:苹果酸;Ser:丝氨酸;Ala:丙氨酸;Glu:谷氨酸;Gln:谷氨酰胺;Asp:天冬氨酸;Asn:天冬酰胺.柱状图上不同小写字母表示在P<0.05水平差异有统计学意义. CK: Control; Ref: Formamide; Cit: Citric acid; Gly: Glycine; Gluc: Glucose; Fruc: Fructose; PA: Pyruvic acid; Mal: Malic acid; Ser: Serine; Ala: Alanine; Glu: Glutamic acid; Gln: Glutamine; Asp: Aspartic acid; Asn:Asparagine. Different lowercase letters above the bar graph indicate statistically significant differences at the 0.05 probability level. 图2 2 mmol/L液体H 13CHO处理天竺葵4、24和48 h后的主要代谢产物 Fig.2 Carbon-13 nuclear magnetic resonance ( 13C-NMR) analyses of metabolic intermediates in geranium leaves treated with gradient time of 4, 24 and 48 h in 2 mmol/L H 13CHO
2.3高浓度液体甲醛胁迫下天竺葵叶片代谢H13CHO的代谢产物分析
用13C-NMR分析天竺葵叶片在高浓度液体甲醛胁迫下短时期内代谢H13CHO的主要代谢产物。结果表明:2 mmol/L H13CHO处理叶片中没有H13COOH信号峰(图3A),4 mmol/L 和6 mmol/L H13CHO处理叶片中均产生了明显的H13COOH信号峰(图3A),并且随着H13CHO处理浓度的增加,H13COOH的生成量明显增加(图3B),6 mmol/L H13CHO胁迫下H13COOH的生成量是4 mmol/L 的1.3倍(图3C)。同时,[3-13C]Cit的信号峰上升幅度仍是最明显的(图3B),在2、4和6 mmol/L H13CHO处理的叶片中[3-13C]Cit相对含量分别是CK的1.33、4.39和5.86倍(图3D)。另外,[1,5,6-13C]Cit信号峰的强度也随H13CHO浓度的上升而增强(图3B,D)。此外,[U-13C]Gluc和[U-13C]Fruc的信号峰(图3E,F)和相对含量(图3G,H)随H13CHO浓度的上升反而降低,说明在高浓度液体甲醛胁迫下短时期内H13CHO在天竺葵叶片中的代谢没有产生[U-13C]Gluc和[U-13C]Fruc。其他有机酸的信号峰变化和[U-13C]Gluc及[U-13C]Fruc相似,也随H13CHO浓度的升高而降低。综合13C-NMR分析结果,H13COOH、[3-13C]Cit和[1,5,6-13C]Cit是天竺葵叶片代谢H13CHO的主要代谢产物。

FA:甲酸;Ref:甲酰胺;Cit:枸橼酸;Gluc:葡萄糖;Fruc:果糖.柱状图上不同小写字母表示在P<0.05水平差异有统计学意义. FA: H 13COOH; Ref: Formamide; Cit: Citric acid; Gluc: Glucose; Fruc: Fructose. Different lowercase letters above the bar graph indicate statistically significant differences at the 0.05 probability level. 图3 2、4和6 mmol/L液体H 13CHO处理天竺葵叶片4 h后的主要代谢产物 Fig.3 Carbon-13 nuclear magnetic resonance ( 13C-NMR) analyses of metabolic intermediates in geranium leaves treated with of 2, 4 and 6 mmol/L H 13CHO solutions for 4 h
3讨论
根据目前已知的C1化合物在植物体内的代谢途径可推测甲醛在植物体内代谢产生枸橼酸和甘氨酸的途径可能是:1)甲醛被同化为糖类物质,糖类物质进入光呼吸途径产生甘氨酸或经过糖酵解进入TCA循环产生枸橼酸;2)甲醛氧化产生甲酸,甲酸氧化为CO2,CO2通过磷酸烯醇式丙酮酸羧化酶催化的反应和磷酸烯醇式丙酮酸结合形成草酰乙酸(oxaloacetic acid,OAA),OAA进入TCA循环产生枸橼酸;3)甲酸缩合为乙醛酸,乙醛酸通过转氨作用形成甘氨酸或进入乙醛酸循环产生枸橼酸。由2 mmol/L液体H13CHO处理的天竺葵叶片4 h后的13C-NMR数据推测,天竺葵代谢液体H13CHO最先产生的代谢产物应该是[3-13C]Cit和[2-13C]Gly。在胁迫增加至24 h时,[3-13C]Cit的信号峰强度继续上升,而在这2个时间点13C-标记糖类物质的信号峰都在降低,13C-标记[U-13C]Gluc和[U-13C]Fruc信号峰的增强出现在胁迫叶片的48 h后。此外,在浓度梯度液体H13CHO处理的叶片中,随甲醛浓度的增加,[3-13C]Cit、[6-13C]Cit和[1,5-13C]Cit信号峰的强度呈现上升趋势,而其他化合物包括13C-标记糖类物质信号峰的强度都呈现下降的趋势。这说明在液体H13CHO处理的天竺葵叶片中,枸橼酸和甘氨酸的产生可能和13C-标记糖类物质的合成无关。
虽然在2 mmol/L液体H13CHO处理的叶片中没有观察到明显的H13COOH共振峰,但在4和6 mmol/L液体H13CHO处理叶片中有很强的H13COOH共振峰,因此可以推测在2 mmol/L液体H13CHO胁迫下,H13CHO肯定在天竺葵叶片被氧化为H13COOH,可能是因为2 mmol/L液体H13CHO处理的叶片产生的H13COOH较少,同时又被迅速转化为其他代谢产物,因而13C-NMR未能检测到H13COOH的信号。水稻在淹水低氧的条件下,叶片中乙醛酸循环的关键酶枸橼酸裂解酶(citrate lyase,ICL)和苹果酸合成酶(malate synthase,MS)的表达受到诱导,使乙醛酸循环的作用增强。在低氧时水稻叶片中由于糖酵解产生大量的乙醛和乙酸,通过增强乙醛酸循环的作用使乙醛和乙酸转化为枸橼酸和苹果酸而脱毒[15]。当叶片浸泡在甲醛溶液中时也处于一种厌氧的环境,由此推测在液体H13CHO胁迫的天竺葵叶片中,[3-13C]Cit应该通过上述第3)种途径产生。有相关研究报道,在绿色马铃薯块茎叶绿体中存在催化甲酸缩合成乙醛酸的酶(乙醛酸合成酶)[16-17],由此我们推测天竺葵叶片的叶绿体中可能也存在乙醛酸合成酶(glyoxylic acid synthase,GXS),在甲醛处理的天竺葵叶片中可由GXS催化甲醛氧化产生的甲酸转变为乙醛酸,乙醛酸通过转氨作用形成甘氨酸或进入乙醛酸循环产生[3-13C]Cit(图4),还有部分甘氨酸可能进入光呼吸途径产生[3-13C]Ser(图4)。
在时间梯度的液体H13CHO胁迫实验中,天竺葵叶片中的[U-13C]Gluc和[U-13C]Fruc信号峰和相对含量在H13CHO胁迫的早期显著降低,这一结果在低浓度液体H13CHO胁迫的香蕉和拟南芥叶片中也观察到[8,18],证实消耗植物体内源的可溶性糖类物质是植物应答液体甲醛胁迫的一种普遍机制,这可能是因为在溶液中进行液体甲醛胁迫是一种厌氧环境,植物组织只能通过糖酵解获得能量,因而消耗更多糖类物质,这一点已在液体甲醛胁迫的动物细胞中得到证实[19]。在浓度梯度的液体H13CHO胁迫试验中,天竺葵叶片中的[U-13C]Gluc和[U-13C]Fruc信号峰并没有因为H13CHO胁迫浓度的升高而能迅速恢复到CK的水平,这一结果和高浓度液体H13CHO胁迫的香蕉和拟南芥叶片不同,说明即使是高浓度液体H13CHO的胁迫,也不能使天竺葵叶片中的H13CHO代谢迅速产生糖类物质,推测天竺葵叶片应答高浓度液体H13CHO胁迫的机制与拟南介和香蕉叶片的可能不同。植物体可通过糖异生途径把来自非糖类物质的碳骨架转化为糖类物质,由此推测2 mmol/L液体H13CHO胁迫48 h后天竺葵叶片中[U-13C]Gluc和[U-13C]Fruc可能是通过糖异生途径产生的(图4)。伴随[U-13C]Gluc和[U-13C]Fruc信号峰的升高而增强的有机酸包括:[3-13C]Ala、[3-13C]PA、[2-13C]Glu、[2-13C]Gln、[3-13C]Asp、[2-13C]Asn、[2-13C]Mal可能是[U-13C]Gluc和[U-13C]Fruc随后流入糖酵解或TCA循环的结果(图4)。

Ser:丝氨酸;SHMT:丝氨酸羟甲基转移酶;Gly:甘氨酸;Asn:天冬酰胺;Cit:枸橼酸;Glu:谷氨酸;Gln:谷氨酰胺;Asp:天冬氨酸;SGAT:乙醛酸氨基转移酶;FALDH:甲酸脱氢酶;FGH:硫代甲酰基谷胱甘肽水解酶;Ala:丙氨酸;PA:丙酮酸;Gluc:葡萄糖;Fruc:果糖;PEP:磷酸烯醇式丙酮酸. Ser: Serine; SHMT: Serine hydroxymethyl transferase; Gly: Glycine; Asn:Asparagine; Cit: Citric acid; Glu: Glutamic acid; Gln: Glutamine; Asp: Aspartic acid; SGAT: Glyoxylate aminotransferase; FALDH: Formaldehyde dehydrogenase; FGH: S-formylglutathione hydrolase; Ala: Alanine; PA: Pyruvic acid; Gluc: Glucose; Fruc: Fructose; PEP: Phosphoenolpyruvic acid. 图4 天竺葵代谢液体HCHO的主要代谢途径 Fig.4 Major metabolic pathways of geranium metabolising liquid H 13CHO
试验证明了枸橼酸合成途径和13C-糖类物质合成途径是天竺葵叶片代谢液体HCHO的主要途径。结合甲醛吸收曲线和时间、浓度梯度的核磁谱可以估算在2 mmol/L液体甲醛胁迫的早期(0~24 h时期),在天竺葵叶片中主要起作用的甲醛代谢途径是从甲醛产生枸橼酸的途径,这一时期叶片从溶液中吸收甲醛的量约为总吸收量的25%;在24~48 h时期,叶片中的2个甲醛代谢途径即产生枸橼酸的途径和13C-糖类物质合成途径都起作用,故此时期内叶片从溶液中吸收甲醛效率显著提高,吸收的甲醛量约为总吸收量的50%.以上可知,这2种代谢途径在甲醛胁迫的不同时间段发挥作用使天竺葵叶片的甲醛吸收量和时间呈曲线函数关系。
参考文献(References):
[1]金凯洪,王宝荣,李磊,等.农药废水中甲醛资源化回收的应用研究//中国化学学会.持久性有机污染物论坛2010暨第五届持久性有机污染物全国学术研讨会论文集,2010:212-213.
Jin K H, Wang B R, Li L,etal. Application of formaldehyde resources recycling on pesticide wastewater//Chinese Chemical Society.POPsForum2010CumProceedingsoftheFifthPersistentOrganicPollutantsNationalSymposium, 2010:212-213. (in Chinese)
[2]宋春生.室内空气污染的来源及危害.福建环境,2001,18(5):38-41.
Song C S. The polluting sources of indoor air and its harm.FujianEnvironment, 2001,18(5):38-41. (in Chinese with English abstract)
[3]Vorholt J A. Cofactor-dependent pathways of formaldehyde oxidation in methylotrophic bacteria.ArchivesofMicrobiology, 2002,178(4):239-249.
[4]Marx C J, van Dien S J, Lidstrom M E. Flux analysis uncovers key role of functional redundancy in formaldehyde metabolism.PLoSBiology, 2005,3(2):e16.
[5]Wolverton B C, Mcdonald R C, Watkins E A. Foliage plants for removing indoor air pollution from energy-efficient homes.EconomicBotany, 1984,38(2):224-228.
[6]Schmitz H, Hilgers U, Weidner M,etal. Assimilation and metabolism of formaldehyde by leaves appear unlikely to be of value for indoor air purification.NewPhytologist, 2000,147(2):307-315.
[7]Wang S S, Song Z B, Sun Z,etal. Physiological and transcriptional analysis of the effects of formaldehyde exposure onArabidopsisthaliana.ActaPhysiologiaePlantarum, 2012,34(3):923-936.
[8]Zeng Z D, Qi C J, Chen Q,etal. Absorption and metabolism of formaldehyde in solutions by detached banana leaves.JournalofBioscienceandBioengineering, 2014,117(5):602-612.
[9]赵辉,郝振萍,金潇潇,等.甲醛污染对3种室内观赏植物叶片保护酶活性的影响.安徽农业科学,2009,37(32):15807-15808,15845.
Zhao H, Hao Z P, Jin X X,etal. Effects of formaldehyde pollution on leaf protective enzymatic activities of 3 kinds of indoor leaf-viewed Plant.JournalofAnhuiAgriculturalScience, 2009,37(32):15807-15808,15845. (in Chinese with English abstract)
[10]徐迪.18种观赏植物甲醛吸收能力的研究.昆明:昆明理工大学,2009:42-43.
Xu D. Study on 18 kinds of ornamental plants formaldehyde absorptive capacity. Kunming: Kunming University of Science and Technology, 2009:42-43. (in Chinese with English abstract)
[11]Song Z, Orita I, Yin F,etal. Overexpression of an HPS/PHI fusion enzyme fromMycobacteriumgastriin chloroplasts of geranium enhance its ability to assimilate and phytoremediate formaldehyde.BiotechnologyLetters, 2010,32(10):1541-1548.
[12]Nash T. The colorimetric estimation of formaldehyde by means of the Hantzsch reaction.BiochemicalJournal, 1953,55(3):416-421.
[13]Yasueda H, Kawahara Y, Sugimoto S.BacillussubtilisyckGandyckFencode two key enzymes of the ribulose monophosphate pathway used by methylotrophs, andyckHis required for their expression.JournalofBacteriology, 1999,181(23):7154-7160.
[14]Yanase H, Matsuzaki K, Sato Y,etal. Enzymatic preparation of [1-13C]D-fructose-6-phosphate from [13C] formaldehyde andD-ribose-5-phosphate using the formaldehyde-fixing system ofMethylomonasaminofaciens77a.AppliedMicrobiologyandBiotechnology, 1992,37(3):301-304.
[15]Sarkar R K, Das S, Ravi I,etal. Changes in certain antioxidative enzymes and growth parameters as a result of complete submergence and subsequent re-aeration of rice cultivars differing in submergence tolerance.JournalofAgronomyandCropScience, 2001,187(2):69-74.
[16]Janave M T, Ranaswamy N K, Nair P M. Purification and characterization of glyoxylate synthetase from greening potato-tuber chloroplasts.EuropeanJournalofBiochemistry, 1993,214(3):889-896.
[17]Janave M T, Ranaswamy N K, Nair P M. Studies on determination of active site amino acid residues in glyoxylate synthetase from potato tuber chloroplasts.PlantPhysiologyandBiochemistry, 1999,37(2):121-129.
[18]Song Z B, Xiao S Q, You L,etal. C1 metabolism and the Calvin cycle function simultaneously and independently during HCHO metabolism and detoxification inArabidopsisthalianatreated with HCHO solutions.Plant,CellandEnvironment, 2013,36(8):1490-1506.
[19]Fujimaki H, Kurokawa Y, Kunugita N,etal. Differential immunogenic and neurogenic inflammatory responses in an allergic mouse model exposed to low levels of formaldehyde.Toxicology, 2004,197(1):1-13.
*通信作者(Corresponding author):陈正礼,E-mail:chzhli75@163.com
第一作者联系方式:陈姗姗,E-mail:chenssism@163.com;罗启慧,E-mail:lqhbiology@163.com.†为共同第一作者
URL:http://www.cnki.net/kcms/detail/33.1247.s.20150519.1317.008.html
——吉普赛女郎

