治疗多发性骨髓瘤的HDAC抑制剂——Farydak
·药物信息·
作者简介:刘珍,女,研究方向:药品监管,E-mail:717055193@qq.com
治疗多发性骨髓瘤的HDAC抑制剂——Farydak
刘珍
(菏泽市牡丹区食品药品监督管理局食品药品稽查大队,山东 菏泽 274000)
中图分类号:R979.1文献标识码:A
2015年2月23日,美国食品药品监督管理局(FDA) 批准瑞士诺华(Novartis)制药的抗癌新药Farydak(panobinostat,LBH589)联合硼替佐米(bortezomib)和地塞米松(dexamethasone)用于既往接受至少2种治疗方案治疗失败的多发性骨髓瘤(myltiple myeloma,MM)患者。Farydak成为用于治疗多发性骨髓瘤的首个组蛋白脱乙酰酶(HDAC)抑制剂,该药的表观遗传学活性,可能有助于恢复多发性骨髓瘤细胞的功能。
商品名:Farydak
通用名:Panobinostat
化学名:2-Hydroxypropanoic acid, compd.with 2-(E)-N-hydroxy-3-[4[[[2-(2-methyl-1H-indol-3-yl)ethyl]amino]methyl]phenyl]-2-propenamide (1∶1)
结构式:

1作用机制
Panobinostat是一种HDAC抑制剂,在纳摩尔浓度下抑制HDACs酶活性。HDACs催化乙酰基从组蛋白和一些非组蛋白的赖氨酸残基中去除。HDAC活性的抑制导致组蛋白乙酰化作用的增强,使染色质松弛,导致转录激活。相对于正常细胞,panobinostat对肿瘤细胞的毒性更大。
2药代动力学
吸收:Farydak的绝对口服生物利用度接近21%。Panobinostat的峰浓度在癌症晚期患者口服2 h(Tmax)内被观察到。在超过剂量范围时,Farydak的Cmax和AUC显示了类似与剂量成比例的增加。
与禁食条件下相比,36名晚期癌症患者在高脂肪餐后摄入口服剂量的Farydak 30 min后,panobinostat在血浆中的Cmax和AUC0~48分别大约低44%和16%。在这些患者中,中位Tmax同样也延迟了2.5 h。
Panobinostat的水溶性是pH依赖性的,在高pH条件下具有较低的可溶性。Farydak与提高胃pH值的药物同时服用,在体外或临床试验中没有进行评价;然而,在模拟使用生理学基础的药物代谢动力学(PBPK)模型中没有观察到panobinostat吸收发生改变。
分布:在体外研究中,panobinostat大约90%与人血浆蛋白结合,并且没有浓度依赖性。Panobinostat是一个P-糖蛋白(P-gp)底物。
代谢:Panobinostat被广泛代谢,与panobinostat的生物转化有关的代谢途径有还原、水解、氧化和葡萄苷酸化过程。部分通过CYP3A进行代谢,大约占panobinostat总肝脏消除的40%。在体外,来自CYP2D6和CYP2C19途径的贡献是较小的。体外研究中,UGT1A1、UGT1A3、UGT1A7、UGT1A8、UGT1A9和UGT2B4促进panobinostat的葡萄苷酸化。
消除:4位晚期癌症患者单次口服14C-panobinostat后,29%~51%的放射性标记药物通过尿液排出,44%~77%通过粪便排出。未变化的panobinostat占尿液中剂量的<2.5%,粪便中<3.5%。
口服清除率(CL/F)和终末消除半衰期t1/2大约分别为160 L·h-1和37 h,通过晚期癌症患者人口基础药代动力学(pop-PK)模型进行评估。一个跨学科的变异性65%的清除率评估也有报道。在长期口服给药的晚期癌症患者中,观察到多达2层的蓄积物。
3临床研究
Farydak与硼替佐米和地塞米松联用的功效和安全性通过一项随机、双盲、安慰剂对照和多中心研究进行了评估,该研究的复发性多发性骨髓瘤患者先前接受过1~3次的系统治疗。
患者接受硼替佐米(1.3 mg·m-2,静脉注入)与地塞米松(20 mg)联合Farydak 20 mg(或安慰剂)治疗,隔日口服,21 d为一个治疗周期,前两周内每周给药3次。治疗周期最多达16个周期(48周)。
一共768名患者按1∶1的比例随机接受Farydak联合硼替佐米和地塞米松(n=387)或安慰剂联合硼替佐米和地塞米松(n=381)治疗,对先前使用硼替佐米治疗和先前抗骨髓瘤治疗次数进行区分。93%的患者ECOG体力状态在0~1。先前治疗次数的中位数为1;48%的患者接受过2或3次先前系统治疗。超过一半(57%)的患者先前接受过干细胞移植。先前最普遍的抗肿瘤治疗有皮质类甾醇类(90%)、美法仑(80%)、沙利度胺(53%)、环磷酰胺(47%)、硼替佐米(44%)和来那度胺(19%)。两项研究方法的随访中位时间为29个月。
该研究的主要终末点为无进展生存期(PFS),研究者利用修改的欧洲骨髓移植组织(EBMT)标准进行评估。在全部的试验人群中,Farydak联合硼替佐米和地塞米松治疗的中位PFS(95%CI)为12个月(10.3,12.9),而安慰剂联合硼替佐米和地塞米松治疗为8.1个月(7.6,9.2)[危害比HR:0.63(95%CI:0.52,0.76)]。间断分析时,两组的总生存数在统计学上没有差异。对Farydak的认可是基于一项193名患者的亚群分析中的功效和安全性,这些患者以已经接受了硼替佐米与一种免疫调节剂的先前治疗和中位数为2的治疗次数为优势:与在全部试验人群中相比,在这个更严重的预治疗人群中风险似乎更大一些。这些193名患者中,76%的患者接受了≥2次的先前系统治疗。Farydak联合硼替佐米和地塞米松治疗的中位PFS(95%CI)为10.6个月(7.6,13.8),安慰剂联合硼替佐米和地塞米松治疗为5.8个月(4.4,7.1)[HR:0.52(0.36,0.76)]。功效结果见表1和PFS的Kaplan-Meier曲线见图1。
在一些先前接受硼替佐米和一种免疫调节剂治疗的患者亚群中(n=193),根据修改的EBMT标准,Farydak联合硼替佐米和地塞米松治疗的总应答率为58.5%,安慰剂联合硼替佐米和地塞米松治疗的总应答率为41.4%。应答率结果见表2。
4规格与剂量
胶囊剂,规格:10、15、20 mg。剂量:20 mg,隔日口服,21 d为一个治疗周期,前两周时每周服药3次(在第1、3、5、8、10和12天),共8个治疗周期。
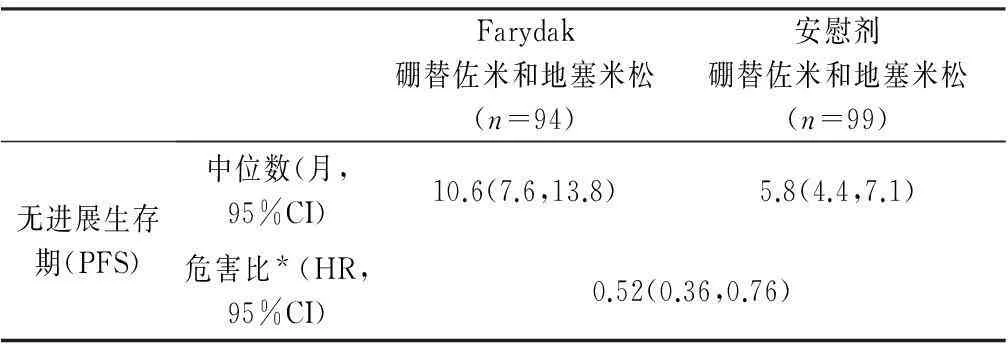
表1 接受过硼替佐米和免疫调节剂先前治疗的患者在多发性
注:*危害比来源于适合分层模型

图1 先前接受硼替佐米和一种免疫调节剂治疗的多发性骨髓瘤患者的 无进展生存期Kaplan-Meier曲线图
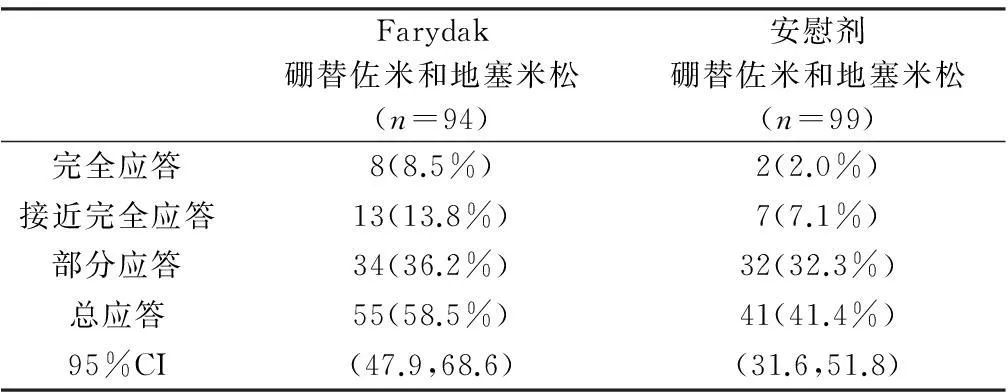
Farydak硼替佐米和地塞米松(n=94)安慰剂硼替佐米和地塞米松(n=99)完全应答8(8.5%)2(2.0%)接近完全应答13(13.8%)7(7.1%)部分应答34(36.2%)32(32.3%)总应答55(58.5%)41(41.4%)95%CI(47.9,68.6)(31.6,51.8)
5适应证
Farydak联合硼替佐米和地塞米松用于既往接受至少2种治疗方案而治疗失败的多发性骨髓瘤患者。
6不良反应
在临床研究中,Farydak常见的不良反应有腹泻、疲劳、恶心、外周性水肿、食欲减退、发热和呕吐等。

