半胱氨酸保护基研究进展
•综述与述评•
半胱氨酸保护基研究进展
黄蓓
(河南省化工研究所有限责任公司 , 河南 郑州450052)
摘要:由半胱氨酸构建的二硫键在多肽药物中是一类关键的结构元素。在合成含有半胱氨酸的多肽药物时,半胱氨酸的巯基必须要被保护基保护起来,否则,具有亲核性的巯基会发生许多副反应。本文介绍了半胱氨酸各种类型的保护基及其相应的脱除条件。
关键词:半胱氨酸 ; 保护基 ; 二硫键
中图分类号:TQ464.7
收稿日期:2015-05-05
作者简介:黄蓓(1982-),女,工程师,从事催化研发工作,电话:15237129810。
Research Progress of Cysteine-protecting Groups
HUANG Bei
( Henan Chemical Industry Research Institute Co.Ltd , Zhengzhou450052 , China)
Abstract:Disulfide bonds,which formed by cysteine,are key structural elements in many therapeutically peptides.Protection of the side chain of cysteine is mandatory in therapeutically peptides synthesis otherwise the nucleophilic thiol will take place some side reactions.A variety of protecting groups of cysteine and its corresponding removal of conditions are introduced in this paper.
Key words:cysteine ; protecting group ; disulfide bond
0前言
多肽是一类普遍存在于生物体内由氨基酸通过肽键连接组成的化学物质,迄今在生物体内已发现多达数万种的多肽分子。由于其具有独特的生物活性,多肽在治疗癌症等疑难病上起到良好的效果,因此,近年来吸引了越来越多的制药企业投入到多肽药物的研究和开发中。
分子骨架中有一对或多对由半胱氨酸构建的二硫键的多肽分子是多肽类药物中一类具有更加独特生物活性的分子。在合成含有半胱氨酸的多肽药物时,侧链含有的半胱氨酸是必须要被保护基保护的,否则其含有的具有高亲核性的巯基将有可能发生酰基化、烷基化或者被空气氧化形成二硫键等副反应[1]。
由半胱氨酸构建的二硫键这一关键结构存在于许多具有潜在药理活性的多肽药物中,为了使这些潜在药物真正被应用到实际治疗疾病过程中或者临床前期的评估中,目前大量的研究和优化工作已经开展[2]。
然而对于肽链中含有多个半胱氨酸的多肽药物,在构建多个二硫键时将会遇到一个困难,即如何能保证做到按照分子设计的那样清晰明了地构建相应的二硫键。为了解决这个问题,就需要在肽链合成中选择合适的保护基对不同位点的半胱氨酸进行正交保护,从而实现逐步合成理想的多个二硫键的多肽药物[3]。
1半胱氨酸保护基
1.1酸敏感保护基
1.1.1苄基及其取代苄基类
苄基及其取代苄基类衍生物是一类对酸敏感的半胱氨酸保护基,主要应用在Boc/Bn固相合成策略中。随着芳环上取代基的不同,苄基类保护基对酸的敏感程度和脱除的难易也有比较大的区别。
苄基(Bn)的脱除需要比较苛刻的实验条件(HF、25 ℃或者钠在液体氨水中[4])才能实现;对甲基苄基(Meb)对酸相对比较敏感,脱除条件相对于苄基就比较温和一点,只需要HF和捕获剂在低温下就可以实现脱除;而对甲氧基苄基(Mob)是一种比Meb对酸更加敏感的保护基,脱除它只需要HF和捕获剂在零度条件下就可实现,同时也发现Mob作为保护基的粗肽纯度比用Meb作保护基的高[5]。
三甲氧基苄基(Tmob)也是一种对酸敏感的苄基类衍生物,但这个保护基主要应用于Fmoc/tBu的固相合成策略。脱除这个保护基只需要在稀的TFA和捕获剂存在下就可以实现。然而值得注意的是脱除下来的三甲氧基苄基阳离子会与色氨酸(Trp)发生烷基化的副反应[6]。
由此可知,苄基及其衍生物对酸敏感度的相对关系:Mob > Meb > Bn,此类物质的结构见图1。
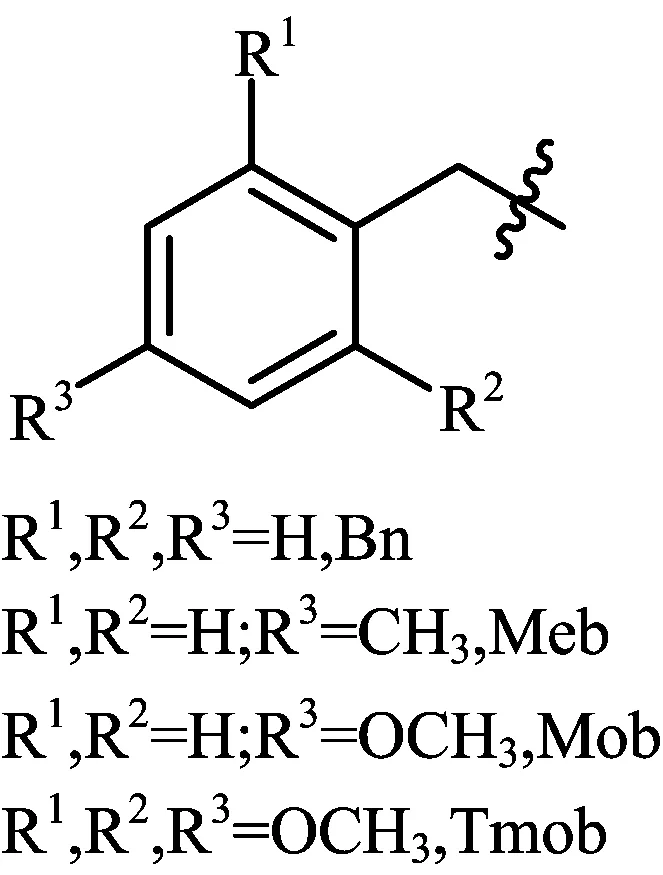
图1 苄基及其取代衍生物保护基
1.1.2二苯甲基和三苯甲基类
三苯甲基类的半胱氨酸保护基是一类在Fmoc/tBu固相合成策略中比较经典和常用的保护基。三苯甲基(Trt)可以用TFA(>25%浓度)和捕获剂(例如三异丙基硅烷 TIS,为了阻止脱下来的三苯甲基阳离子再次与巯基反应)脱除[7]。而单甲氧基三苯基(Mmt)与Trt相比是一类对酸更加敏感的保护基,脱除Mmt保护基只需要在很稀的TFA(1%~5%浓度)和捕获剂存在下就可实现[8]。另外,无论是Trt还是Mmt都可以在碘作用下一步实现脱除和
氧化形成二硫键。
然而在一些实验中发现,当Trt和Mmt被用作正交半胱氨酸保护基时,用1%的TFA脱除Mmt时并不能彻底脱除,而正交的Trt保护基却发现被部分脱除,这种现象就导致最终不能得到较好的产品纯度和收率。因此,近年又发展了一种二苯甲基的保护基(Dpm),脱除此保护基需要比较高浓度的TFA(> 60%)才能实现[9]。这样当Dpm与Trt或者Mmt同时使用时,就能起到很好的正交结果。此类物质的结构如图2所示。
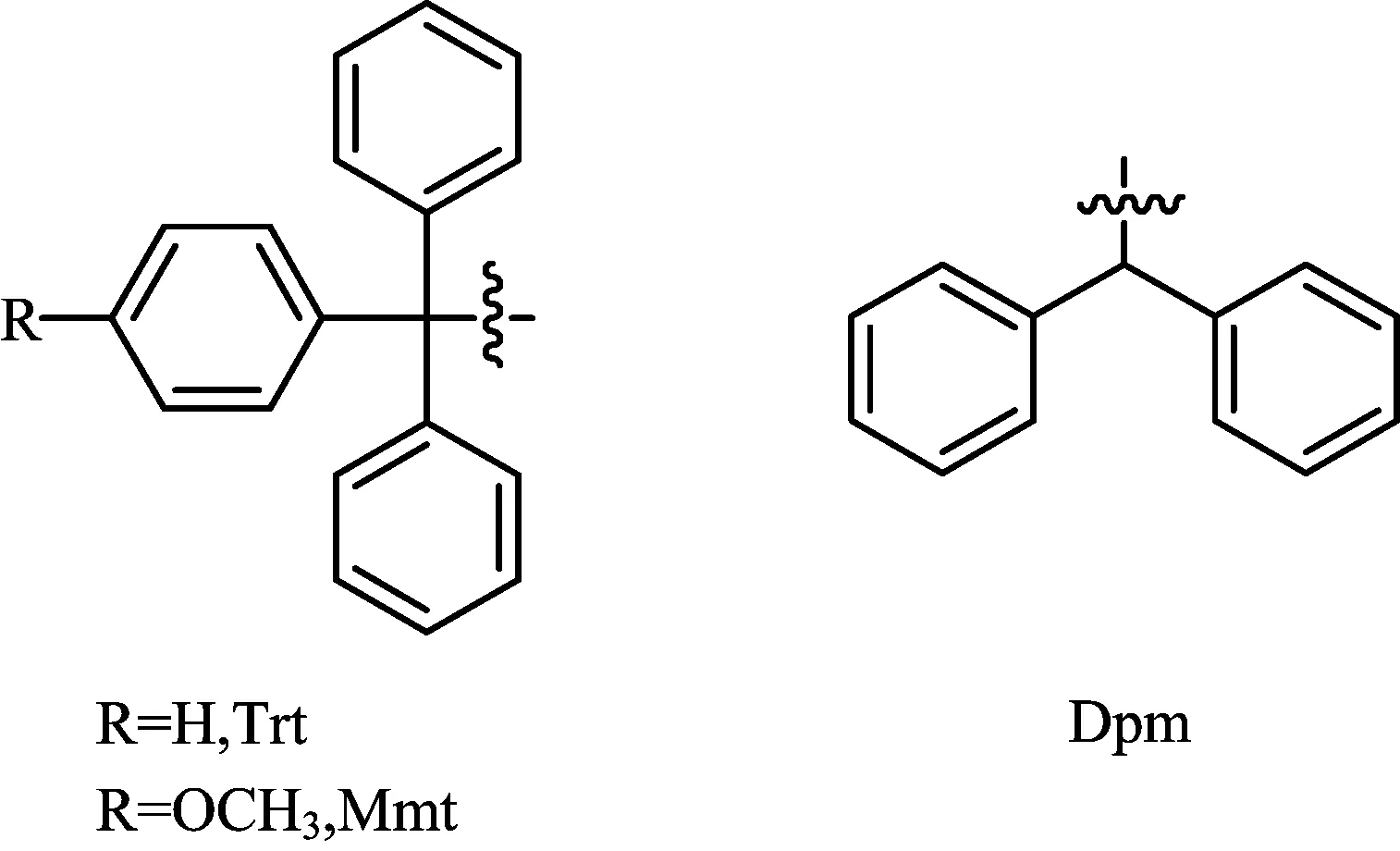
图2 三苯甲基类和二苯甲基保护基
1.1.3叔丁基类
叔丁基(tBu)和含有叔丁基骨架的半胱氨酸保护基(1-Ada)(如图3所示)在TFA条件下非常稳定,因此此类保护基主要应用与Boc/Bn固相合成策略中[10]。脱除这类保护基需要用HF在相对高温和捕获剂条件下才能实现。
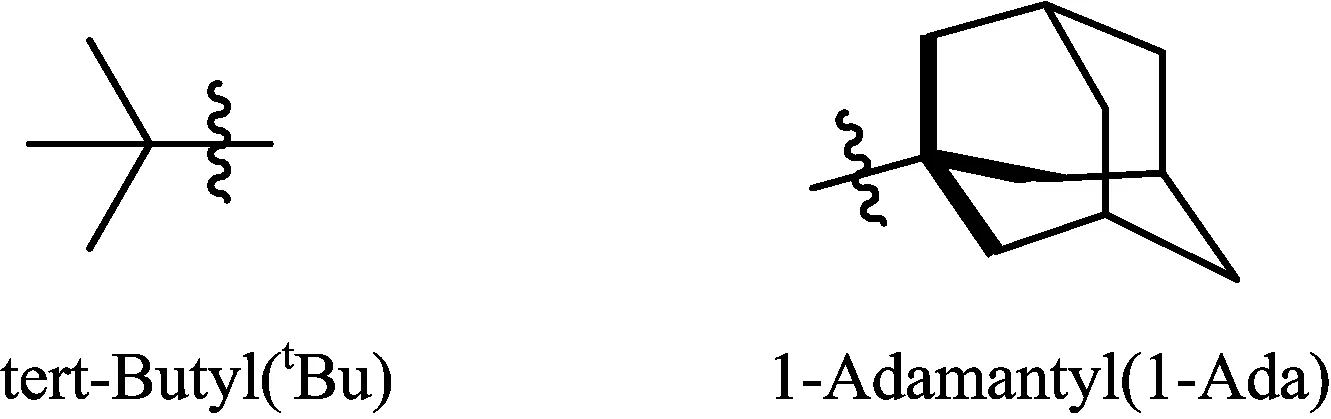
图3 叔丁基类保护基
1.2碱敏感保护基
碱敏感的半胱氨酸保护基主要有芴甲基(Fm)、2,4-二硝基-苯乙基(Dnpe)、芴甲氧羰基(Fmoc)、烯丙氧气羰基(Alloc)这几种(如图4所示),这些保护基只适合用于Boc/Bn固相合成策略中。
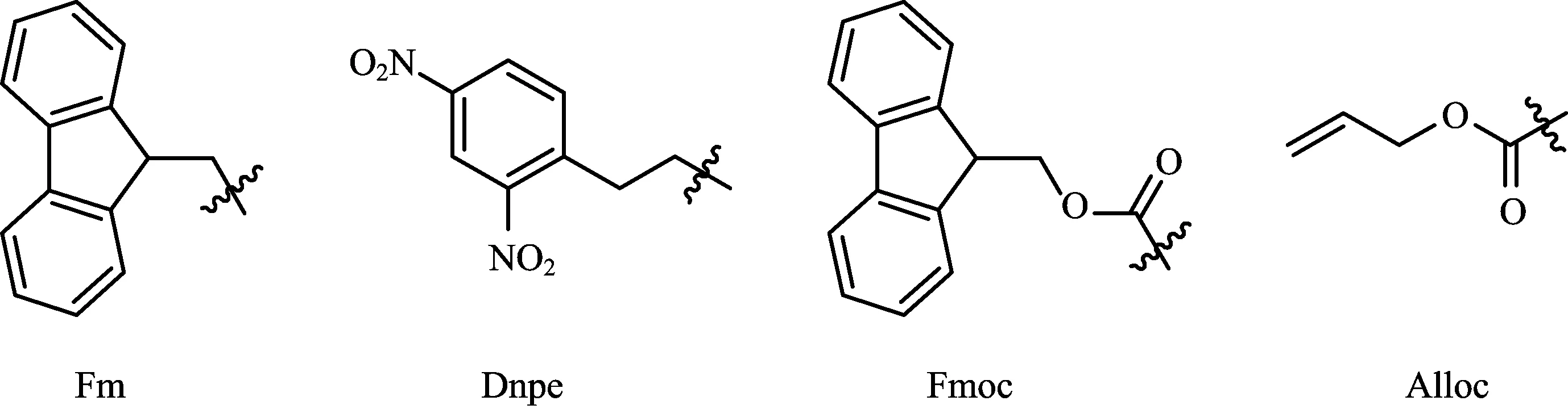
图4 碱敏感类保护基
芴甲基(Fm)的脱除需要在50% piperidine/DMF中反应2 h,而如果用10% piperidine/DMF则需要反应过夜才能保证彻底脱除。此保护基对强酸有比较好的耐受性,即使在HF下也比较稳定[11]。
Dnpe的脱除在50% piperidine/DMF中只需要30~60 min,值得强调的是在此条件下保护基被脱除的同时二硫键也随之形成。如果想得到含有自由巯基的产物,就需要在脱除剂中加入额外的自由巯基分子如2-巯基乙醇[12]。
Fmoc保护基的脱除需要用三乙胺在碘作用下同时实现脱除和形成相应的二硫键,而且这种脱除方法并不会影响氨基的Fmoc保护基[13]。
Alloc保护基的脱除要用到金属催化剂Pb(0)在Bu3SnH存在下,常用的金属催化剂是Pd(PPh3)4[14]。
1.3酸、碱相对稳定的保护基
酸、碱相对稳定的保护基主要有乙酰氨甲基(Acm)、苯乙酰氨甲基(Phacm)、叔丁基硫基(StBu)三种(如图5所示),由于此类保护基对酸、碱的耐受性相对都比较好,因此既可以应用在Boc/Bn固相合成策略中也可以应用在Fmoc/tBu固相合成策略中。
Acm保护基可以在碘或者铊盐[15]的作用下一步实现脱除和二硫键的形成,用汞盐或者银盐处理Acm保护基时可以得到含有自由巯基的产物。此外,也发现Acm保护基在HF条件下可以被部分脱除[16]。
Phacm与Acm的化学性质非常相似,脱除Acm的条件同时也可以应用到此保护基中。另外,Phacm具有一个独特的性质,即可以被青霉素水解酶在非常温和条件下脱除[16]。
StBu保护基的脱除需要用到额外的巯基,如苯硫酚、2-巯基乙醇、二硫苏糖醇等。此保护基也可以被HF部分脱除[18]。
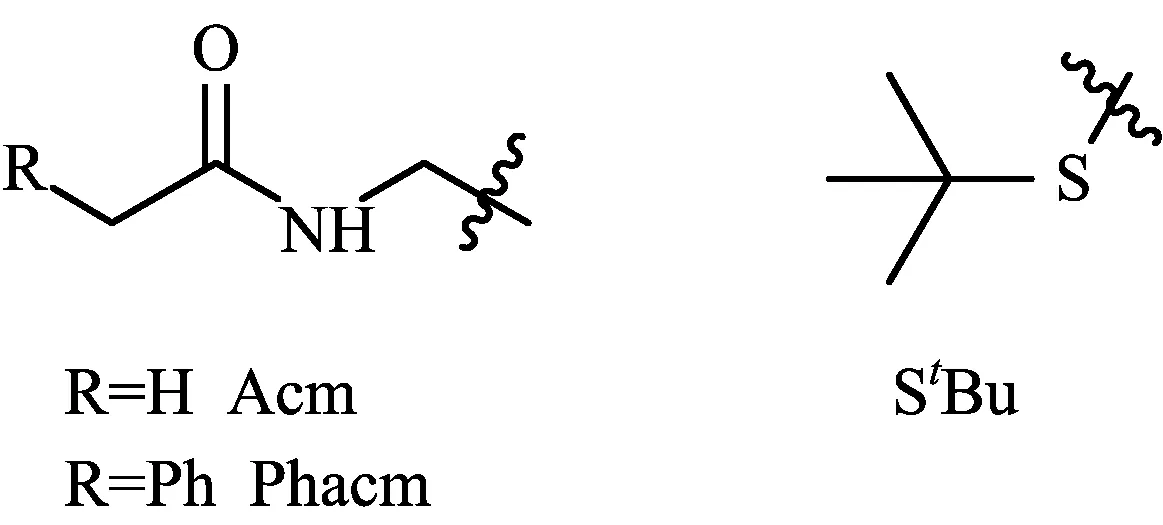
图5 酸、碱稳定的保护基
1.4光敏感保护基
光敏感半胱氨酸保护基发现和发展的一个主要原因,就是为了克服在苛刻条件下脱除半胱氨酸保护基时引起其它敏感基团发生副反应的可能性。因为光敏感保护基的脱除条件非常的温和,只需要在溶液中光照(λ= 300~ 400 nm)条件下就可实现脱除,而不需要再额外添加任何试剂,这样就最大程度地减少了其它敏感基团副反应发生的可能性。
目前常用的光敏感保护基主要有2-硝基-苯甲基(oNb)和2-硝基-4,5-二甲氧基-苯甲基(oNv)(如图6所示)这两种,此类保护基可应用与Boc/Bn和Fmoc/tBu两种固相合成策略中。另外,相对于oNb,oNv由于在350 nm处有比较强的吸收,因此oNv光敏感保护基在实际应用中更受欢迎。

图6 光敏感类保护基
1.5保护与活化功能兼具的保护基
在构建二硫键的时候此类保护基不仅起到保护半胱氨酸巯基的功能同时也具有活化巯基的特性。这样的保护基以Npys18和S-Pyr19类为主(如图7所示),此类保护基由于对碱相对敏感,因此主要应用在Boc/Bn固相合成策略中。如果此类保护基是在肽链的N端时,也可以应用在Fmoc/tBu固相合成策略中。脱除这类保护基需要引入额外的自由巯基,因此如果肽链中含有二硫键的话可能存在二硫键被巯基断开的风险。
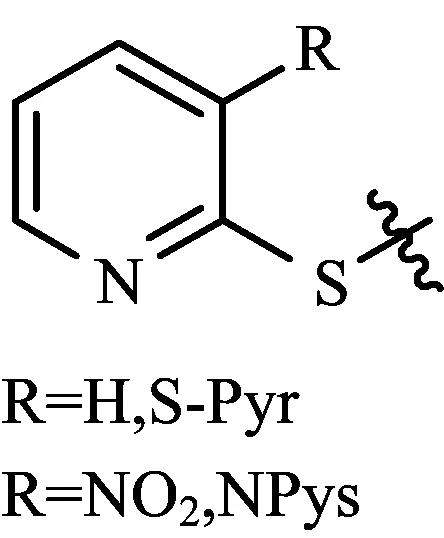
图7 保护和活化功能兼具的保护基
2结论与展望
采用化学方法合成多肽类物质在生物化学中是一种非常重要的工具。然而开发更加有效的方法来构建复杂多肽分子依旧存在巨大的挑战,其中一个挑战就是如何准确地构建含有多个由半胱氨酸形成的二硫键的多肽分子,因为在合成此类多肽分子中,经常会遇到不能按照分子设计的那样准确地构建设定的二硫键分子,总是会有二硫键混杂现象的发生。而为了避免和解决这个问题,就需要在多肽合成中选用合适的保护基来进行正交保护半胱氨酸。
随着新多肽药物的发现和多肽技术的不断更新,特别是在构建含有多个二硫键的多肽药物时,对半胱氨酸保护基的正交选择尤为重要。尽管目前半胱氨酸的保护基种类很多,但是发现和发展更加有效的以及脱除条件更加温和的新的保护基始终是多肽药物合成研究的重点。
参考文献:
[1]Albert Isidro-Llobet,Mercedes Alvarez,Fernando Albericio.Amino acid-protecting groups[J].Chem Rev 2009,109:2455-2504.
[2]John A Karas,Denis B Scanlon,Mohammed A Hossain,et al.2-Nitroveratryl as a photocleavable thiol-protecting group for directed disulfide bond formation in the chemical synthesis of insulin[J].Chem Eur J,2014,20:9549-9552.
[3]Fei Shen,Zhi-Ping Zhang,Lei Liu,et al.Hydrazine-sensitive thiol protecting group for peptide and protein chemistry[J].Org Lett,2011,13:568-571.
[4]Robert H,Sifferd,Vincent du Vigneaud. A new synthesis of carnosine,with some observations on the splitting of benzyl group from capbobenzoxy derivatives and from benzylthio ethers[J].J Biol Chem,1935,108:753-761.
[5]Erickson B W,Merrifield R B.Acid stability of several benzylic protecting groups used in solid-phase peptide synthesis.Rearrangement ofo-benzyltyrosine to 3-benzyltyrosine[J].J Am Chem Soc,1973,95:3750.
[6]Mark C Munson,Carlos Garcia-Echeverria,Fernando Albericio,et al.S-2,4,6-trimethoxybenzyl (Tmob): a novel cysteine protecting group for the N alpha-(9-fluorenylmethoxycarbonyl) (Fmoc) strategy of peptide synthesis[J].J Org Chem,1992,57:3013-3018.
[7]Shiro Akabori,Shumpei Sakakibara,Yasutsugu Shimonishi,et al.A new method for the protection of the sulfhydryl group during peptide synthesis[J].Bull Chem Soc Jpn,1964,37:433-434.
[8]Kleomenis Barlos,Dimitrios Gatos,Olga Hatzi,et al.Synthesis of the very acid-sensitive fmoc-cys(Mmt)-OH and its application in solid-phase peptide synthesis[J].Int J Pept Protein Res,1996,47:148-153.
[9]Miriam Góngora-Benítez,Lorena Mendive-Tapia,Iván Ramos-Tomillero,et al.Acid-labile cys-protecting groups for the fmoc/tBu strategy:filling the Gap[J]. Org Lett,2012,14:5472-5475.
[10]Juliusz Jacek Pastuszak,Andrzej Chimiak.Tert-butyl group as thiol protection in peptide synthesis[J].J Org Chem,1981,46:1868-1873.
[11]Mariano Ruiz-Gayo,Fernando Albericio,Enrique Pedroso,et al.(S)-9-fluorenylmethyl-L-cysteine,a useful HF-stable derivative for peptide synthesis[J].J Chem Soc Chem Commun,1986,20:1501.
[12]Miriam Royo,Carlos García-Echeverría,Ernest Giralt,et al.S-2-(2,4-dinitrophenyl) ethyl-L-cysteine: a new derivative for solid-phase peptide synthesis[J].Tetrahedron Letters,1992,33:2391-2394.
[13]Christopher W West M.Angels estiarte and daniel H. rich.new methods for side-chain protection of cysteine[J].Org Lett,2001,3:1205-1208.
[14]A Loffet,H X Zhang.Allyl-based groups for side-chain protection of amino-acids[J].Int J Pept Protein Res,1993,42:346-351.
[15]Daniel Veber,John Milkowski,Sandor Varga,et al.A novel thiol protecting group for cysteine[J].J Am Chem Soc,1972,94:5456-5461.
[16]Nobutaka Fujii,Akira Otaka,Toshihiro Watanabe,et al.Silver trifluoromethanesulphonate as an S-deprotecting reagent for the synthesis of cystine peptides[J].J Chem Soc Chem Commun,1989,283-284.
[17]Miriam Royo,Jordi Alsina,Ernest Giralt,et al.S-phenylacetamidomethyl (Phacm):an orthogonal cysteine protecting group for Boc and Fmoc solid-phase peptide synthesis strategies[J].J Chem Soc,Perkin Trans 1,1995:1095-1102.
[18]Eric Atherton,Robert C,Sheppard,et al.Peptide synthesis part 7 solid-phase synthesis of conotoxin G1[J].J Chem Soc,Perkin Trans1,1985:2065-2073.
[19]Michael S,Bernatowicz,Rei Matsueda,et al. Preparation of boc-[S-(3-nitro-2-pyridinesulfenyl)]-cysteine and its use for unsymmetrical disulfide bond formation[J].Int J Pept Protein Res,1986,28:107-112.
[19]Haihong Huang,Robert I,Carey.Preparations of boc-Cys(S-Pyr)-OH and Z-Cys(S-Pyr)-OH and their applications in orthogonal coupling of unprotected peptide segments[J].J Pept Res,1998,51:290-296.

