模拟微重力对NIH3T3细胞近日节律基因表达的影响
模拟微重力对NIH3T3细胞近日节律基因表达的影响*
杨云云杨淑红刘延友成姝婷后望李世平王正荣
(四川大学华西基础医学与法医学院·卫生部时间生物学重点实验室,四川 成都 610041)
【摘要】目的探讨模拟微重力对NIH3T3细胞近日节律基因Per1, Per2与Cry1 mRNA表达的影响。方法体外培养培养NIH3T3细胞分为实验组和对照组。实验组采用RCCS模拟微重力环境培养NIH3T3细胞;而对照组在正常重力环境下静置培养。两组均采用PMA刺激细胞,RT-qPCR检测Per1,Per2与Cry1 mRNA的表达水平。结果对照组与实验组的近日节律基因Per1,Per2与Cry1的mRNA都呈现节律性。与对照相比,实验组节律基因的振幅减小,相位延迟。结论模拟微重力影响NIH3T3细胞近日节律基因Per1,Per2,Cry1的表达。
【关键词】模拟微重力; 近日节律基因; NIH3T3;
【中图分类号】R 318.01【文献标志码】A
基金项目:国家重点基础研究发展规划项目(2011CB71 1000)
通讯作者:刘延友,E-mail:liuyanyou@126.com
收稿日期:( 2015-01-30; 编辑: 张文秀)
The effect of stimulated microgravity on expression of circadian genesYANG Yunyun, YANG Shuhong, LIU Yanyou,etal
(KeyLaboratoryofChronobiology,MinistryofHealth(SichuanUniversity),WestChinaSchoolofPreclinicaland
ForensicMedicine,SichuanUniversity,Chengdu610041,China)
Abstract【】ObjectiveTo investigate the effect of simulated microgravity on circadian genes in NIH3T3 cells. MethodsNIH3T3 cells cultured in vitro were divided into control group and experiment group. The experiment group was cultured in Rotary Cell Culture System (RCCS) stimulated microgravity. The control group was cultured under static condition. Both two groups were stimulated by PMA. The expression of Per1, Per2 and Cry1 were detected by RT-qPCR. ResultsThe mRNA level of Per1, Per2 and Cry1 demonstrated rhythmic oscillation in control group and experiment group. The amplitudes of Per1, Per2 and Cry1 of experiment group were lower than that of control group. The phases of Per1, Per2 and Cry1 of experiment group delayed compared that of control group. ConclusionSimulated microgravity can influence the expression of Per1, Per2 and Cry1.
【Key words】Stimulated microgravity; Circadian genes; NIH3T3

近日节律广泛存在于生物界。在自然状态下,生物钟接受外界光-暗和温度等周期信号,调整自身的相位,与外界环境保持同步[1]。生物节律由近日节律基因的转录-翻译的正负反馈环路产生[2,3]。生物体内约有10%的基因参与调节近日节律[4,5]。目前,已通过基因分析找到与近日节律有关的节律基因,如Perl、Per2、Per3、Clock、Bmal、Tim、Cryl、Cry2和Tau等,其中Per1,Per2,Cry1为近日节律的核心元件。
随着航天事业的发展,微重力对有机体的影响成为研究热点。微重力可以破坏细胞的骨架,改变细胞的形态,使细胞发生水肿,微管蛋白减少,部分细胞发生凋亡等[6,7]。在微重力条件下,人T淋巴细胞减少,免疫因子的表达出现明显的下降。人体温度调节系统在微重力状态下也发生一定的变化[8]。微重力对生物的近日节律也有着明显的影响[9]。在微重力影响下,人的睡眠周期推迟2小时[10]。但是,微重力对生物节律的影响机制尚不清楚,需要深入研究。本文以NIH-3T3细胞为研究对象,利用旋转细胞培养系统(RCCS)模拟太空微重力环境,研究微重力对NIH-3T3细胞节律基因表达的影响,从分子层面研究微重力对生物体近日节律的影响。
1材料与方法
1.1PCR引物PCR引物由英潍捷基(上海)贸易有限公司合成,引物序列见表1。
1.2细胞培养细胞培养条件: 10%新生小牛血清和1%的双抗的DMEM高糖培养基,5%CO2,37℃。对照组:将NIH-3T3细胞(密度:2.0×105个/平皿)接种在25mm的培养皿中,待细胞密度为80%时,用无血清的培养基处理。24小时后,用PBS溶液清洗,然后用不含血清浓度为100nM的PMA的DMEM溶液诱导,将诱导时间定为0h。诱导2小时后,分别在0、1、4、8、12、16、20、24、28、32、36、40、44和48h时间点用0.25%的胰酶溶液消化细胞。离心收集细胞,加Trizol试剂裂解细胞取样,于-80℃冻存。实验组:将NIH-3T3细胞接种在100mm的培养皿,当密度至80%时,将细胞接种在cytodex-3上,置入RCCS中培养。24小时后,将含10%新生小牛血清的培养基更换为无血清的培养基,24小时后用与对照组浓度相同的PMA刺激,然后与对照组在相同时间点取样。
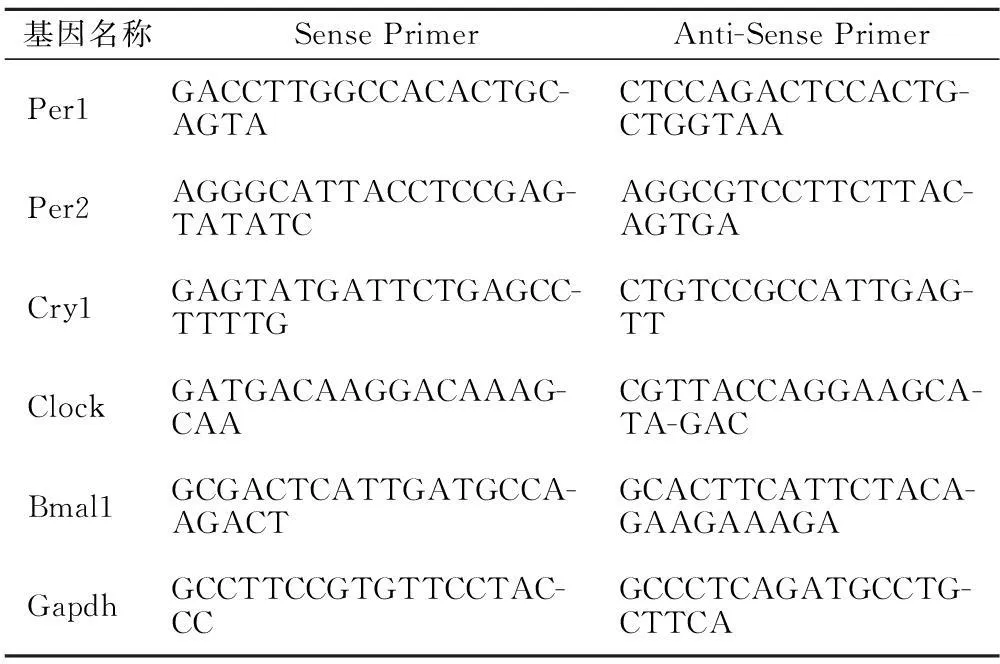
表1 PCR引物序列
1.3实时荧光定量PCR根据Trizol试剂说明书提取NIH-3T3细胞的总RNA,用紫外分光光度计检测RNA浓度和纯度。分别取2μg的RNA逆转录试剂合反转录合成cDNA。RT-qPCR反应体系:10μl Mix,1μl上游引物,1μl下游引物,2μl cDNA模版,补加灭菌蒸馏水至总体积20μl。反应条件,预变性:95℃,10m;扩增条件:95℃,10s;55-65℃,20s;72℃,20s;40个循环;融解曲线:65℃~95℃,5s。其中Gapdh,Per1,Per2,Cry1各自的退火温度分别为56.9℃,55℃,62.5℃,60℃。
1.4统计分析Per1,Per2与Cyr1基因的mRNA 的相对表达水平以2-ΔΔCt方法计算。数据用SPSS 13.0软件分析,并进行两因素方差分析法,P<0.05为差异具有统计学意义。
2结果
2.1模拟微重力对节律基因Per1的影响以GAPDG为内参基因,采用RT-qPCR法检测正常重力组和实验组Per1基因的mRNA的相对表达水平。如图1所示:正常重力组(1g)和实验组(0g)per1的表达都呈现出节律性振荡。与1g 组相比,0g组 per1的振幅和相位都发生了明显的变化,两因素方差分析结果表明,1g组与0g组per1的相对表达水平有显著差异(P<0.001)。1g组per1的波峰大约出现在32h左右,波谷大约出现在20 h,振幅最大值为2.03;0g组per1波峰大约出现在20 h,相对表达量为1.82,波谷大约出现在32 h,相对表达量为0.075。0g组与1g组相比,振幅减少,相位也发生了延迟。
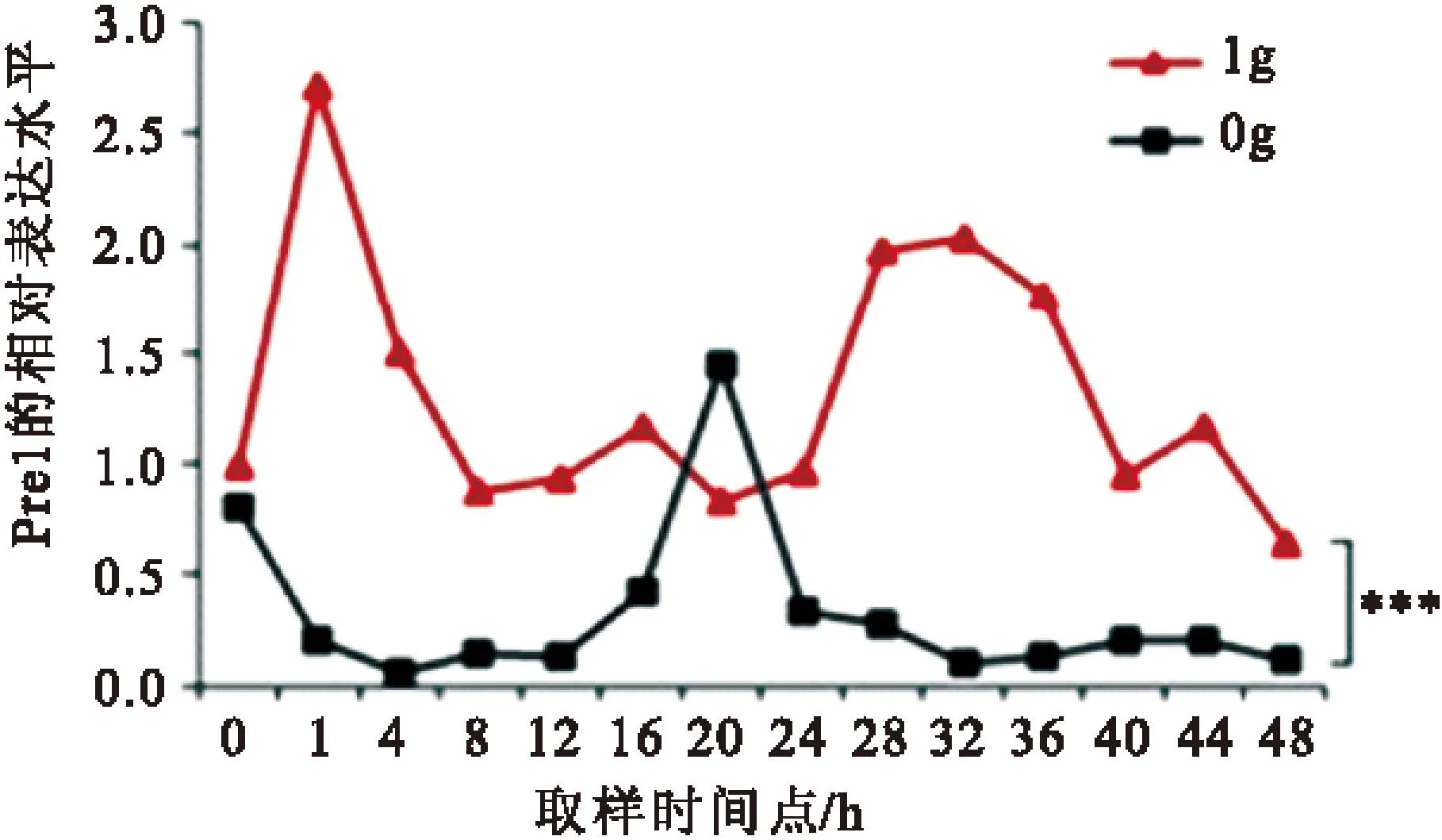
图1模拟微重力对Per1相位的影响
Figure 1Influence of simulated microgravity on phase of Per1
2.2模拟微重力对节律基因Per2的影响以GAPDG为内参基因,采用RT-qPCR法检测正常重力组和实验组Per2基因的mRNA的相对表达水平。如图2所示:1g组和0g组Per2 mRNA表达水平也呈节律性振荡。与1g 组相比,0g组 per2的振幅和相位都发生了明显的变化,两因素方差分析结果表明,1g组与0g组per1的相对表达水平有显著差异(P<0.001)。1g组的波峰大约出现在32h,相对表达量2.16,波谷大约出现在44 h,相对表达量为0.57;0g组波峰大约出现在20 h,相对表达量为1.39,波谷大约出现在8 h,相对表达量为0.05。0g组与1g组相比,振幅减少,相位也发生了延迟。
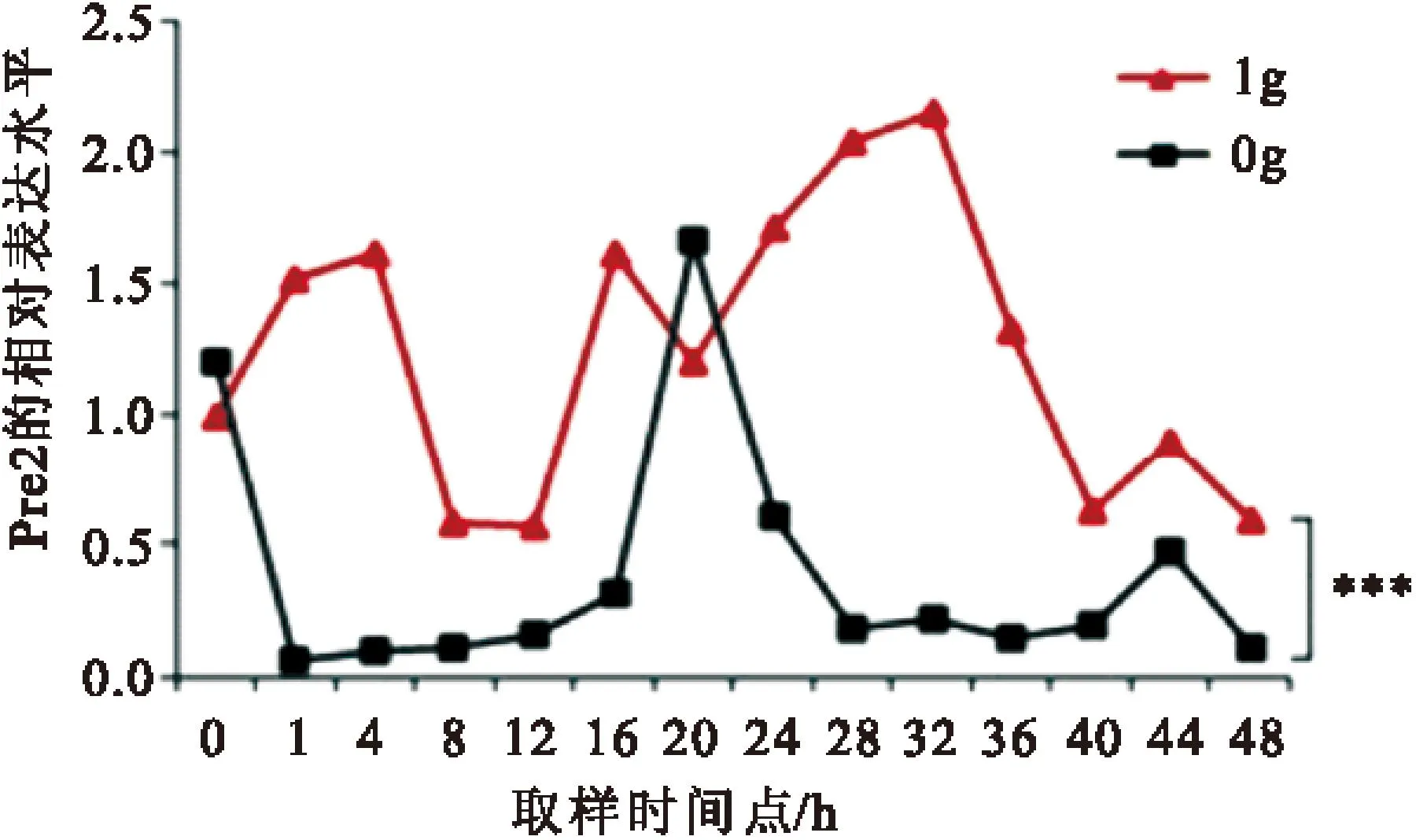
图2模拟微重力对Per2相位的影响
Figure 2Influence of simulated microgravity on phase of Per2
2.3模拟微重力对节律基因Cry1的影响以GAPDG为内参基因,采用RT-qPCR法检测正常重力组和实验组Cry1基因的mRNA的相对表达水平。如图3所示:1g组和0g组Cry1 mRNA表达水平都呈节律性振荡,但是,与1g 组相比,0g组cry1的振幅和相位都发生了明显的变化,两因素方差分析结果表明,1g组与0g组cry1的相对表达水平有显著差异(P<0.001)。1g组的波峰大约出现在28h,相对表达量1.9,波谷大约出现在12,相对表达量为0.43;0g组波峰大约出现在16 h,相对表达量为0.47,波谷大约出现在1 h,相对表达量为0.13。0g组与1g组相比,振幅减少,相位也发生了延迟。
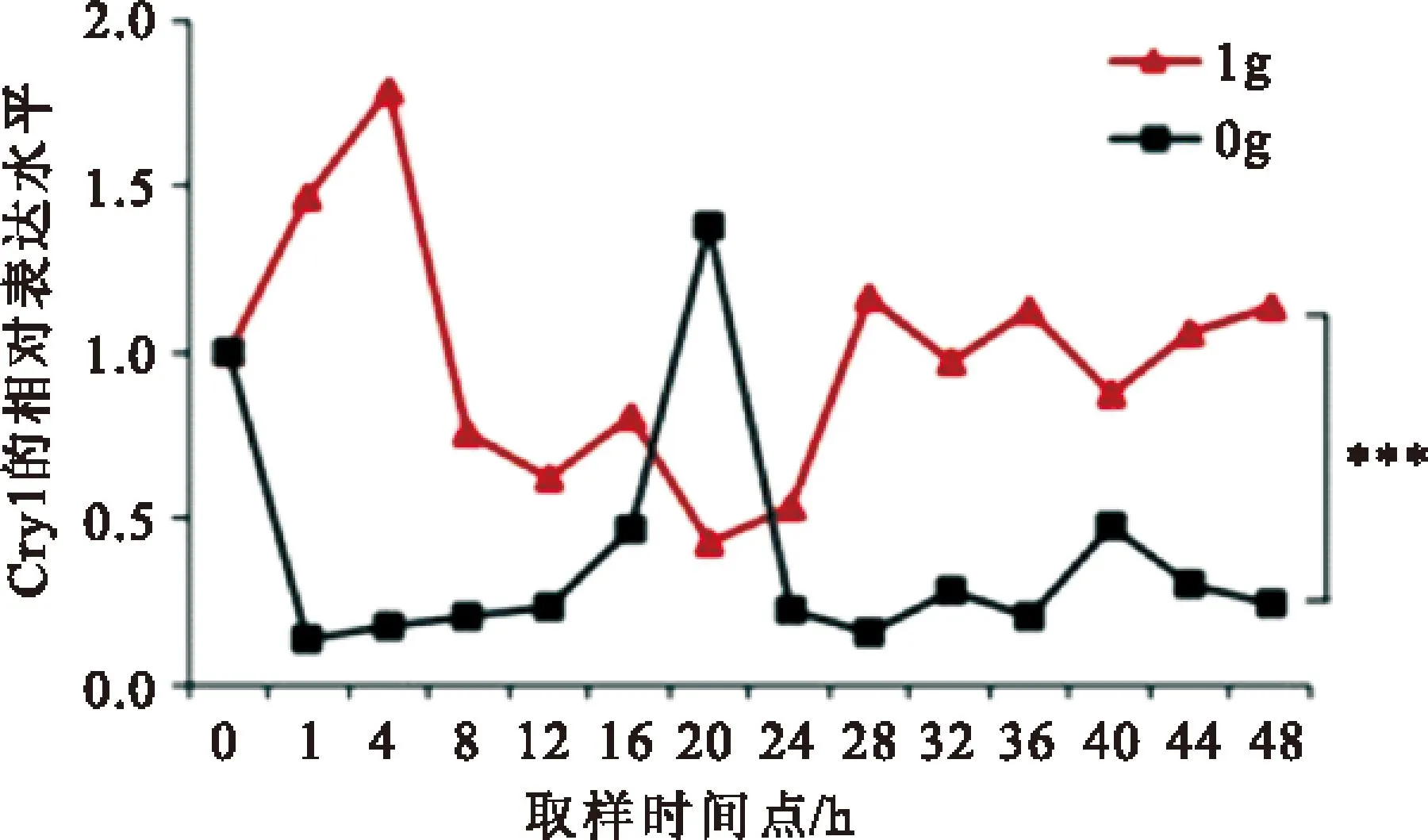
图3模拟微重力对Cry1相位的影响
Figure 3Influence of simulated microgravity on phase of Cry1
3讨论
地球上所有的生物都处在太阳系中,近日生物钟系统的存在使得生物体能够适应环境周期性变化。重力作为一个恒定的环境因素深刻地影响着地球上生物体的生命活动。研究表明,失重或者微重力环境对机体造成的影响是多方面,可以导致许多脏器长期或短期的功能异常,如体液重新分布、肾小球滤过增加、心血管功能改变、肌肉萎缩、骨质丢失、代谢紊乱、免疫功能的改变等[11]。同时也会引起一些精神性疾病,睡眠障碍,错觉,太空定位、认知障碍等[12]。已有大量实验表明,微重力条件下,机体的生物节律也发生了相应的变化。实验报道,采用人体Head-Down Bed Rest(HDBR)的方法进行微重力的模拟,通过检测排泄物的成份发现,微重力条件下,排泄物中的各成人的含量发生了周期性的变化[12]。Shimda等在模拟微重力下对斑马鱼胚胎发育影响的研究中发现,微重力对不同组织器官基因表达存在着敏感反应时间段[13]。太空实验中记录猕猴运动情况、心率以及腋窝和大脑的温度,与地面对照组相比,太空飞行过程中,猕猴温度节律相位延迟,平均心率降低[14]。
实验结果表明,模拟微重力影响了NIH3T3细胞Per,Per2,Cry1的近日节律振荡,表现为振幅减小,相位发生延迟。正常环境下,体外培养的细胞节律基因的表达不呈现近日节律振荡,而作为PKC的经典诱导剂PMA,能够诱导体外培养的成纤维细胞产生近日节律振荡,其诱导机制是PMA激活PKC,紧接着激活了MAPK激酶信号通路,同步化每个细胞的相位,从而重置了细胞的近日节律振荡[15]。模拟微重力环境下近日节律基因的振幅减小,相位发生了延迟。已有研究证实,模拟微重力环境下,成纤维细胞内的MAPK信号通路被激活,而MAPK信号通路又参与了成纤维细胞近日钟重置的过程[16],所以,模拟微重力环境刺激了MAPK信号通路,使其参与近日钟重置过程,这可能是导致NIH3T3细胞的近日生物钟系统发生变化,从而引起相关节律基因的表达发生了变化。也有研究表明,微重力条件下,下丘脑-垂体系统也会发生改变,前叶激素的分泌呈降低的趋势[17],而生物节律的中央调控位于下丘脑的SCN区域,由此可间接推测微重力条件下生物节律的改变可能是由于下丘脑-垂体系统的改变影响了相关激素的分泌,最终也引起了生物节律的变化。而报道最多的可能的机制是ERK/MAPK信号通路,本实验中也从侧面验证了MAPK通路的参与。
4结论
模拟微重力影响了近日节律基因的表达水平。以本研究为基础,进一步研究微重力条件下节律基因的分子调控机制,节律基因对代谢的调控等,将有助于揭示航天环境因素产生的生物节律特异调节途径,从而为空间生理,病理性疾病的预防和治疗提供新的思路和理论基础。
【参考文献】
[1]Traon APL, Heer M, Narici MV,etal. From space to Earth: advances in human physiology from 20 years of bed rest studies (1986-2006) [J]. European Journal of Applied Physiology, 2007, 101:143-194.
[2]Thresher RJ, Martha HV, Yasuhide M,etal. Role of mouse cryptochrome blue-light photoreceptor in circadian photoresponses [J]. Science, 1998, 282,1490-1494.
[3]Welsh DK, Takahashi JS, Kay SA. Suprachiasmatic nucleus: cell autonomy and network properties [J]. Annu Rev Physiol, 2010, 72, 551-577.
[4]Akhtar RA, Reddy AB, Maywood ES,etal. Circadian cycling of the mouse liver transcriptome, as revealed by cDNA microarray, is driven by the suprachiasmatic nucleus [J]. Curr Biol, 2002, 12,540-550.
[5]Panda S, Antoch MP, Miller BH,etal. Coordinated transcription of key pathways in the mouse by the circadian clock [J]. Cell, 2002, 109, 307-320.
[6]Marina YK, Norita S, Salina O,etal. Alteration of cell cytoskeleton and functions of cell recovery of normal human osteoblast cells caused by factors associated with real space flight[J]. Malaysian J Pathol, 2013, 35(2):153 -163.
[7]Rui Meng, Huiyun Xu, Shengmeng Di,etal. Human mesenchymal stem cells are sensitive to abnormal gravity and exhibit classic apoptotic features [J]. Acta Biochim Biophys Sin, 2011, 43:133-142.
[8]Zhenzhong Yang, Jinxue Fei, De Song,etal. Effects of simulated natural air movement on thermo regulatory response during head-down bed rest [J]. Journal of Thermal Biology, 2013, 38: 363-368.
[9]Dijk DJ, Neri DF, Wyatt JK,etal. Sleep, performance, circadian rhythms, and light-dark cycles during two space shuttle flights [J]. Am J Physiol Regul Integr Comp Physiol, 2001, 281:1647-1664.
[10] Gundel A, Polyakov VV,Zulley J. The alteration of human sleep and circadian rhythms during spaceflight [J]. Sleep Res,1997,6:1-8.
[11] LeBlanc AD, Spector ER, Evans HJ,etal. Skeletal responses to space flight and the bed rest analog : a review [J]. Musculoskelet Neuronal Interact, 2007, 7:33-47.
[12] Manzey D, Lorenz B. Mental performance during short-term and long-term space flight [J]. Brain Res Rev, 1998, 28:215-221.
[13] Shimada N,Sokunbi G,Moorman SJ. Changes in gravitational for affect gene expression in developing organ systems at different developmental times [J]. BMC Developmental Biology, 2005, 5(1):10.
[14] Fuller CA, Hoban-Higgins TM, Klimovitsky VY,etal. Primate circadian rhythms during spaceflight: results from Cosmos 2044 and 2229 [J]. J Appl Physiol, 1996, 81(1): 188-193.
[15] Brogs L, Beukelaers P, Vandenbosch R,etal. Cell" circadian" cycle a new role for mammalian core clock gene[J].Cell cycle,2009,8(6):832-837.
[16] Akashi M, Nsishida E. Involvement of the MAPinase cascade in resetting of the mammalian circadian clock[J]. Genes Dev, 2000, 14(6): 645-649.
[17] Alekseev EI. Morphofunctional state of the hypothalamic-pituitary neurosecretory system of rats flown on Cosmos-1667[J]. Kosm-Biol-Aviakosm-Med,1987, 21(6):27-31.


