胰岛素与丹参酮ⅡA对大鼠糖尿病周围神经病变的保护作用
胰岛素与丹参酮ⅡA对大鼠糖尿病周围神经病变的保护作用
刘勇,霍金莲,龙永春,田永青,李祥
(延安大学咸阳医院脑血管科, 咸阳 712000)
摘要:目的 观察胰岛素联合丹参酮ⅡA抗DPN大鼠周围神经细胞凋亡的作用并初步探讨其机制。方法成年雄性SD大鼠40只,随机分为正常对照组、模型组、胰岛素治疗组和胰岛素+丹参酮ⅡA治疗组,药物干预4周,处死动物后取坐骨神经,检测周围神经细胞凋亡及相关蛋白Bax和Bcl-2、线粒体膜电位、胞浆/线粒体Bax和Cytochrome C表达变化。结果与正常对照组比较,模型组血糖、糖化血红蛋白、细胞凋亡及促凋亡蛋白Bax表达均显著升高,同时线粒体膜电位和抗凋亡蛋白Bcl-2均显著下降;Bax从细胞浆向线粒体转位而Cytochrome C从线粒体向细胞浆转位。胰岛素与丹参酮ⅡA联合比单用胰岛素更能显著改善糖代谢紊乱,抑制周围神经细胞凋亡、升高线粒体膜电位以及抑制Bax和Cytochrome C转位。结论胰岛素联合丹参酮ⅡA能够显著改善DPN大鼠糖代谢紊乱,并能够显著降低周围神经细胞凋亡,其抑制线粒体凋亡途径可能是其抗DPN大鼠周围神经细胞凋亡的主要机制之一。
关键词:胰岛素;丹参酮ⅡA;糖尿病周围神经病变
doi:10.3969/j.issn.1004-2407.2015.06.018
中图分类号:R965文献标志码:A
收稿日期:(2015-01-14)
Protective effect of insulin combined with tanshinoneⅡA on diabetic peripheral neuropathy in rats
LIU Yong,HUO Jinlian,LONG Yongchun,TIAN Yongqing,LI Xiang (Xianyang Hospital of Yan′an University, Xianyang 712000,China)
Abstract:ObjectiveTo investigate the effect of insulin combined with tanshinoneⅡA on peripheral neuropathy in diabetic rats and to elucidate a possible mechanism. Methods Forty male SD rats were randomized equally into control group,DPN model group,Insulin group and Insulin+tanshinoneⅡA group. Four weeks after administration of the corresponding drugs,cell apoptosis and apoptosis related protein,such as Bax and Bcl-2,mitochondrial membrane potential and the cytoplasm and mitochondria change of Bax and Cytochrome C amount in sciatic nerve were examined. ResultsCompared with the control group,the levels of BG,Hb1Ac,cell apoptosis and Bax in DPN group significantly increased (P<0.01) while mitochondrial membrane potential and Bcl-2 significantly decreased. In DPN groups,Bax released from cytoplasm to mitochondrial,while cytochrome C was opposite with that in the case of Bax. Compared with insulin group,insulin combined with tanshinoneⅡA group significantly decreased the level of BG and HbA1c,markedly inhibited the cell apoptosis,markedly increased the mitochondrial membrane potential and inhibited the translocation of Bax and Cytochrome C. Conclusion Insulin combined with tanshinoneⅡA significantly inhibited the cell apoptosis probably by suppressing the mitochondrial apoptotic pathways.
Key words: insulin;tanshinoneⅡA;diabetic peripheral neuropathy
糖尿病周围神经病变是糖尿病最常见的慢性并发症之一,属于DM微血管病变,其发病率高达60%~90%[1-2],且有逐渐增高的趋势。DPN的发病机制较为复杂,目前研究认为可能与微血管病变、糖基化终产物的形成、多元醇代谢及蛋白激酶C途径激活等有关[3-4]。体内高血糖状态将导致氧化应激反应增加[5],而氧化应激又与上述的发病因素相互影响,作用于DPN发生、发展的多个环节。高血糖及其诱导的氧化应激可激活线粒体凋亡途径,参与周围神经细胞的损伤过程[6],进而影响其功能。因此,控制血糖的同时,抗氧化治疗有可能成为DPN防治的新途径。丹参酮ⅡA作为中药丹参根部的主要药效成分,具有稳定细胞结构、增强细胞抗氧化能力和提高机体超氧化物歧化酶活性的作用;胰岛素是控制高血糖的有效方法之一,在糖尿病及其并发症治疗中起着不可替代的作用。本实验首次提出将胰岛素与丹参酮ⅡA联合用于治疗DPN,旨在研究两药联合应用对DPN大鼠周围神经细胞凋亡及相关蛋白、线粒体膜电位及细胞浆/线粒体中Bax和Cytochrome C表达的影响。从而探讨两药联合通过线粒体途径抑制DPN大鼠周围神经细胞凋亡,以期为DPN的防治提供参考。
1 仪器与材料
1.1 仪器 血糖仪和血糖试纸(购自美国强生公司);电泳仪和半干转印仪(美国BIO-RAD公司);低温高速离心机(日立HITCH公司)。
1.2 试药 链脲佐菌素购买于Sigma公司;中效胰岛素由丹麦诺和灵公司生产;血糖试纸为强生公司产品;Modified Lowry protein assay kit 为Pierce公司产品;抗Bax抗体、抗Bcl-2抗体和Cytochrome C抗体购自Sigma公司。
1.3 动物 成年雄性SD大鼠40只,体质量200±20 g,购自西安交通大学医学院动物中心。
2 方法
2.1 动物分组与处理成年雄性SD大鼠40只,体质量200±20 g。随机分为4组:正常对照组、DPN模型组、胰岛素治疗组和胰岛素+丹参酮ⅡA治疗组,每组10只。正常对照组大鼠常规饲养,不做任何处理;DPN模型组、胰岛素治疗组和胰岛素+丹参酮ⅡA治疗组鼠采用一次性腹腔注射STZ 50 mg·kg-1复制大鼠糖尿病模型,1周后于大鼠尾尖采血,血糖仪测定血糖,并测尿糖。待DM模型建立后,继续饲养6周,检测大鼠尾部SNCV,以尾部SNCV<30 m·s-1为DPN大鼠成模标准,待DPN模型成功建立后,DPN组大鼠不再做任何处理,胰岛素治疗组给予皮下注射胰岛素(1 u·kg-1·d-1)4周,胰岛素+丹参酮ⅡA治疗组给予皮下注射胰岛素(1 u·kg-1·d-1)同时丹参酮ⅡA(30 mg·kg-1·d-1)灌胃4周。
2.2 检测BG 处死前腹主动脉采血检测血糖和糖化血红蛋白( hemoglobin A1c,HbA1c)。采用One TouchⅡ血糖仪和血糖试纸测定血糖水平,微柱法测定HbA1c浓度。
2.3 标本制备大鼠断头处死,迅速分离并取双侧坐骨神经(在膝关节上方取长约4 cm的坐骨神经干),入液氮保存。
2.4 线粒体膜电位测定取适量组织制成单细胞悬液,将100 μL细胞悬液加入5 mL的流式测定管中,在测定管中加入1 μL JC-1工作液,阴性对照管不加,轻轻混匀。将测定管和对照管置于37 ℃培养箱中孵育15~20 min;吸取500 μL PBS缓冲液分别加入测定管中,上机检测。流式细胞仪激发波为488 nm,红色荧光的最大发射波长为580/590 nm,绿色荧光的最大发射波长为510/527 nm,以红/绿荧光强度比值代表线粒体膜电位。
2.5 细胞凋亡测定组织经40 g·L-1多聚甲醛固定,常规石蜡包埋,切片。切片在二甲苯中脱蜡 5~10 min。换用新鲜的二甲苯,再脱蜡5~10 min。无水乙醇5 min,体积分数90%乙醇2 min,体积分数70%乙醇2 min,蒸馏水2 min。滴加适量不含DNase的蛋白酶K,37 ℃作用20 min,PBS 洗涤3次。每个样本加入2 μL TdT 酶和48 μL荧光标记液混合的TUNEL检测液,37 ℃避光孵育60 min,PBS洗涤3次。每个样本滴加50 μL DAPI,PBS洗涤3次后在显微镜下计数凋亡细胞和总细胞数。提取组织蛋白后Western blot方法检测促凋亡蛋白Bax和抗凋亡蛋白Bcl-2变化。
2.6 细胞浆、线粒体中Bax和Cytochrome C测定将冷冻的组织剪成碎块,加入适量RIPA蛋白提取液匀浆器匀浆,冰浴上操作;4 ℃下离心30 min,吸取上清;用Modified lowry protein assay kit测定总蛋白浓度,确定每孔上样蛋白量相等。取各组样品50 μg蛋白质,进行SDS-PAGE 分离蛋白,并将蛋白电转移至PVDF膜上,再用质量分数5%脱脂奶粉的TBST封闭1 h;加适当比例稀释抗Bax抗体,4 ℃过夜;洗膜后加辣根过氧化物酶标记的二抗,室温轻摇1 h,充分洗涤后与ECL反应,即刻与X光片曝光,目的条带使用分析仪进行分析。同法测定Cytochrome C。
2.7 统计学处理采用SPSS 13.0 统计软件,数据以均数±标准差表示,多组间比较采用单因素方差分析( ANOVA) ,组间两两比较采用最小显著性差异法( LSD 法) ,以P<0.05为差异有统计学意义。
3 结果
3.1 药物干预对DPN大鼠糖代谢的影响与对照组比较,模型组血糖和HbA1c 水平明显升高(P<0.01);与模型组比较,胰岛素治疗组及胰岛素+丹参酮ⅡA治疗组的血糖和HbA1c 水平均明显降低(P<0.01);与胰岛素单用组相比,联合用药组各指标下降更为明显(P<0.01)。结果表明,胰岛素与丹参酮ⅡA联合用药对改善DPN大鼠的糖代谢更为显著,见表1。
表1 胰岛素与丹参酮ⅡA联合对DPN大鼠糖代谢的影响
Tab.1Effects of combination of insulin and tanshinoneⅡA on blood glucose andHbA1cinDPN rats

项目对照组DPN胰岛素组胰岛素+丹参酮ⅡABG/mmol·L-15.74±0.5924.44±1.39a14.58±1.88b8.05±0.89bcHbA1c/%4.69±0.488.01±0.41a6.97±0.47**5.53±0.53bc
注:aP<0.01 vs 对照组;bP<0.01 vs DPN组;cP<0.01 vs 胰岛素组
3. 2 胰岛素与丹参酮ⅡA对线粒体膜电位的影响实验结果显示:与正常对照组比较,DPN组线粒体膜电位显著降低(P<0.01);与DPN组比较,胰岛素治疗组及胰岛素+丹参酮ⅡA治疗组线粒体膜电位显著升高(P<0.01);与胰岛素治疗组比较,胰岛素+丹参酮ⅡA治疗组线粒体膜电位显著升高(P<0.01)。
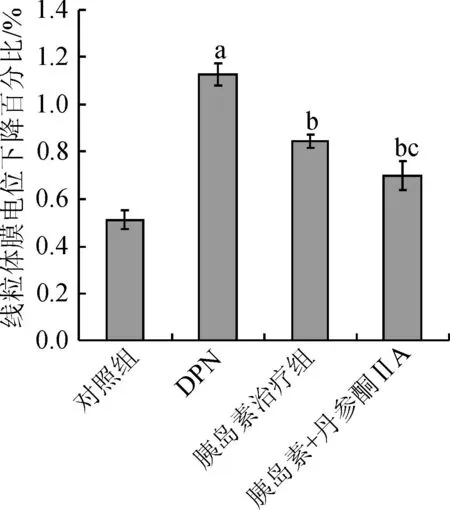
图1 胰岛素与丹参酮ⅡA对线粒体膜电位的影响
Fig.1Effects of combination of insulin and tanshinoneⅡA on mitochondrial membrane potentialinDPN rats
注:aP<0.01 vs对照组;bP<0.01 vs DPN组;cP<0.01 vs胰岛素组
3.3 胰岛素与丹参酮ⅡA对细胞凋亡的影响TUNEL检测结果显示:与正常对照组比较,DPN组细胞凋亡显著增加(P<0.01);与DPN组比较,胰岛素治疗组及胰岛素+丹参酮ⅡA治疗组细胞凋亡显著下降(P<0.01);与胰岛素治疗组比较,胰岛素+丹参酮ⅡA治疗组细胞凋亡显著下降(P<0.01);结果表明,胰岛素与丹参酮ⅡA联合应用在抑制细胞凋亡方面明显优于单用胰岛素。
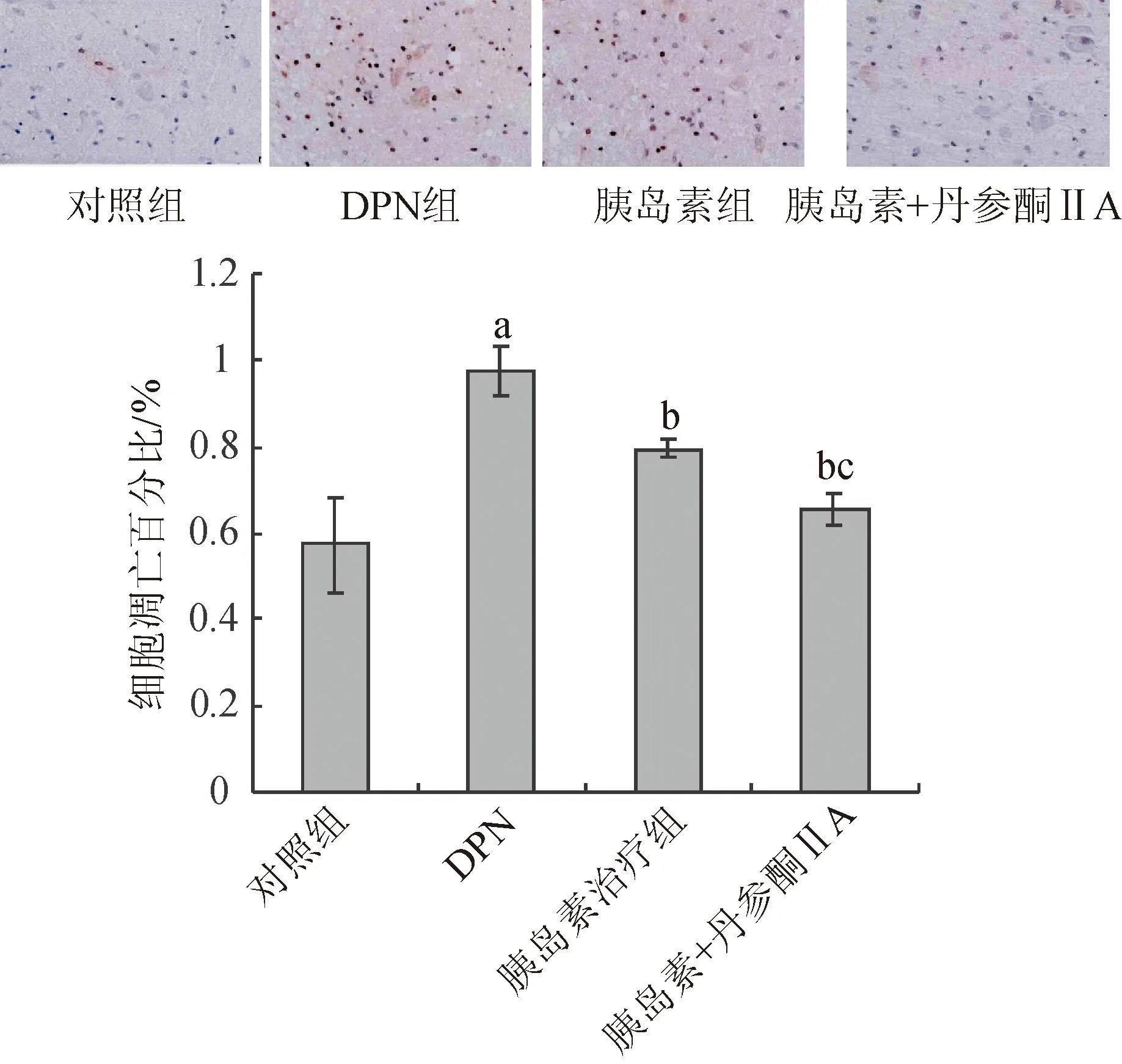
图2 胰岛素与丹参酮ⅡA对细胞凋亡的影响
Fig.2Effects of combination of insulin and tanshinoneⅡA oncell apoptosisinDPN rats
注:aP<0.01 vs对照组;bP<0.01 vs DPN组;cP<0.01 vs胰岛素组
Western blot结果显示:与正常对照组比较,DPN组Bax蛋白水平显著增加,同时Bcl-2显著降低(P<0.01);与DPN组比较,胰岛素治疗组及胰岛素+丹参酮ⅡA治疗Bax蛋白水平显著下降,同时Bcl-2显著升高(P<0.01);与胰岛素治疗组比较,胰岛素+丹参酮ⅡA治疗组Bax蛋白水平显著下降,同时Bcl-2显著升高(P<0.01)。

图3 胰岛素与丹参酮ⅡA对Bax和Bcl-2表达的影响
Fig.3Effects of combination of insulin and tanshinoneⅡA onBax and Bcl-2 in DPN rats
注:aP<0.01 vs对照组;bP<0.01 vs DPN组;cP<0.01 vs胰岛素组
3.4药物干预下细胞浆/线粒体中Bax和Cytochrome C的变化Western blot结果显示:与正常对照组比较,DPN组胞浆Bax向线粒体转位,线粒体中Cytochrome C向细胞浆转位;与DPN组比较,胰岛素治疗组及胰岛素+丹参酮ⅡA治疗组Bax向线粒体转位,线粒体中Cytochrome C向细胞浆转位均显著减少(P<0.01);与胰岛素治疗组比较,胰岛素+丹参酮ⅡA治疗组Bax向线粒体转位,线粒体中Cytochrome C向细胞浆转位均显著减少(P<0.01)。
4 讨论
急慢性高血糖均可引起活性自由基产生过多,超过自身抗氧化能力,便产生氧化应激状态[7-9],氧化应激可通过直接损伤和激活各种通路的方式损伤血管和神经组织,导致细胞凋亡,最终影响神经组织功能。因此,控制血糖的同时,改善氧化应激对于防治周围神经病变至关重要。胰岛素是快速控制高血糖的最有效方法[10];丹参酮ⅡA具抗缺血缺氧、改善微循环、抑制血小板黏附聚集功能、抗血栓形成作用以及抗氧化应激作用。因此,我们首次提出将胰岛素与丹参酮ⅡA联合用于DPN。
本实验采用STZ成功诱导糖尿病动物模型,6周后通过大鼠尾部SNCV检测,模型组神经传导速度显著下降,表明长时间的高血糖刺激可导致大鼠发生神经病变。胰岛素与丹参酮ⅡA联合比单用胰岛素治疗更能显著增加神经传导速度,这说明胰岛素联合丹参酮ⅡA能够显著改善糖尿病导致的周围神经病变。
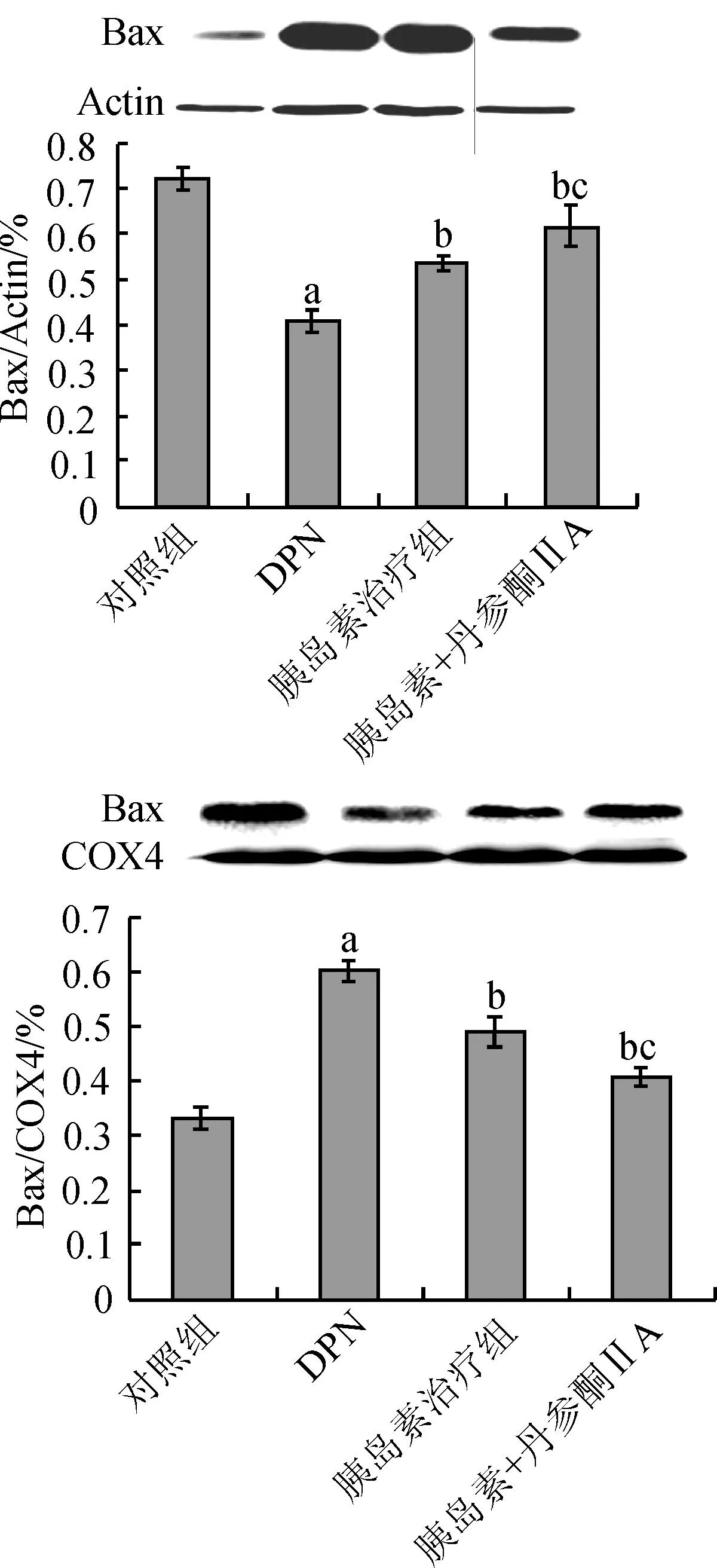
图4 胰岛素与丹参酮ⅡA对细胞浆和线粒体中Bax表达的影响
Fig.4Effects of combination of insulin and tanshinone ⅡA on Bax in the cytoplasm and mitochondria in DPN rats
注:aP<0.01 vs对照组;bP<0.01 vs DPN组;cP<0.01 vs胰岛素组
研究表明,高血糖及其诱导的氧化应激可导致细胞凋亡,氧化应激导致的细胞凋亡主要是通过线粒体途径来实现的,细胞凋亡最初的改变是线粒体膜电位下降[11-13]。受损伤的膜电位导致线粒体的通透性增高,线粒体中的凋亡蛋白释放到胞浆启动细胞凋亡程序[14-15]。TUNEL法和流式细胞术结果显示,模型组出现明显凋亡且线粒体膜电位显著性下降,胰岛素联合丹参酮ⅡA能够显著降低细胞凋亡,并升高线粒体膜电位;Western blot结果显示,两药联合使用可使促凋亡蛋白Bax表达显著降低,抗凋亡蛋白Bcl-2表达显著升高;这说明两药联合在抗细胞凋亡中具有协同作用。实验结果还显示,胰岛素与丹参酮ⅡA联合能够抑制Bax由细胞浆向线粒体同时抑制Cytochrome C由线粒体向细胞浆的转位;说明两药联合是通过抑制线粒体途径抗DPN大鼠周围神经细胞凋亡。
总之,本研究结果表明:胰岛素与丹参酮ⅡA合用比单独使用胰岛素更能有效改善糖尿病大鼠的糖代谢紊乱,抑制细胞凋亡和升高线粒体膜电位。本实验两药联合时胰岛素给药剂量与单用胰岛素时胰岛素的剂量一致,那么合用时减少胰岛素剂量能否达到同样的效果,尚有待进一步研究。此外,胰岛素与丹参酮ⅡA联合用药对DPN保护作用的详细分子机制有待进一步阐明。
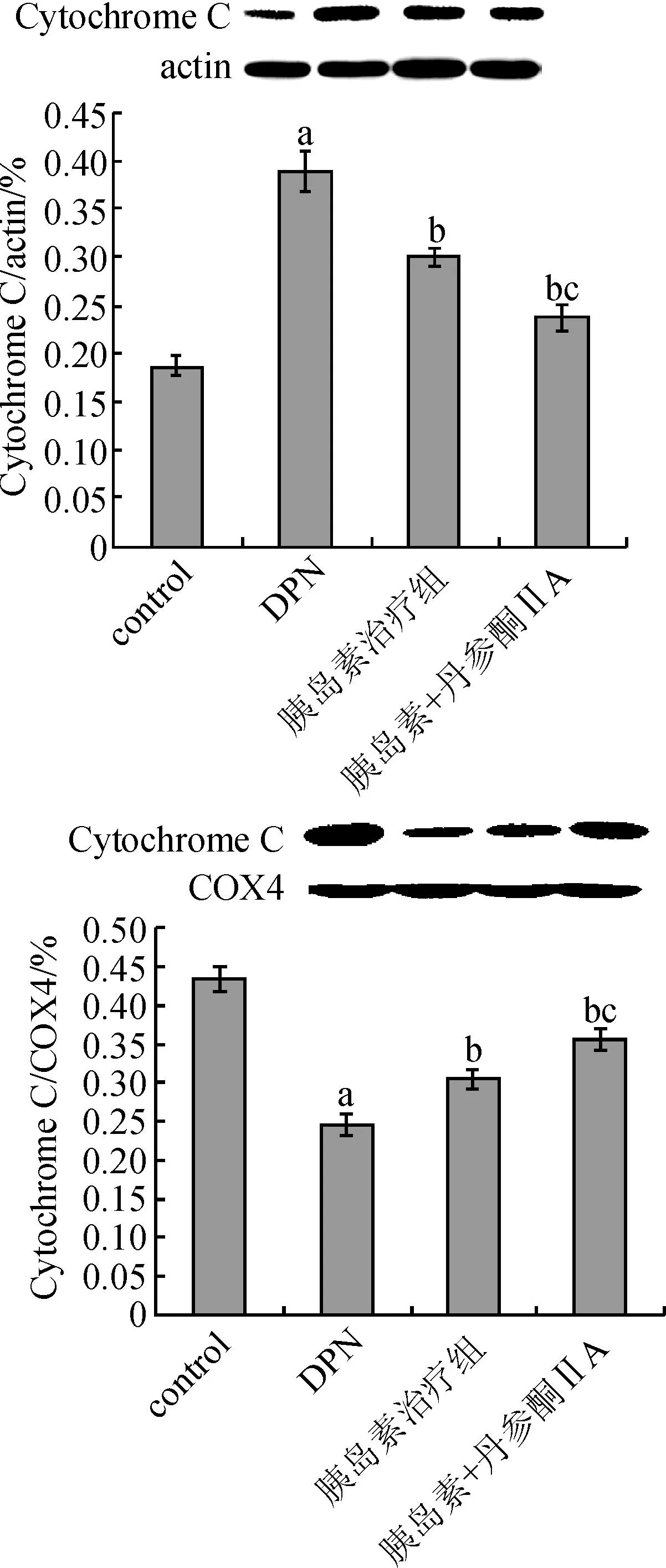
图5 胰岛素与丹参酮ⅡA对细胞浆和线粒体中Cytoshrome C表达的影响
Fig.5Effects of combination of insulin and tanshinone ⅡA on Cytochrome C in the cytoplasm and mitochondria in DPN rats
注:aP<0.01 vs对照组;bP<0.01 vs DPN组;cP<0.01 vs胰岛素组
参考文献:
[1]Naito R,Tohda C.Characterization of anti-neurodegenerative effcets of polygala tenuifolia in A(25-35)-treated cortical neurons[J].Biol Pharm Bull,2006,29(9):1892-1896.
[2]范建华,冯文丽,袁志林.糖尿病周围神经病变的中医证-治用药规律分析[J].中国医药指南,2012,10(8):219-221.
[3]Yagihashi S,Yamagishi S I,Wada R,et aI.Neuropathy in diabetic mice overexpressing human aldose reductaseand effects of aldose reductase inhibitor[J].Brain,2001,124(pt12):2448-2458.
[4]Hafer-Macko C E,Ivey F M,Gyllre K A,et aI.Thrombomodulin deficiency in human diabetic nerve microvasculature[J].Diabetes,2002,51(6):1957-1963.
[5]Mohanty P,HaInouda W,Garg R,et a1.Glucosechallenge stimulates reactive oxygen species(ROS) generation byleucocytes[J].J Clin EndocrinoI Metab,2000,85(8):2970-2973.
[6]Brownlee M. The pathobiology of diabetic complications a unifying mechanism[J].Diabetes,2005,54(6): 1615-1625.
[7]LI Xing,LI Meirong,GUO Zhixin. Effects of adiponectin on oxidative stress and apoptosis in human cardiac myocytes cultured with high glucose[J]. Chin Med J,2012,125(23):4209-4213
[8]Wei Yu,Jiliang Wu,Fei Cai,et al. Curcumin alleviates diabetic cardiomyopathy in experimental diabetic rats[J].PLoS One,2012,7(12):e52013.
[9]M Asrih,S Steffens.Emerging role of epigenetics and miRNA in diabetic cardiomyopathy[J].Cardiovasc Pathol,2013,22:117-125.
[10]韩旭亮,石俊峰,龙丽辉,等.胰岛素及其类似物治疗糖尿病进展[J].西北药学杂志,2012, 27(3):277-279
[11]S Marchi,C Giorgi,J M Suski,et al. Mitochondria-ros crosstalk in the control of cell death and aging [J]. J Signal Transduct,2012,2012:17.
[12]E J Anderson,E Rodriguez,C A Anderson,et al. Increased propensity for cell death in diabetic human heart is mediated by mitochondrial dependent pathways [J]. Am J Physiol Heart Circ Physiol,2011,300(1):H118-H124.
[13]H M onkemann,A S DeVriese,H J Blom,et al. Early molecular events in the development of the diabetic cardiomyopathy [J]. Amino Acids,2002,23(1):331-336.
[14]P M Rindler,S M Plafker,L I Szweda,et al. High dietary fat selectively increases catalase expression within cardiac mitochondria[J]. J Biol Chem,2013,288:1979-1990.
[15]D M Ansley,B Wang. Oxidative stress and myocardial injury in the diabetic heart[J]. J Pathol,2013,229:232-241.

