HIF-1α@Fe3O4纳米颗粒标记对胰腺癌干细胞增殖及凋亡的影响
·论著·
HIF-1α@Fe3O4纳米颗粒标记对胰腺癌干细胞增殖及凋亡的影响
谢晓东朱海涛吴荧荧黄文斯王颖吴恺迪张礼荣王冬青
【摘要】目的探讨缺氧诱导因子-1α螯合四氧化三铁(HIF-1α@Fe3O4)纳米颗粒标记胰腺癌干细胞的可行性,并观察胰腺癌干细胞被标记后的增殖及凋亡变化。方法采用无血清培养法培养胰腺癌细胞株PANC1干细胞,将获得的干细胞与5、15、45、135 μg/ml的HIF-1α@Fe3O4纳米颗粒共孵育24 h,采用普鲁士蓝染色法观察胰腺癌干细胞的标记率,采用四甲基偶氮唑蓝比色法检测胰腺癌干细胞的增殖活性,采用流式细胞仪检测胰腺癌干细胞的凋亡。结果HIF-1α@Fe3O4纳米颗粒与胰腺癌干细胞共培养24 h后的胞质内可见不同程度的蓝色铁染颗粒,且随着HIF-1α@Fe3O4浓度的增加而增加,浓度为45 μg/ml时标记率达100%。未标记的干细胞及5、15、45、135 μg/ml HIF-1α@Fe3O4标记的胰腺癌干细胞的细胞凋亡率分别为(3.76±0.96)%、(4.38±0.84)%、(4.36±1.22)%、(3.80±0.11)%、(4.78±0.98)%,差异无统计学意义(P>0.05);未标记的干细胞与各浓度纳米颗粒标记的干细胞细胞存活率的差异亦无统计学意义(P>0.05)。结论HIF-1α@Fe3O4纳米颗粒可用于标记胰腺癌干细胞,且不影响胰腺癌干细胞的增殖及凋亡。
【关键词】胰腺肿瘤;缺氧诱导因子-1α;四氧化三铁;干细胞;细胞增殖;细胞凋亡
DOI:10.3760/cma.j.issn.1674-1935.2015.01.006
基金项目:江苏省自然基金(BK2011487);镇江市社会发展项目(SH2013026);江苏大学大学生科研立项资助项目(12A209)
收稿日期:(2014-09-16)
Effect of HIF-1α@Fe3O4nanoparticles tag on proliferation and apoptosis of pancreatic cancer stem cellsXieXiaodong,ZhuHaitao,WuYingying,HuangWensi,WangYing,WuKaidi,ZhangLirong,WangDongqing.DepartmentofRadiology,AffiliatedHospitalofSuzhouUniversity,Zhenjiang212001,China
Correspondingauthor:ZhuHaitao,Email:zhht25@163.com
Abstract【】ObjectiveTo explore the feasibility of HIF-1α@Fe3O4 nanoparticles tag of pancreatic cancer stem cells, and to investigate the proliferation and apoptosis rate of the labeled pancreatic cancer stem cells. MethodsPANC1 pancreatic cancer stem cells were cultured in serum-free medium, and then the pancreatic cancer stem cells were co-cultured with different concentrations of HIF-1α@Fe3O4(5 、15、45 、135 μg/ml) for 24 h. Prussian blue staining method was used to determine the labeling efficiency. MTT method was used to analyze the proliferation of pancreatic cancer stem cells. Also, flow cytometry was used to evaluate apoptosis. ResultsPrussian blue staining showed various number of blue-stained iron particles in the cells after co-culture of HIF-1α@Fe3O4 nanoparticles and pancreatic cancer stem cells. And the number of blue-stained iron particles increased with the concentration of HIF-1α@Fe3O4, and the labeled rate reached 100% with the concentration of 45 μg/ml or above. The apoptosis rates of stem cells of 5, 15, 45, 135 μg/ml HIF-1α@Fe3O4 tag and stem cells of without tag were (4.38±0.84)%, (4.36±1.22)%, (3.8±0.11)%, (4.78±0.98)%, (3.76±0.96)%, and the difference between the two groups was not statistically significant (P>0.05); and the survival rates between the two groups was not statistically significant (P>0.05), either. ConclusionsHIF-1α@Fe3O4 nanoparticles can be used for tagging pancreatic cancer stem cells, and they do not affect the proliferation and apoptosis of pancreatic cancer stem cells.
【Key words】Pancreatic neoplasms;Hypoxia-inducible factor 1, alpha subunit;Ferrosoferric oxide;Stem cells;Cells proliferation;Apoptosis

作者单位:212001镇江,江苏大学附属医院影像科
通信作者:朱海涛,Email:zhht25@163.com
缺氧诱导因子-1α(hypoxiainduciblefactor-1α,HIF-1α)是在缺氧诱导的细胞核抽提物中发现的,最先由Semenza等[1]报道。它是缺氧诱导基因转录和信息传递中最重要的因子,在调控有氧能量代谢、肿瘤血管生成、侵袭转移、细胞凋亡及放疗和化疗抵抗等生物学效应中都发挥着重要作用[2-3]。磁共振成像(MRI)是一种无创、信号敏感和组织分辨率高的显像方式,纳米磁粒子Fe3O4因良好的生物相容性和MRI信号敏感性而常用于离体和活体的生物学研究[4]。本研究根据已知的HIF-1α可识别的核酸序列5′-RCGTG-3′设计、合成核酸序列,并使其螯合于纳米磁粒子Fe3O4上合成HIF-1α@Fe3O4,用于探索该纳米颗粒对胰腺癌干细胞标记的可行性以及对细胞增殖、凋亡的影响,为后期应用于磁共振靶向成像及靶向治疗奠定基础。
材料与方法
一、试剂及材料
胎牛血清(FBS)、细胞培养基DMEM/F12、培养基添加剂B27、表皮生长因子(EGF)、碱性成纤维母细胞生长因子(bFGF)、胰岛素及转铁蛋白均购于美国Gibco公司。胰蛋白酶购于Amersco 公司。 二甲亚砜(DMSO)以及四甲基偶氮唑蓝(MTT)购于Sigma 公司,Annexin V-PI细胞凋亡检测试剂盒购自南京凯基生物公司。HIF-1α螯合于纳米磁粒子Fe3O4的合成物HIF-1α@Fe3O4由江苏大学化工学院合成。胰腺癌细胞系PANC1购于中国科学院上海细胞研究所。
二、方法
1.胰腺癌干细胞培养:PANC1细胞常规培养、传代。培养三代到细胞状态稳定后采取本课题组前期实验采用的无血清培养方式,并在培养液中加入20 ng/ml EGF、20 ng/ml B27及bFGF、5 μg/ml胰岛素、2.75 μg/ml转铁蛋白等培养胰腺癌干细胞[5]。
2.HIF-1α@Fe3O4标记胰腺癌干细胞:收集胰腺癌干细胞,用培养液吹打成单细胞悬液,调整细胞密度为5×105/ml,接种于6孔板,每孔2 ml。4个孔中分别加入5、15、45、135 μg/ml的HIF-1α@Fe3O4纳米颗粒,剩余2孔加入等体积的培养基作为对照,实验设置3组6孔板。6孔板置培养箱中孵育24 h后取出,弃培养上清,用预冷的PBS清洗3遍去除游离的HIF-1α@Fe3O4,再用4%戊二醛溶液固定细胞约20 min,用预冷的PBS洗涤细胞3遍,加入Perl试剂(2%亚铁氰化钾和6%盐酸混合溶液)孵育30 min,用PBS再次清洗细胞3遍,最后用1%核固红水溶液复染5 min,用蒸馏水洗去多余的核固红,置显微镜下观察,用Image J软件分析图片,结果以细胞内颗粒数表示。
3.细胞增殖检测:取上述标记的各组胰腺癌干细胞及未标记的胰腺癌干细胞制备成单个细胞悬液,接种于96孔板中,每孔200 μl,1×105个细胞,以只加培养基孔作为空白对照。置37℃、5% CO2及饱和湿度的培养箱中培养1~6 d,每个时间点设3个复孔。到培养时间时在每孔中加入5 mg/ml MTT溶液20 μl,继续孵育4 h,弃上清液,加入150 μl DMSO,置摇床振荡10 min,上酶标仪检测波长490 nm处的吸光度值(A490值),以空白对照孔调零,绘制细胞生长曲线。
4.细胞凋亡测定:取标记的各组胰腺癌干细胞和未标记的胰腺癌干细胞,弃去上清,用3 ml预冷的PBS漂洗2次,将细胞重悬于预冷的70%乙醇中4℃固定1~2 h,离心弃去固定液,用3 ml PBS重悬细胞,400目筛网过滤、离心收集细胞,加含有1 μl PI和5 μl AnnexinV 的缓冲液,室温下放置15 min,加400 μl的缓冲液混匀,上流式细胞仪检测细胞凋亡。
三、统计学处理

结果
一、HIF-1α@Fe3O4标记胰腺癌干细胞的效率
在无血清培养基条件下肿瘤细胞呈悬浮半贴壁的球形生长,细胞表面CD133高表达(图1)。HIF-1α@Fe3O4纳米颗粒与胰腺癌干细胞共培养24 h后,胞质内可见不同程度的蓝色铁染颗粒,且随着HIF-1α@Fe3O4浓度的增加而增加。当浓度为45 μg/ml HIF-1α@Fe3O4时,标记率达100%,而未标记的干细胞的胞质内未见蓝色铁染颗粒(图2)。
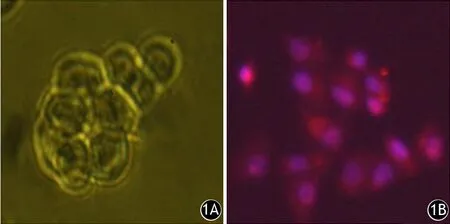
图1 无血清培养基条件下的胰腺癌干细胞 1A:细胞呈半贴壁的球形生长;1B:细胞表面CD 133高表达(免疫荧光 ×200)
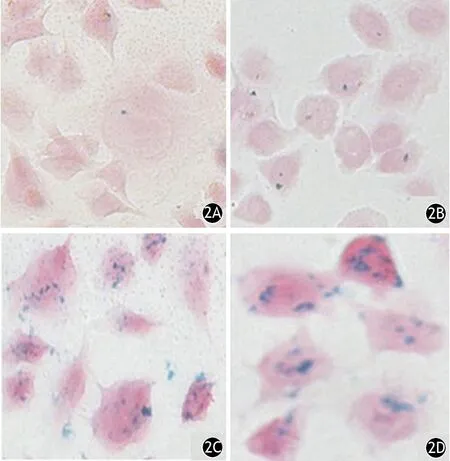
图2 5(2A)、15(2B)、45(2C)、135 (2D)μg/ml HIF-1α@Fe 3O 4纳米颗粒标记的胰腺癌干细胞
二、胰腺癌干细胞的增殖
随着时间的增加,各浓度标记组干细胞的A490值均逐渐增加,同一时间点未标记组及各浓度标记组之间的A490值差异无统计学意义(t值分别为1.004、2.417、0.348、0.174、0.076、0.295,P值均>0.05),表明HIF-1α@Fe3O4纳米颗粒毒性较小,不影响干细胞的活力(图3)。
三、胰腺癌干细胞的凋亡
未标记的胰腺癌干细胞及5、15、45、135 μg/ml HIF-1α@Fe3O4标记的胰腺癌干细胞早期及晚期的总细胞凋亡率分别为(3.76±0.96)%、(4.38±0.84)%、(4.36±1.22)%、(3.80±0.11)%、(4.78±0.98)%(图4),各组间的差异无统计学意义(t=1.807,P>0.05),表明 HIF-1α@Fe3O4纳米颗粒不影响胰腺癌干细胞的正常凋亡。
讨论
众所周知,肿瘤干细胞在肿瘤的发生、发展以及复发方面起着决定性的作用[6-9],因此对干细胞的监测及检测对于患者的治疗及预后判断有着至关重要的作用。Fe3O4纳米粒子对MRI的显像具有信号强度变化显著及对人体无伤害的优势[10-12],因此采用Fe3O4纳米粒子标记干细胞,为其成像提供新的方法与思路。
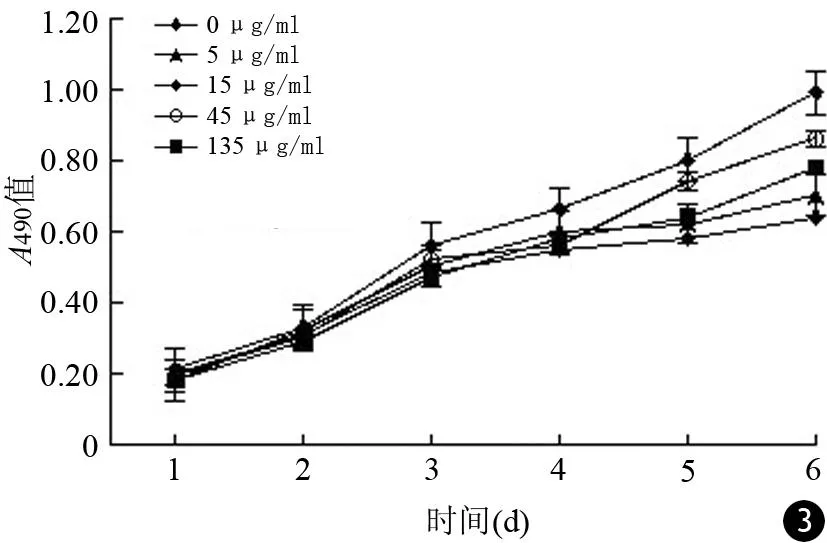
图3 不同浓度HIF-1α@Fe 3O 4纳米颗粒标记的胰腺癌干细胞的生长曲线
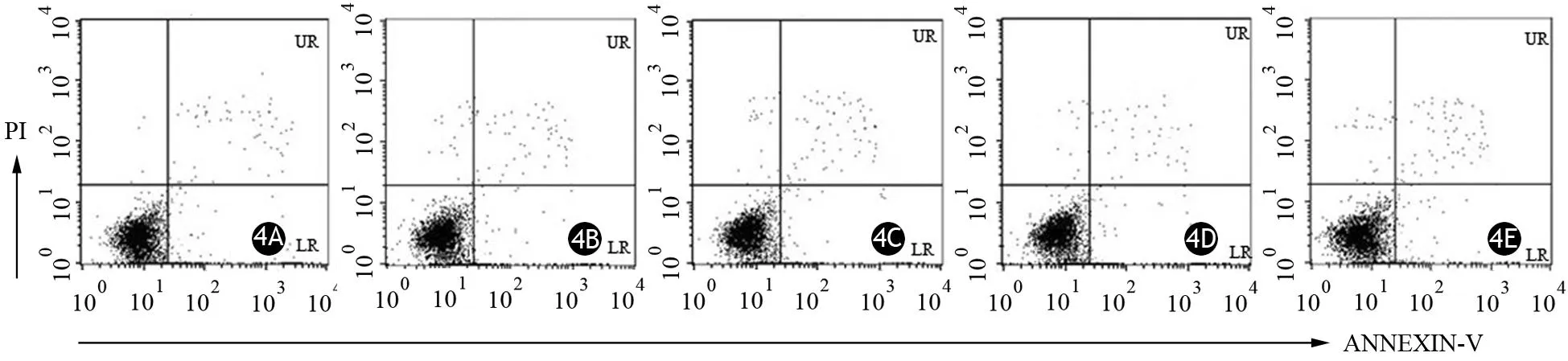
图4 未标记(4A)及5、15、45、135 μg/ml(4B~4E)HIF-1α@Fe 3O 4纳米颗粒标记的胰腺癌干细胞的细胞凋亡率
HIF-1α是缺氧条件下的一种核心转录因子,参与多种肿瘤细胞的转录以及新生血管形成和转移过程[13-14],增强肿瘤细胞在缺氧条件下的生存能力。Zhong等[15]检测了179例19种肿瘤标本的HIF-1α表达,结果显示包括胰腺癌在内的13种肿瘤的HIF-1α均有不同程度的表达,而在良性肿瘤和癌旁正常组织中则未见表达。Akakurat等[16]报道,在所选取的20种胰腺癌细胞株中均有HIF-1α表达。Semenza等[17]发现5′-RCGTG-3′是HIF-1α可识别的基因序列。由于HIF在肿瘤细胞中高表达,因此在纳米磁粒子上修饰含有5′-RCGTG-3′核酸序列不仅可以与高表达HIF-1α的肿瘤细胞结合,更可以在磁共振上实时监测肿瘤细胞的发生和发展,为早期检测和治疗肿瘤提供了新的检测方法和治疗思路。
本研究结果显示,HIF-1α@Fe3O4成功地标记到胰腺癌干细胞,细胞标记率随HIF-1α@Fe3O4浓度的增加而增加。HIF-1α@Fe3O4标记后胰腺癌干细胞的增殖及凋亡均未受影响,为后期MRI检测胰腺癌干细胞提供了实验基础。同时,根据转录因子HIF-1α识别的序列可设计出更加特异性结合的探针,以提高诊断的灵敏度和特异性。
参考文献
[1]Semenza GL, Wang GL. A nuclear factor induced by hypoxia via denovo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J]. Mol Cell Biol,1992, 12(12):5447-5454.
[2]Imai T, Horiuchi A, Wang C, et al. Hypoxia attenuates the expression of E-cadherin via up-regulation of SNAIL in ovarian carcinoma cells[J]. Am J Pathol, 2003, 163 (4): 1437-1447.
[3]Minoia C, Quero C, Asselti M, et al. Changes in angiogenesis and hypoxia-inducible factor-1 alpha protein expression in relapsed/refractory indolent non-Hodgkin lymphomas[J]. Br J Haematol, 2013, 163(5), 640-645.
[4]Zhou R, Acton PD, Ferrari VA, et al. Imaging stem cells implanted in infarcted myoeardium[J]. J Am Coll Cardiol, 2006,48(10):2094-2106.
[5]Wang D, Zhu H, Zhu Y, et al. CD133(+)/CD44(+)/Oct4(+)/Nestin(+) stem-like cells isolated from Panc-1 cell line may contribute to multi-resistance and metastasis of pancreatic cancer[J]. Acta Histochem, 2013, 115(4):349-356.
[6]Reya T, Morrison SJ, Clarke MF, et al. Stem cells, cancer, and cancer stem cells[J]. Nature, 2001, 414 (6859): 105-111.
[7]Visvader JE, Lindeman GJ. Cancer stem cells in solid tumors: accumulating evidence and unresolved questions[J]. Nat Rev Cancer, 2008, 8(10):755-768.
[8]Dick JE. Stem cell concepts renew cancer research[J]. Blood, 2008, 112(13): 4793-4807.
[9]Vries RG, Huch M, Clevers H. Stem cells and cancer of the stomach and intestine[J]. Mol Oncol, 2010, 4(5):373-384.
[10]Zhang C, Xie X, Liang S, et al. Mono-dispersed high magnetic resonance sensitive magnetite nanocluster probe for detection of nascent tumors by magnetic resonance molecular imaging[J]. Nanomedicine,2012, 8(6): 996-1006.
[11]Chien LY, Hsiao JK, Hsu SC, et al. In vivo magnetic resonance imaging of cell tropism, trafficking mechanism, and therapeutic impact of human mesenchymal stem cells in a murine glioma model[J]. Biomaterials, 2011, 32(12): 3275-3284.
[12]Yang Y, Schumacher A, Yang Y, et al. Monitoring bone marrow-originated mesenchymal stem cell traffic to myocardial infarction sites using magnetic resonance imaging[J]. Magn Reson Med, 2011, 65(5):1430-1436.
[13]Couvelard A, O′Toole D, Leek R, et al. Expression of hypoxia-inducible factors is correlated with the presence of a fibrotic focus and angiogenesis in pancreatic ductal adenocarcinomas[J]. Histopathology, 2005,46(6): 668-676.
[14]汪必成,刘志苏.缺氧诱导因子-1α在肝癌中的表达及其对肿瘤细胞周期的影响和临床意义[J].中华实验外科杂志,2006,23(11):1404-1405.
[15]Zhong H, De Marzo AM, Laughner E, et al. Overexpression of hypoxia-inducible factor l alpha in common human cancers and their metastases[J]. Cancer Res, 1999, 59(22): 5830-5835.
[16]Akakura N,Kobayashi M,Horiuchi I,et al. Constitutive expression of hypoxia-inducible factor-1 alpha renders pancreatic cancer cells resistant to apoptosis induced by hypoxia and nutrient deprivation[J].Cancer Res, 2001, 61(17):6548-6554.
[17]Semenza GL, Jiang BH, Leung SW, et al. Hypoxia response elements in the aldolase A, enolase 1, and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor 1[J].J Biol Chem, 1996, 271(51): 32529-32537.
(本文编辑:屠振兴)

