干预胆碱M受体对药物成瘾的影响及其与多巴胺的关系*
刘昕鹤 田 琳 刘佳琳 李新旺
(首都师范大学心理系,北京 100037)
1 引言
药物成瘾又称药物依赖、物质依赖,国际疾病及健康相关问题分类标准(International Statistical Classification of Diseases and Related Health Problems 10th Revision,ICD-10)将药物成瘾定义为一种精神及行为障碍。慢性使用阿片类药物或精神活性药物形成药物成瘾后,不仅对身心健康产生危害,同时伴随药物渴求、戒断、冲动性觅药等症状。早期普遍认为药物成瘾是一种社会问题,与个人意志力密切相关,而非是一种精神疾病,因此缺乏针对药物成瘾治疗手段的研究(Dackis&O'Brien,2005)。随着神经科学的发展,研究者逐渐开始深入探讨药物成瘾的神经机制,发现多种神经递质之间的平衡在药物成瘾过程中被打破。现在已经逐渐认可药物成瘾是一种神经性疾病,而针对药物成瘾的治疗方法的探索,也成了一个研究热点。
毒蕈碱受体(Muscarinic receptor,M受体)属于胆碱能系统中一类受体。M受体涉及到学习记忆、运动控制、注意、探究等行为及认知过程(于萍,渠春环,石密,李新旺,郭春彦,2009),同时中枢胆碱能系统的病变与多种疾病有关,如精神分裂症、帕金森症、阿尔茨海默症等症状。近些年药物成瘾的行为学研究表明,通过干预M受体功能,能有效影响药物成瘾行为。但是采用行为学方法的研究所得结论并不完全一致,甚至还存在矛盾的结论,例如在药物成瘾发展期间可卡因联合非特异性M受体抑制剂东莨菪碱腹腔注射对药物成瘾行为发展表现出增强效果(Itzhak&Martin,2000),或是抑制效果(Yee et al.,2011)。造成这种差异的原因可能是不同的研究采用了不同的药物成瘾动物模型。以上证据提示了我们需要进一步深入理解干预M受体对药物成瘾行为起作用的神经机制。而多巴胺(Dopamine,DA)是与药物成瘾密切相关的一类神经递质,M受体在多个脑区对多巴胺系统起调控作用,研究证据表明干预M受体功能影响了药物成瘾行为的同时也影响了中枢多巴胺系统,因此干预M受体可能通过影响多巴胺系统的方式对药物成瘾行为起作用。最近新的研究技术方法的普及,及新的工具药物的出现,使人们在这个问题上获得了更多的相关证据。深入了解胆碱能M受体在药物成瘾中起作用的神经机制,对治疗药物成瘾具有指导意义。
2 中枢神经系统中胆碱能神经元及M受体的分布
中枢神经系统内胆碱能神经元主要集中于两块区域:基底前脑区域及脑桥中脑被盖区域。两块区域均分布有密集的胆碱能神经元,向周边脑区广泛投射。基底前脑区域的胆碱能神经元主要投射到皮质、海马、杏仁核及嗅球区域,而中脑区域胆碱能神经元投射到腹侧被盖区(Ventral tegmental area,VTA)、黑质及丘脑。除了这两大区域之外,纹状体及NAc内分布有少量胆碱能中间神经元(Cholinergic Interneurons,CIN),只占这个区域神经元总数的2%~5%,并不向外部投射。
M受体由于能被毒蕈碱(muscarine)激动,因此被称做毒蕈碱受体。同时M受体还能被乙酰胆碱(Acetycholine,Ach)所激动,乙酰胆碱也是胆碱能系统中主要的神经递质。同时胆碱系统中存在另一类胆碱受体,N受体(Nicotine receptor,N受体)。M受体在中枢神经系统及外周神经系统内均广泛分布。M受体包括5种亚型,M1~M5,均属于G蛋白偶联受体。一般认为M2及M4受体属于Gi受体,激动后对所在神经元起抑制作用,而M1、M3、M5受体属于Gs受体,激动后对所在神经元活动起刺激作用。不同的M受体亚型在中枢神经系统中表达程度并不一样。表1为M受体亚型在不同脑区中的分布。
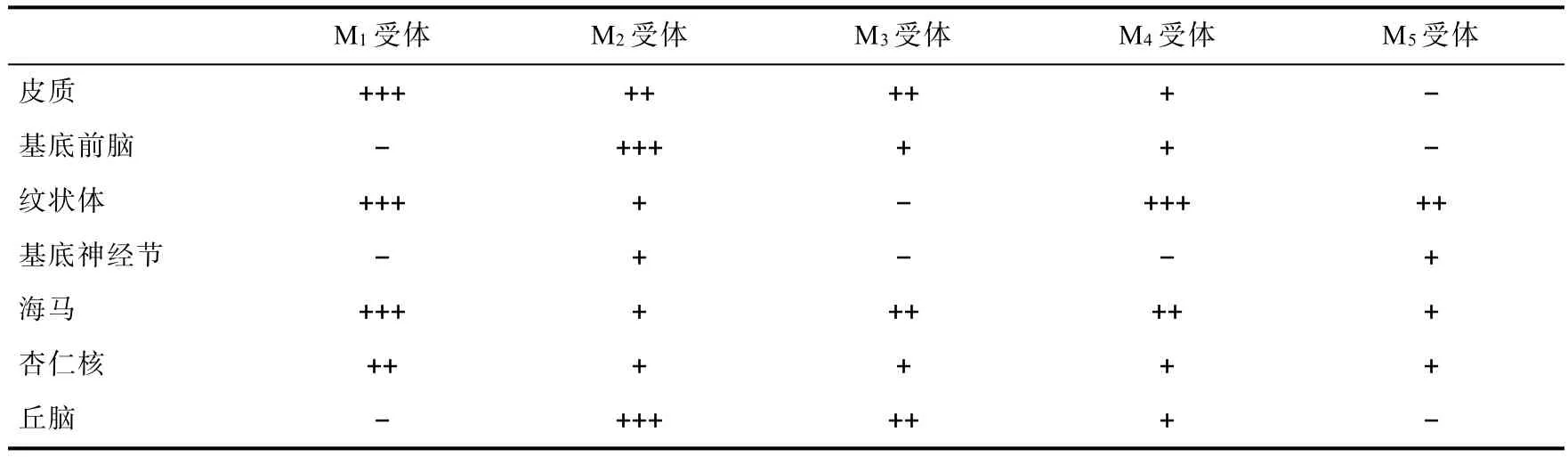
表1 不同亚型M受体在中枢神经系统内的分布
3 干预M受体功能对药物成瘾行为的影响
在药物成瘾的行为学研究中,常用的3种动物模型包括:行为敏化(Behavioral sensitization)模型以自发活动 (Locomotive activity,LA)作为行为指标,条件性位置偏爱模型(Conditional place preference,CPP),自身给药模型(Self-adminstration,SA)。尽管不同模型所研究的药物成瘾侧重点不一样,对药物成瘾测量所用行为指标也不一样,但实验流程有一定的类似,均是在发展阶段让动物反复暴露在药物的作用下,引起中枢神经系统对药物作用产生适应性变化,而在表达阶段给予一定手段诱导成瘾行为的表达,因此不同动物模型间的研究结果具有一定的可比性。
3.1 外周给药干预M受体功能对药物成瘾行为的影响
总体上来看,腹腔注射胆碱酯酶抑制剂的方式抑制了胆碱酯酶对乙酰胆碱的水解过程,从而提升了神经元突触间隙乙酰胆碱浓度,对M受体起兴奋性作用,并对阿片类药物或是精神活性药物引起的成瘾行为表达均有抑制作用。但有趣的是,抑制全身M受体功能也表现出了对成瘾行为的抑制作用。并且多数采用SA模型的研究中同时检验了自然奖赏物(例,食丸)引起行为强化的作用,而未表现出抑制效果(Liu et al.,2012;Yee et al.,2011),体现了对M受体在药物成瘾中的特异性效果。不同动物模型间对比也表现出了矛盾的结果:在吗啡LA模型中的发展过程联合腹腔注射胆碱酯酶抑制剂激动M受体,表现出了对LA表达的增强(Li,Li,Zhu,Cui,&Jiao,2010),而在吗啡CPP模型及海洛因SA模型药物成瘾的发展过程中,联合胆碱酯酶抑制剂发展期给药则表现出了对药物成瘾行为表达的抑制作用(Hikida,Kitabatake,Pastan,&Nakanishi,2003;Zhou et al.,2007),具体的研究及其结论见表2。
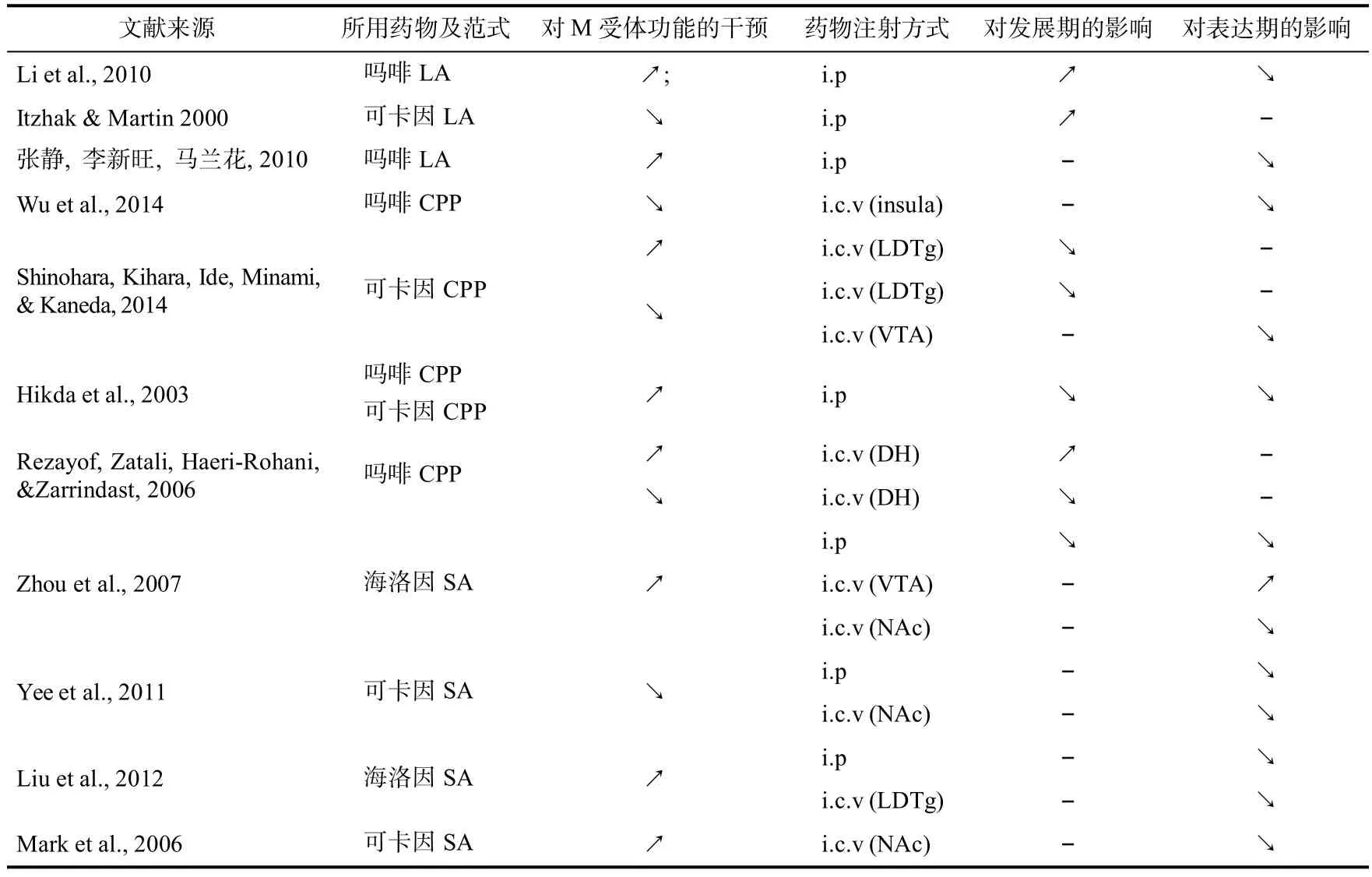
表2 采用药理学手段非特异性干预M受体功能对药物成瘾行为的影响
而特异性干预M受体亚型的功能也表现出了对药物成瘾行为的影响,并且不同亚型的M受体在药物成瘾中的作用并不一样。在精神活性药物诱导的成瘾行为表达过程中,M1受体在不同的动物模型中表现出来了不同的效果:腹腔注射M1受体抑制剂Biperiden阻断了可卡因CPP的表达,但却增强了可卡因LA的表达(Ramos,Andersen,Oliveira,Soeiro,&Galduróz,2012)。对已形成可卡因成瘾的个体在药物戒断期间反复注射偏M1及M4受体激动剂Xanomeline,引起了可卡因量效曲线右移(Thomsen,Fulton,&Caine,2014),即抑制了可卡因奖赏作用。腹腔注射M2受体抑制剂Tripitramine,则能增加多巴胺激动剂阿朴吗啡对大鼠造成的打哈欠及生殖器梳理行为(Gamberini,Bolognesi,&Nasello,2012)。腹腔注射M4受体激动剂VU0152100,反转了安非他命所诱导的即时精神活动效应及可卡因诱导的LA、CPP、SA行为的表达(Brady et al.,2008;Dencker et al.,2012);也有研究中得出特异性激动M4受体对安非他命诱导的即时诱导的精神活动效应没有效果的结论,但在药物成瘾的发展期间反复激动M4受体功能也抑制了安非他命诱导成瘾行为的发展(Ferguson et al.,2011),两者的研究差异在于所使用的M4受体激动剂不同。而剔除M4受体基因的小鼠表现对可卡因的动机更强烈(Schmidt et al.,2011)。剔除M5受体基因的小鼠,精神活性药物诱导的SA行为及CPP也显著减弱(Fink-Jensen et al.,2003)。需要注意的是,只干预外周胆碱能系统M受体也会影响药物成瘾行为。有研究者用对血脑屏障穿透率低的甲基东莨菪碱腹腔注射对药物成瘾行为进行研究,同样观察到能有效影响动物的药物成瘾行为(Thomsen et al.,2010),提示了外周胆碱能M受体同样参与了药物成瘾行为。因此,采用剔除M受体基因的动物进行培育再进行行为研究,缺陷就在于同时影响了外周M受体功能,所得行为结果并不能完全反映为是干预中枢神经M受体所起的作用。
3.2 干预不同脑区M受体功能对药物成瘾行为的影响
非特异性干预脑区M受体功能也对药物成瘾行为产生了影响。采用毒扁豆碱非特异性激动NAc内的M受体功能,抑制了SA模型中药物成瘾的复吸行为,并且能被M1受体抑制剂所反转(Mark et al.,2006;Zhou et al.,2007);而抑制NAc内的胆碱能系统功能,也抑制了SA模型中可卡因成瘾的复吸行为(Yee et al.,2011),或是增强了药物成瘾CPP的表达(Hikida et al.,2003)。不同模型间所出现的不同结果,可能与研究者所使用的药物有关,Zhou的研究中使用胆碱酯酶抑制剂,通过增强神经元间乙酰胆碱浓度,对M受体及N受体均有增强作用;而Mark及Yee的研究中使用了非特异性M受体激动剂氧化震颤素及东莨菪碱,单独作用于M受体;这种效应可能造成了实验结论出现差异。
而非特异性激动中脑区域背外侧被盖核(laterodorsal tegmental nucleus,LDTg)或脚桥核(pedunculopontine nucleus PPTg)M受体功能,均表现出了能抑制药物成瘾的复吸行为(Liu et al.,2012;Shinohara et al.,2014)。但激动中脑区域VTA的M受体功能,则表现出了增强药物成瘾行为的结果(Zhou et al.,2007);另外也有研究表明,向VTA定位微注射拟胆碱药物,也能产生与药物成瘾行为类似的CPP及SA效果(Ikemoto&Wise,2002),即也产生了奖赏效应。由上述研究结果可以看出,激动中脑区域不同核团M受体功能对药物成瘾行为表现出了不同的效果:激动VTA内M受体功能对药物成瘾行为起促进作用,而激动LDTg及PPTg内M受体功能则对药物成瘾行为起抑制作用。
脑区间干预不同亚型的M受体也表现出了不同的效果。NAc定位注射M1受体抑制剂虽然不影响动物可卡因SA行为,但能反转氧化震颤素对SA行为的抑制效果(Mark et al.,2006);采用药理学手段特异性激动LDTg的M2受体,也抑制了SA模型中动物自身给药及获取食物行为,即能抑制了刺激物的奖赏作用(Shabani,Foster,Gubner,Phillips,&Mark,2010)。虽然M5受体能被非特异性M受体抑制剂所抑制,以及被拟胆碱药物及胆碱酯酶抑制剂所激动,但缺乏普遍使用的特异性针对M5受体的工具药物。目前对M5受体的研究手段局限在采用转基因对小鼠M5受体基因进行剔除,培育后进行行为研究。在Pudmed上搜索相关文献,缺乏针对脑内M5受体在药物成瘾中影响的行为学研究。
由上述外周干预或在脑区间干预M受体及其亚型功能对药物成瘾影响的行为学研究结果可以看出,不同亚型M受体对药物成瘾行为影响方式并不一样,较为一致的结果是激动M2及M4受体功能后抑制了药物成瘾的行为,而激动M5受体后能促进药物成瘾行为。前人认为激动或抑制中枢胆碱能系统通过不同的方式在药物成瘾中起作用:1、胆碱能激动剂通过与多巴胺系统产生交互作用的方式对药物成瘾行为产生影响,而胆碱能抑制剂通过抑制成瘾记忆形成及提取的方式对药物成瘾行为产生影响(李新旺,于萍 2006),但这种解释方式并未深入到不同亚型M受体对药物成瘾影响的神经机制。
4 干预M受体功能影响药物成瘾行为过程中多巴胺系统的变化
4.1 中脑-纹状体多巴胺投射通路
尽管阿片类药物及精神活性药物作用的中枢神经靶点不一样,但它们的一个共同点是能激活中脑区域多巴胺神经元,引起纹状体背侧及腹侧NAc的多巴胺水平升高(Tzavara et al.,2004;Kalivas&O’Brien,2008)。纹状体区域的多巴胺释放促进了神经突触可塑性改变的过程(Ranaldi,2014),这个过程与行为强化密切相关。中枢神经系统反复暴露在药物的作用下,引起的神经可塑性发生变化,可能构成了药物成瘾难以戒断及反复复吸的生理基础。因此在药物成瘾的研究中,多巴胺系统一直是研究者所关注的重点。对药物成瘾治疗的一个思路是通过抑制成瘾过程多巴胺系统的变化,达到抑制药物成瘾行为的目的。
中脑区域多巴胺神经元是中枢神经系统中多巴胺的主要来源。与药物成瘾密切相关的多巴胺神经元核团包括中脑区域的VTA及黑质致密部(substantia nigra pars compacta,SNpc),两者均对纹状体投射多巴胺神经元,而纹状体及NAc中多巴胺受体得到充分表达。纹状体从其细胞结构上来分,95%以上的神经元都是中间棘突神经元(Medium spiny neurons,MSNs),延伸到NAc中,同时有少量的另外类型的中间神经元,NAc与纹状体细胞结构类似。MSNs是一类以GABA为神经递质的神经元,也是纹状体的主要输出神经元,多巴胺受体主要在MSNs上表达。MSNs树突部位与来自中脑的多巴胺投射神经元相连,因此纹状体的输出受到多巴胺释放的影响(Yager,Garcia,Wunsch,&Ferguson,2015)。多巴胺受体分为5种亚型,D1-D5型受体,也属于G蛋白偶联受体,分成了两大类:D1样(D1-like)受体,包括 D1受体与 D5受体;D2样(D2-like)受体,包括D2、D3、D4受体。D1样及D2样受体均在纹状体区域MSNs上得到表达,数量均衡(Beaulieu&Gainetdinov,2011)。其中表达D1样受体的MSNs投射到苍白球内侧及黑质网状部位,被称为直接通路(driect MSNs,dMSNs),表达D2样受体的MSNs投射到苍白球外侧及丘脑底核(indriect MSNs,iMSNs),两者在药物成瘾中的作用并不一样(Yager et al.,2015)。
4.2 干预M受体功能同时影响成瘾行为和多巴胺系统功能
当动物进行在可卡因用药行为后,中枢胆碱能神经元也会显著激活(Berlanga et al.,2003;Kamii et al.,2015)。而在吗啡成瘾过程中,中枢神经系统中乙酰胆碱及多巴胺水平均发生改变(李新旺,于萍 2006)。一部分研究在干预M受体功能对药物成瘾行为影响的同时观察到多巴胺系统的变化,并且干预不同亚型的M受体功能对多巴胺系统影响也不一样,与对药物成瘾行为的影响相对应。
干预M1受体功能对不同的精神活性药物的效果出现了差异:与正常小鼠对比,在剔除M1受体的小鼠身上,安非他命所诱导的多巴胺释放及精神活动效应均被显著增强 (Gerber et al.,2001);但可卡因联合M1受体抑制剂telenzepine腹腔注射,NAc中多巴胺水平也显著上升,但对PFC中多巴胺水平影响不显著,同时精神活动效应则被显著抑制(Tanda&Katz,2007)。虽然可卡因和安非他命均属于精神活性类药物,但两者分子式差异较大。而在剔除M2及M4受体基因的小鼠身上,中脑核团LDTg及PPTg乙酰胆碱水平基线值上升,同时伴随着纹状体区域多巴胺基线水平上升(Baghdoyan,Lydic,&Fleegal,1998;Tzavara et al.,2004),并且安非他命所诱导的多巴胺释放水平也得到了显著增加(Schmidt et al.,2011)。即时腹腔注射M4受体激动剂VU0152100抑制药物成瘾行为表达的同时,也抑制了可卡因所诱导的纹状体多巴胺水平升高的效果(Dencker et al.,2012)。采用技术特异性剔除纹状体dMSNs通路中M4受体的小鼠,精神活性药物所诱导的精神活动效应及多巴胺释放效果均得到显著增强(Jeon et al.,2010)。在剔除M5受体基因的小鼠身上,吗啡所诱导CPP效果显著下降,伴随着纹状体多巴胺水平升高效果也被抑制(Basile et al.,2002)。
以上证据提示了干预M受体同时也会引起多巴胺系统变化,而多巴胺系统同样与药物成瘾过程密切相关。因此干预胆碱能M受体时对药物成瘾行为产生影响的神经机制可能是通过多巴胺的中介作用。下面将进一步论述中枢神经系统中不同亚型M受体对多巴胺系统产生影响的方式。
5 干预M受体影响多巴胺系统的神经生物学机制
5.1 M受体对多巴胺系统产生调控作用的脑区
中枢神经系统不同脑区M受体对多巴胺系统产生调控作用的条件包括:1、存在胆碱能神经元及M受体;2、同时存在多巴胺神经元或多巴胺受体。PFC接受中脑区域的多巴胺投射及基底前脑区域的胆碱能神经元投射,而PFC则向NAc及VTA进行谷氨酸投射,PFC、VTA、NAc共同构成了一个神经环路(秦幸娜,李新旺,田琳,孙金玲,2015),并且PFC中M受体及多巴胺受体均得到高度表达,但有证据表明PFC中多巴胺系统在药物成瘾的发展过程中作用可能并不突出(Tzschentke,2001),因此药物成瘾中PFC中M受体对多巴胺系统的影响也不突出(Tanda&Katz,2007)。
从神经元位置上看,多巴胺神经元主要所在核团VTA及SNpc与胆碱能神经元密集的主要核团LDTg及PPTg均位于中脑脑干区域,距离接近。VTA接受来自LDTg的胆碱能神经元的投射,而SNpc受到来自PPTg的胆碱能神经元投射。并且这是目前SNpc及VTA所知的接受的唯一胆碱能投射(Lester,Miller,&Blaha,2010)。在VTA及SNpc中多巴胺神经元表达有N受体及M受体(Fields,Hjelmstad,Margolis,&Nicola,2007),因此LDTg及PPTg可能通过胆碱能投射在LDTg-VTA-NAc及PPTg-SNpc-纹状体通路中影响多巴胺系统。并且在药物成瘾的发展过程中,LDTg及PPTg的胆碱能投射神经元细胞膜产生了适应性变化,对Na+的通透性增加,更容易被刺激激动(Kamii et al.,2015),提示了中脑区域M受体对多巴胺系统的影响在药物成瘾中凸显。
而M受体也在纹状体多种神经元上得到表达:包括MSNs、多巴胺神经元、外部投射的谷氨酸神经元、及部分中间神经元,同时纹状体中存在少量CIN激活后释放乙酰胆碱,因此纹状体区域也存在M受体对多巴胺系统产生影响的生理基础。由于纹状体中多巴胺受体在药物成瘾中作用突出,干预纹状体M受体功能也可能通过影响多巴胺系统的方式来影响药物成瘾行为。虽然NAc与纹状体神经元组成类似,但不同亚型的M受体在NAc及在纹状体背侧中表达程度并不一样,对多巴胺系统的作用可能存在差异。并且由于纹状体众多神经递质通路及多种M受体亚型的存在,干预纹状体M受体功能对多巴胺系统的影响方式相对复杂。
5.2 不同亚型M受体影响多巴胺系统功能的神经机制
早期的离体研究中针对纹状体M受体对多巴胺系统交互作用的研究存在诸多矛盾。不同的研究中,非特异性激动纹状体M受体功能分别表现出了促进多巴胺释放(de Belleroche&Gardiner,1982;Lehmann&Langer,1982)或是抑制多巴胺释放(Kudernatsch&Sutor,1994)。近几年随着光遗传学技术的普及,许多研究者采用了这一新手段探讨这一问题。光遗传学手段及传统的电刺激手段均是对神经元进行刺激的技术,一些研究者同时采用了两种手段对比,得到了类似的结果:依据对CIN刺激频率及时间的长短,对多巴胺释放有不同的效果:单次刺激CIN,便能引起多巴胺神经元激动程度的上升并促进多巴胺释放,但对CIN进行连续刺激,反而对多巴胺的释放起抑制作用,并且抑制效果随刺激频率升高而升高,这种效果能被非特异性N受体或M受体抑制剂所反转(Cachope et al.,2012;Melchior,Ferris,Stuber,Riddle,&Jones,2015)。提示了M受体及N受体均参与了这个过程,而中介这个过程的是乙酰胆碱。
5.2.1 M2及 M4受体
M2及M4受体在中脑区域核团PPTg及LDTg胆碱能神经元轴突区域中均得到高度表达(Garzón&Pickel,2006),其中大部分M2及 M4受体分布在突触前膜,属于自受体(Autoreceptor),纹状体CIN中也分布有M2及M4自受体(Weiner,Levey,&Brann,1990;Yan&Surmeier,1996)。LDTg及PPTg的胆碱能投射神经元轴突与VTA及SNpc的多巴胺神经元的突触区域产生联系。另外中脑区域少量M2受体则在多巴胺神经元上表达,在剔除M5受体的动物身上多巴胺神经元中M2受体表达水平增加,提示了M2受体可能对M5受体的功能有代偿作用(Garzón&Pickel,2006)。而纹状体中多种神经元也表达了M2及M4受体:除了CIN外,皮质-纹状体的谷氨酸投射神经元突触末梢区域表达有M2及M4受体(Ince,Ciliax,&Levey,1997),同时dMSNs通路中也表达有M4受体。虽然M2及M4受体分布广泛,但纹状体中对多巴胺系统起调控作用的M2及M4受体分布的区域并不一样,纹状体背侧尾状核中M2及M4受体共同对多巴胺系统起调控作用,而NAc内主要是M4受体对多巴胺系统起作用(Threlfell et al.,2010)。
采用拟胆碱药物卡巴胆碱非特异性激动LDTg或PPTg胆碱能功能,能显著抑制胆碱能神经元放电活动,而在同时剔除M2受体基因及M4受体基因小鼠的脑切片上,这种效果则消失了(Kohlmeier,Ishibashi,Wess,Bickford,&Leonard,2012)。用药理学手段特异性激动中脑区域突触前膜M4受体抑制了动物觅食行为(Stachniak,Ghosh,&Sternson,2014),提示了激动中脑区域突触前膜M2及M4受体,能显著抑制胆碱能神经元的激活及动机行为。纹状体中M2及M4自受体效果类似,激动后也能抑制CIN的激活。另外谷氨酸投射神经元中表达的M2及M4受体激动后抑制谷氨酸的兴奋性传导,而谷氨酸的释放与纹状体区域神经可塑性变化密切相关(Mao&Wang,2015;Shen et al.,2015),因此在行为学习阶段反复激动M2及M4受体功能,能抑制纹状体神经可塑性的变化。而激动dMSNs中表达的M4受体功能,增强了D1样受体信号通路,即增强了dMSNs通路输出(Ferguson et al.,2011)。
向PPTg注射拟胆碱药物卡巴胆碱降低了纹状体的多巴胺释放的基线水平,而向PPTg注射非特异性M受体抑制剂东莨菪碱或M2、M4受体抑制剂methoctramine均升高了纹状体多巴胺的基线水平(Miller&Blaha,2004)。虽然纹状体中多种神经元中表达了M2及M4受体,但总的来说,促进纹状体M4及M2受体功能对多巴胺系统功能起抑制作用。从多巴胺释放的角度来看,刺激纹状体中CIN进行多巴胺释放起抑制作用,但在剔除了M2及M4受体的小鼠纹状体切片上,这种抑制作用消失了,并且这种效果能被N受体抑制剂完全替代(Shin,Adrover,Wess,&Alvarez,2015),提示了这种抑制效果是通过抑制N受体功能来完成的,而N受体在多巴胺神经元上也直接分布。胆碱能神经元突触前膜的M2及M4自受体并不能直接对多巴胺神经元起作用,但通过抑制胆碱能神经元的激活,可能间接影响了多巴胺神经元上N受体及M受体的激活状态。我们实验室的研究中表明整体抑制N受体功能对吗啡诱导的LA行为没有效果(未发表),但另外一些研究中得出证据提示了部分脑区间N受体参与了精神活性药物及阿片类药物所诱导的药物成瘾过程(Rezayof et al.,2006;Shinohara et al.,2014),并且总体上来说,非特异性激动中枢神经系统N受体功能,对多巴胺系统起促进作用(Exley&Cragg,2008)。N受体属于离子通道受体,激活后起效速度比M受体更快。结合以上证据,中枢神经系统中M2及M4自受体激活后通过抑制胆碱能神经元活动,抑制了神经元突触间隙乙酰胆碱浓度,可能对多巴胺神经元树突区域N受体及M受体的状态产生影响,从而抑制多巴胺系统功能,这种效果同时存在于中脑区域及纹状体区域。
5.2.2 M5受体
中枢神经系统内几种M受体亚型中,M5受体表达水平虽然最低,但M5受体的mRNA在多巴胺神经元中得到表达(Weiner et al.,1990),即M5受体激动后能直接对多巴胺神经元起作用,因此得到了研究者的重视。Garzon等(2013)的研究中检验了VTA树突区域M5受体及多巴胺转运体(Dopamine transporter,DAT)所在的区域:M5受体主要位于多巴胺神经元的突触区域(66.8%),与另外神经元的轴突联系,少量位于轴突(25.6%)及胞体(3.7%)上,而DAT同样主要在突触区域表达(85.6%),但M5受体及DAT表达相重叠的区域却并不大(33.2%),提示了中脑区域多巴胺神经元上的M5受体激活后并非是通过影响DAT起作用,而主要通过神经递质传导的方式通路影响多巴胺系统。纹状体背侧接受的多巴胺投射神经元中也表达M5受体,同时M5受体还在纹状体中MSNs及部分中间神经元中少量表达(Yan&Surmeier,1996),但在CIN中并未表达M5受体,因此M5受体并不属于自受体。纹状体不同区域中M5受体对多巴胺系统起作用的方式并不一样,M5受体对多巴胺调控作用主要发生在纹状体背侧区域的尾状核及豆状核中(Raffa,2009;Threlfell et al.,2010)。纹状体M5受体对多巴胺系统的影响方式还存在一定的争议,最近几年有离体研究中表明M5受体激动后促进了多巴胺神经元的激动(Shin et al.,2015),或是对多巴胺神经元起抑制作用(Foster et al.,2014)。
向VTA定位注射吗啡也能引起纹状体多巴胺水平上升,但在剔除M5受体的小鼠身上这种效果则被显著抑制(Steidl,Miller,Blaha,&Yeomans,2011)。Foster等(2014)的研究中,在小鼠SNpc脑切片上,首先检验了新的工具药物VU0238429对不同亚型M受体的影响:VU0238429显著增强了乙酰胆碱与M5受体的亲和作用,同时对其它亚型的M受体无效果,即能特异性激动M5受体功能;而在SNpc的切片上,VU0238429显著增强了多巴胺神经元的放电水平。但在纹状体切片上采用M5受体激动剂VU0238429与氧化震颤素联合给药,反而增强了氧化震颤素对多巴胺神经元活动的抑制作用。而Shin等(2015)的研究中采用小鼠纹状体切片进行了离体研究:在非特异性M受体激动剂氧化震颤素的作用下,结合光遗传学技术刺激纹状体中多巴胺神经元,促进了纹状体多巴胺释放的基线水平,而在剔除了M5受体基因的小鼠身上,这种促进效果消失了;并且这种促进效果还能被β2型N受体抑制剂完全反转,提示了激动纹状体中M5受体对多巴胺释放的起促进作用还需要N受体的协同激活。另外也有一部分研究表明激动纹状体M5受体需要N受体的协同作用才能促进多巴胺的释放(Cachope et al.,2012;Kuroiwa et al.,2012)。这两个研究结果的差异可能在于干预M5受体的手段不一样。
6 总结及展望
理解胆碱系统M受体在药物成瘾中起作用的方式,具有重要的理论意义及实践意义。一、虽然有研究证实了干预M受体能显著影响药物成瘾行为,但还存在许多矛盾很难解释。因为成瘾行为受多种因素影响,而M受体同样参与了多种认知活动功能,干预M受体功能可能通过多种方式在药物成瘾中起作用,如从记忆角度、自身状态、或是产生额外的行为上的干扰因素:如我们实验室的研究中发现腹腔注射东莨菪碱也能显著增加活动量,或向特定脑区注射拟胆碱药物卡巴胆碱也能产生CPP或SA行为(Ikemoto&Wise,2002),同时外周M受体也中介了可卡因诱导的状态,因此采用单一动物模型的研究很难全面的解释M受体影响药物成瘾的方式。二、从神经机制的角度来看,多巴胺系统是与药物成瘾密切相关的神经系统,药物刺激均能引起中脑-纹状体多巴胺系统激活,多巴胺系统激活与行为强化密切相关,而M受体在多个脑区影响了多巴胺系统。在不同亚型M受体对药物成瘾影响的神经机制上,M2及M4受体激活后抑制了多巴胺的释放,而M5受体激活后则能促进多巴胺的释放,与行为学的研究结论相对应,提示了中枢多巴胺系统的变化能在一定程度上反映药物成瘾行为的变化,及M受体对药物成瘾行为的影响可能是通过影响多巴胺系统来起作用;三、新的生物学研究技术的出现,加速了对不同受体亚型M受体在药物成瘾中起作用的神经机制的理解。光遗传学手段是这个世纪初出现的,并普及较快的生物学研究技术。与传统的电刺激手段相比,光遗传学能对特定类型的神经元起刺激作用,例如对纹状体区域采用电刺激手段研究,必定同时刺激到多巴胺神经元及CIN,难以区分单独刺激两种神经元的效果;而采用光遗传学技术,则能分别对多巴胺神经元或CIN进行刺激,结合碳电极对多巴胺的释放的即时检测技术,能准确地测量不同刺激条件下对多巴胺释放的影响;最近几年出现了较多的电刺激及光遗传学刺激手段对比的研究(Cachope et al.,2012;Melchior et al.,2015;Shin et al.,2015),所得结果大大促进了对纹状体胆碱能系统及多巴胺系统交互作用方式的理解,有助于推动M受体作为药物成瘾治疗的神经靶点。
虽然目前针对M受体对药物成瘾的影响的行为学及神经机制的研究均取得了较大的进展,在今后的研究方向中,还存在着可以进步的空间:一、行为学研究中,一些胆碱类药物本身就能引起动物行为的改变,这点可能在动物模型中产生混淆变量,但之前却少有研究者关注。因此在干预M受体功能进行动物模型研究时,需要单独考察干预M受体对动物行为的影响,如果显著影响了动物行为,就更需要注意研究结果的解释。二、中枢神经M受体在药物成瘾中起作用的脑区不局限在中脑区域及纹状体区域,已有证据表明海马及脑岛区域的胆碱能系统同样中介了药物成瘾记忆的形成及表达过程(Rezayof et al.,2006;Wu et al.,2014),但这种起作用的方式并不是通过多巴胺系统起作用的,还值得深入考察;三、大多数行为学研究关注的是药物成瘾的发展阶段及表达阶段,而在戒断阶段纹状体神经系统同样发生了神经可塑性的变化(Song et al.,2014),并且在药物戒断期间进行干预能模拟真实情境下对强制戒断的患者进行治疗的过程,却鲜有研究者关注,这可能作为之后的一个研究方向。
李新旺,于萍.(2008).中枢胆碱能系统对吗啡成瘾的影响研究现状.心理科学进展,16(3),418-423.
秦幸娜,李新旺,田琳,孙金玲.(2015).多巴胺对动物冲动性的影响.心理科学进展,23(2),241-251.
于萍,渠春环,石密,李新旺,郭春彦.(2009).东莨菪碱对大鼠空间参考记忆和工作记忆的不同影响.心理学报,41(4),337-345.
张静,李新旺,马兰花.(2010).石杉碱甲对应激诱导的吗啡行为敏感化表达的影响.心理学报,42(3),387-394.
Baghdoyan,H.A.,Lydic,R.,&Fleegal,M.A.(1998).M2muscarinic autoreceptors modulate acetylcholine release in the medial pontine reticular formation.The Journal of Pharmacology and ExperimentalTherapeutics,286(3),1446-1452.
Basile,A.S.,Fedorova,I.,Zapata,A.,Liu,X.G.,Shippenberg,T.,Duttaroy,A.,...Wess,J.(2002).Deletion of the M5muscarinic acetylcholine receptor attenuates morphine reinforcement and withdrawal but not morphine analgesia.Proceedings of the National Academy of Sciences of the United States of America,99(17),11452-11457.
Beaulieu,J.M.,&Gainetdinov,R.R.(2011).The physiology,signaling,and pharmacology of dopamine receptors.Pharmacological Reviews,63(1),182-217.
Berlanga,M.L.,Olsen,C.M.,Chen,V.,Ikegami,A.,Herring,B.E.,Duvauchelle,C.L.,&Alcantara,A.A.(2003).Cholinergic interneurons of the nucleus accumbens and dorsal striatum are activated by the self-administration of cocaine.Neuroscience,120(4),1149-1156.
Brady,A.E.,Jones,C.K.,Bridges,T.M.,Kennedy,J.P.,Thompson,A.D.,Heiman,J.U.,...Lindsley,C.W.(2008).Centrally active allosteric potentiators of the M4muscarinic acetylcholine receptor reverse amphetamine-induced hyperlocomotor activity in rats.The Journal of Pharmacology and ExperimentalTherapeutics,327(3),941-953.
Cachope,R.,Mateo,Y.,Mathur,B.N.,Irving,J.,Wang,H.L.,Morales,M.,...Cheer,J.F.(2012).Selective activation of cholinergic interneurons enhances accumbal phasic dopamine release:Setting the tone for reward processing.Cell Reports,2(1),33-41.
Dackis,C.,&O'Brien,C.(2005).Neurobiology of addiction:Treatment and public policy ramifications.Nature Neuroscience,8(11),1431-1436.
de Belleroche,J.S.,&Gardiner,I.M.(1982).Cholinergic action in the nucleus accumbens:Modulation of dopamine and acetylcholine release.British Journal of Pharmacology,75(2),359-365.
Dencker,D.,Weikop,P.,Sørensen,G.,Woldbye,D.P.D.,Wörtwein,G.,Wess,J.,&Fink-Jensen,A.(2012).An allosteric enhancer of M4muscarinic acetylcholine receptor function inhibits behavioral and neurochemical effects of cocaine.Psychopharmacology,224(2),277-287.
Exley,R.,&Cragg,S.J.(2008).Presynaptic nicotinic receptors:A dynamic and diverse cholinergic filter ofstriatal dopamine neurotransmission.British Journal of Pharmacology,153(Suppl 1),S283-S297.
Ferguson,S.M.,Eskenazi,D.,Ishikawa,M.,Wanat,M.J.,Phillips,P.E.M.,Dong,Y.,...Neumaier,J.F.(2011).Transient neuronal inhibition reveals opposing roles of indirectand directpathways in sensitization.Nature Neuroscience,14(1),22-24.
Fields,H.L.,Hjelmstad,G.O.,Margolis,E.B.,&Nicola,S.M.(2007).Ventral tegmental area neuronsin learned appetitive behavior and positive reinforcement.Annual Review of Neuroscience,30,289-316.
Fink-Jensen,A.,Fedorova,I.,Wörtwein,G.,Woldbye,D.P.D.,Rasmussen,T.,Thomsen,M.,...Basile,A.(2003).Role forM5muscarinic acetylcholine receptors in cocaine addiction.The Journal of Neuroscience Research,74(1),91-96.
Foster,D.J.,Gentry,P.R.,Lizardi-Ortiz,J.E.,Bridges,T.M.,Wood,M.R.,Niswender,C.M.,...Conn,P.J.(2014).M5receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location.The Journal of Neuroscience,34(9),3253-3262.
Gamberini,M.T.,Bolognesi,M.L.,&Nasello,A.G.(2012).The modulatory role ofM2muscarinic receptoron apomorphine-induced yawning and genitalgrooming.Neuroscience Letter,531(2),91-95.
Garzón,M.,&Pickel,V.M.(2006).Subcellular distribution of M2muscarinic receptors in relation to dopaminergic neuronsof the rat ventral tegmental area.Journal of Comparative Neurology,498(6),821-839.
Gerber,D.J.,Sotnikova,T.D.,Gainetdinov,R.R.,Huang,S.Y.,Caron,M.G.,&Tonegawa,S.(2001).Hyperactivity,elevated dopaminergic transmission,and response to amphetamine in M1muscarinic acetylcholine receptordeficient mice.Proceedings of the National Academy of Sciences of the United States of America,98(26),15312-15317.
Hikida,T.,Kitabatake,Y.,Pastan,I.,&Nakanishi,S.(2003).Acetylcholine enhancementin the nucleusaccumbens prevents addictive behaviors of cocaine and morphine.Proceedings of the National Academy of Sciences of the United States of America,100(10),6169-6173.
Ikemoto,S.,&Wise,R.A.(2002).Rewarding effects of the cholinergic agents carbacholand neostigmine in the posterior ventral tegmental area.The Journal of Neuroscience,22(22),9895-9904.
Ince,E.,Ciliax,B.J.,&Levey,A.I.(1997).Differential expression of D1and D2dopamine and m4 muscarinic acetylcholine receptor proteins in identified striatonigral neurons.Synapse,27(4),357-366.
Itzhak,Y.,&Martin,J.L.(2000).Scopolamine inhibits cocaine-conditioned but not unconditioned stimulant effects in mice.Psychopharmacology,152(2),216-223.
Jeon,J.,Dencker,D.,Wortwein,G.,Woldbye,D.P.,Cui,Y.,Davis,A.A.,...Wess,J.(2010).A subpopulation of neuronal M4muscarinic acetylcholine receptors plays a critical role in modulating dopamine-dependent behaviors.Journal of Neuroscience,30(6),2396-2405.
Kalivas,P.W.,&O'Brien,C.(2008).Drug addiction as a pathology of staged neuroplasticity.Neuropsychopharmacology,33(1),166-180.
Kamii,H.,Kurosawa,R.,Taoka,N.,Shinohara,F.,Minami,M.,&Kaneda,K.(2015).Intrinsic membrane plasticity via increased persistent sodium conductance of cholinergic neurons in the rat laterodorsal tegmental nucleus contributes to cocaine-induced addictive behavior.European Journal of Neuroscience,41(9),1126-1138.
Kohlmeier,K.A.,Ishibashi,M.,Wess,J.,Bickford,M.E.,&Leonard,C.S.(2012).Knockoutsrevealoverlapping functions of M2and M4muscarinic receptors and evidence for a local glutamatergic circuit within the laterodorsal tegmental nucleus.Journal of Neurophysiology,108(10),2751-2766.
Kudernatsch,M.,&Sutor,B.(1994).Cholinergic modulation of dopamine overflow in the rat neostriatum:A fast cyclic voltammetric study in vitro.Neuroscience Letter,181(1-2),107-112.
Kuroiwa,M.,Hamada,M.,Hieda,E.,Shuto,T.,Sotogaku,N.,Flajolet,M.,...Nishi,A.(2012).Muscarinic receptors acting at pre-and post-synaptic sites differentially regulate dopamine/DARPP-32 signaling in striatonigral and striatopallidal neurons.Neuropharmacology, 63(7),1248-1257.
Lehmann,J.,&Langer,S.Z.(1982).Muscarinic receptors on dopamine terminals in the cat caudate nucleus:Neuromodulation of [3H]dopamine release in vitro by endogenous acetylcholine.Brain Research,248(1),61-69.
Lester,D.B.,Miller,A.D.,& Blaha,C.D.(2010).Muscarinic receptor blockade in the ventral tegmental area attenuates cocaine enhancement of laterodorsal tegmentum stimulation-evoked accumbensdopamine efflux in the mouse.Synapse,64(3),216-223.
Levey,A.I.,Kitt,C.A.,Simonds,W.F.,Price,D.L.,&Brann,M.R.(1991).Identification and localization of muscarinic acetylcholine receptor proteins in brain with subtype-specific antibodies.The Journal of Neuroscience,11(10),3218-3226.
Li,X.W.,Li,J.X.,Zhu,X.L.,Cui,R.S.,&Jiao,J.J.(2010).Effects ofphysostigmine on the conditioned hyperactivity and locomotor sensitization to morphine in rats.Behavioural Brain Research,206(2),223-228.
Liu,H.F.,Lai,M.J.,Zhou,X.,Zhu,H.Q.,Liu,Y.,Sun,A.A.,...Zhou,W.H.(2012).Galantamine attenuates the heroin seeking behaviors induced by cues after prolonged withdrawal in rats.Neuropharmacology,62(8),2515-2521.
Mao,L.M.,&Wang,J.Q.(2015).Dopaminergic and cholinergic regulation of Fyn tyrosine kinase phosphorylation in the rat striatum in vivo.Neuropharmacology,99,491-499.
Mark,G.P.,Kinney,A.E.,Grubb,M.C.,Zhu,X.M.,Finn,D.A.,Mader,S.L.,...Bechtholt,A.J.(2006).Injection of oxotremorine in nucleus accumbens shell reduces cocaine but not food self-administration in rats.Brain Research,1123(1),51-59.
Melchior,J.R.,Ferris,M.J.,Stuber,G.D.,Riddle,D.R.,&Jones,S.R.(2015).Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release.Journalof Neurochemistry,134(5),833-844.
Miller,A.D.,&Blaha,C.D.(2004).Nigrostriatal dopamine release modulated by mesopontine muscarinic receptors.Neuroreport,15(11),1805-1808.
Raffa,R.B.(2009).The M5muscarinic receptor as possible target for treatment of drug abuse.Journal of Clinical Pharmacy and Therapeutics,34(6),623-629.
Ramos,A.C.,Andersen,M.L.,Oliveira,M.G.M.,Soeiro,A.C.,& Galduróz,J.C.F.(2012).Biperiden (M1antagonist)impairs the expression of cocaine conditioned place preference but potentiates the expression of cocaineinduced behavioral sensitization.Behavioural Brain Research,231(1),213-216.
Ranaldi,R.(2014).Dopamine and reward seeking:The role of ventral tegmental area.Reviews in the Neurosciences,25(5),621-630.
Rezayof,A.,Zatali,H.,Haeri-Rohani,A.,&Zarrindast,M.R.(2006).Dorsal hippocampal muscarinic and nicotinic receptorsare involved in mediating morphine reward.Behavioural Brain Research,166(2),281-290.
Schmidt,L.S.,Thomsen,M.,Weikop,P.,Dencker,D.,Wess,J.,Woldbye,D.P.D.,...Fink-Jensen,A.(2011).Increased cocaine self-administration in M4muscarinic acetylcholine receptorknockoutmice.Psychopharmacology,216(3),367-378.
Shabani,S.,Foster,R.,Gubner,N.,Phillips,T.J.,&Mark,G.P.(2010).Muscarinic type 2 receptors in the lateral dorsal tegmental area modulate cocaine and food seeking behavior in rats.Neuroscience,170(2),559-569.
Shen,W.X.,Plotkin,J.L.,Francardo,V.,Ko,W.K.D.,Xie,Z.,Li,Q.,...Surmeier,D.J.(2015).M4muscarinic receptor signaling ameliorates striatal plasticity deficits in models of L-DOPA-Induced dyskinesia.Neuron,88(4),762-773.
Shin,J.H.,Adrover,M.F.,Wess,J.,&Alvarez,V.A.(2015).Muscarinic regulation of dopamine and glutamate transmission in the nucleus accumbens.Proceedings of the National Academy of Sciences of the United States of America,112(26),8124-8129.
Shinohara,F.,Kihara,Y.,Ide,S.,Minami,M.,&Kaneda,K.(2014).Critical role of cholinergic transmission from the laterodorsal tegmental nucleus to the ventral tegmental area in cocaine-induced place preference.Neuropharmacology,79,573-579.
Song,S.S.,Kang,B.J.,Wen,L.,Lee,H.J.,Sim,H.R.,Kim,T.H.,...Baik,J.H.(2014).Optogenetics reveals a role for accumbal medium spiny neurons expressing dopamine D2receptors in cocaine-induced behavioral sensitization.Frontiers in Behavioral Neuroscience,8,336.
Stachniak,T.J.,Ghosh,A.,& Sternson,S.M.(2014).Chemogenetic synaptic silencing of neural circuits localizes a hypothalamus→midbrain pathway for feeding behavior.Neuron,82(4),797-808.
Steidl,S.,Miller,A.D.,Blaha,C.D.,&Yeomans,J.S.(2011).M5muscarinic receptors mediate striatal dopamine activation by ventral tegmental morphine and pedunculopontine stimulation in mice.PLoS One,6(11),e27538.
Tanda,G.,&Katz,J.L.(2007).Muscarinic preferential M1receptor antagonists enhance the discriminative-stimulus effects of cocaine in rats.Pharmacology,Biochemistry and Behavior,87(4),400-404.
Thomsen,M.,Conn,P.J.,Lindsley,C.,Wess,J.,Boon,J.Y.,Fulton,B.S.,...Caine,S.B.(2010).Attenuation of cocaine's reinforcing and discriminative stimulus effects via muscarinic M1acetylcholine receptorstimulation.Journal of Pharmacology and Experimental Therapeutics,332(3),959-969.
Thomsen,M.,Fulton,B.S.,&Caine,S.B.(2014).Acute and chronic effects of the M1/M4-preferring muscarinic agonist xanomeline on cocaine vs.food choice in rats.Psychopharmacology,231(3),469-479.
Threlfell,S.,Clements,M.A.,Khodai,T.,Pienaar,I.S.,Exley,R.,Wess,J.,& Cragg,S.J.(2010).Striatal muscarinic receptors promote activity dependence of dopamine transmission via distinct receptor subtypes on cholinergic interneurons in ventral versus dorsal striatum.The Journal of Neuroscience,30(9),3398-3408.
Tzavara,E.T.,Bymaster,F.P.,Davis,R.J.,Wade,M.R.,Perry,K.W.,Wess,J.,...Nomikos,G.G.(2004).M4muscarinic receptors regulate the dynamics of cholinergic and dopaminergic neurotransmission:Relevance to the pathophysiology and treatment of related CNS pathologies.The FASEB Journal,18(12),1410-1412.
Tzschentke,T.M.(2001).Pharmacology and behavioral pharmacology ofthe mesocorticaldopamine system.Progress in Neurobiology,63(3),241-320.
Weiner,D.M.,Levey,A.I.,& Brann,M.R.(1990).Expression ofmuscarinic acetylcholine and dopamine receptor mRNAs in rat basal ganglia.Proceedings of the National Academy of Sciences of the United States of America,87(18),7050-7054.
Wu,W.,Li,H.,Liu,Y.,Huang,X.J.,Chen,L.,&Zhai,H.F.(2014).Involvementofinsularmuscarinic cholinergic receptors in morphine-induced conditioned place preference in rats.Psychopharmacology,231(21),4109-4118.
Yager,L.M.,Garcia,A.F.,Wunsch,A.M.,&Ferguson,S.M.(2015).The ins and outs of the striatum:Role in drug addiction.Neuroscience,301,529-541.
Yan,Z.,& Surmeier,D.J.(1996).Muscarinic(M2/M4)receptors reduce N-and P-type Ca2+currents in rat neostriatal cholinergic interneurons through a fast,membrane-delimited,G-protein pathway.The Journal of Neuroscience,16(8),2592-2604.
Yee,J.,Famous,K.R.,Hopkins,T.J.,McMullen,M.C.,Pierce,R.C.,& Schmidt,H.D.(2011).Muscarinic acetylcholine receptors in the nucleus accumbens core and shell contribute to cocaine priming-induced reinstatement of drug seeking.European Journal ofPharmacology,650(2-3),596-604.
Zhou,W.,Liu,H.,Zhang,F.,Tang,S.,Zhu,H.,Lai,M.,&Kalivas,P.W.(2007).Role of acetylcholine transmission in nucleusaccumbens and ventraltegmentalarea in heroin-seeking induced by conditioned cues.Neuroscience,144(4),1209-1218.

