过瘤胃胆碱的性能评定
■李 高 张永根 丁 雪 王晓帆 张立阳 薛世崇
(东北农业大学动物科学技术学院,黑龙江哈尔滨 150030)
近年来,随着饲料工业和乳业生产水平的不断发展,集约化养殖条件下的奶牛生产性能得到极大的改善[1]。但随着奶牛产奶潜力的开发,也出现了一些问题。就目前最常见的脂肪肝疾病而言,调查发现有高达50%的高产奶牛在围产期间都会受此病影响,导致健康、生产和繁殖能力下降,其对奶牛养殖带来了极大的损失[2]。研究发现,胆碱能够有效的减少脂肪在肝脏的沉积,然而因为反刍动物自身的特点,添加在日粮中的胆碱几乎都被瘤胃微生物所降解[3],而且胆碱的碱性以及带有鱼腥异味限制了其大量添加。研究者通过试验选取18只泌乳中期奶牛,当胆碱饲喂量由18 g/d增加至282 g/d时,饲料采食量由18.4 kg/d减少至16.7 kg/d,表明高水平胆碱可降低饲料采食量[4]。为了不影响奶牛的采食量以及预防胆碱在瘤胃中的降解以及改善异味,需要对胆碱进行过瘤胃保护研究,以期达到过瘤胃的目的。
研究证实,肝脏甘油三酯(TAG)沉积会降低肝脏尿素生成速率,影响糖异生、激素清除和响应能力。而研究发现胆碱是形成极低密度脂蛋白(VLDL)的重要物质,在饲料中添加胆碱能够增加体内VLDL的数量,提高对甘油三酯的转运能力,减少非酯化脂肪酸(NEFA)在肝脏的沉积,达到预防脂肪肝的目的[5]。通过饲料与奶牛自身合成的胆碱已经不能满足高产奶牛的营养需要,因此有必要额外的添加胆碱,补充胆碱在奶牛体内的缺乏[6]。目前市面上有很多过瘤胃胆碱产品,但其质量良莠不齐,而且价格昂贵,鉴于这种情况,在国内有必要开展过瘤胃技术研究,形成拥有自主知识产权的,质量优良,价格相对较低的过瘤胃保护胆碱产品,应用于国内牛场,促进奶业的进一步发展。在过瘤胃胆碱的质量评定方面还没有统一的标准。对市面上不同的过瘤胃胆碱产品没有权威的评估,导致养殖户的选择困难。本研究旨在对新研发过瘤胃胆碱产品进行质量评定,且评价日粮添加瘤胃保护胆碱(RPC)预防或减轻奶牛脂肪肝的作用。
1 材料与方法
1.1 试验动物
东北农业大学实验基地提供的安装有瘤胃瘘管的奶牛。按奶牛营养需要配制饲粮。试验奶牛每日分别于07:00和17:00等量饲喂,基础饲粮组成及营养水平见表1。
1.2 试验材料
C1:威尔潞威公司新研发胆碱产品。
1.3 过瘤胃胆碱在瘤胃内保护率测定
1.3.1 半体内法测定过瘤胃胆碱在瘤胃保护率
本试验采用尼龙袋法,尼龙袋采用8 cm×12 cm规格,试验按照降解时间分为9个处理,分别为0、2、4、8、12、16、24、36、48 h,以未经瘤胃处理的为对照组0 h,每个处理3个重复,每个重复每个时间点3个平行样品袋,每袋样品为5 g。装好样品后的尼龙袋在40℃烘箱中烘干48 h至恒重,称重备用。试验时将尼龙袋同时放入牛瘤胃腹囊部,分别在瘤胃中消化2、4、8、12、16、24、36、48 h后分别取出相应的尼龙袋,在清水中缓缓冲洗5~10 min,直到水流清净为止,然后在40℃烘箱中烘干48 h至恒重,称重,计算过瘤胃胆碱样品在瘤胃中的保护率。

表1 试验饲粮组成及营养水平(风干基础)
1.3.2 体外法测定过瘤胃胆碱在瘤胃保护率
基础缓冲溶液,A液:CaCl2·2H2O 16.12 g,MnCl2·4H2O 10.0 g,CoCl2·6H2O 1.0 g,FeCl3·6H2O 0.8 g溶解,并定容至1 000 ml。B液:Na2HPO4(无水)5.7 g,KH3PO4(无水)6.2 g,MgSO4·7H2O 0.6 g溶解,并定容至1 000 ml。C液:NH4HCO34.0 g,NaHCO335.0 g溶解,并定容至1 000 ml。D液:100 mg刃天青加入100 ml蒸馏水充分溶解。E液:1 mol/l NaOH 4.0 ml,Na2S·9H2O 672 mg,蒸馏水95 ml,充分溶解。
2 L缓冲液的配制方法:800 ml蒸馏水+0.2 ml A液+480 ml B液+480 ml C液+2 ml D液,此时混合液为红色,通入CO2并预热到39℃,混合液变成无色,再加入80 ml还原液,继续通入CO2至无色。
瘤胃液:早晨饲喂前通过瘤胃瘘管取瘤胃液,经四层纱布过滤。
试验按照降解时间分为9个处理,分别为0、2、4、8、12、16、24、36、48 h,以未经瘤胃处理的为对照组0 h,每个处理3个重复,每个重复每个时间点3个平行样品袋,称取胆碱样品2 g左右,分别放入24个生理盐水瓶(250 ml),向每个瓶子分装60 ml缓冲液和30 ml瘤胃液,摇动混合,向溶液充CO2,使溶液和试管内空间全部充满CO2,然后盖上带有放气阀门的橡皮塞,将其置于水浴摇床培养(39℃),设置好摇床频率,分别于各个时间点各取出3个瓶子,去上清液,剩余物在清水中缓缓冲洗5~10 min,至水澄清,测剩余物中胆碱含量,从而测定过瘤胃胆碱样品在瘤胃中的保护率。
1.4 过瘤胃胆碱在小肠中的降解率测定
1.4.1 体外法测定过瘤胃胆碱在小肠中的降解率
缓冲液:NaH2PO49.30 g、NaHCO39.80 g、NaCl 0.47 g、KCl 0.57 g、CaCl2·H2O 0.08 g、MgSO4·7H2O 0.12 g,将以上成分加入1 000 ml蒸馏水充分溶解即成。
酸性胃蛋白酶:准确称取胃蛋白酶(1∶10 000)1.0 g,溶解于1 000 ml的0.1 mol/l盐酸中。
胰酶液:称取6.8 g KH2PO4,溶解于750 ml蒸馏水中,用NaOH溶液调pH值至7~8,用蒸馏水定容于1 L容量瓶中得0.5 mol/l KH2PO4,取3 g胰蛋白酶与50 mg百里香酚溶解于1 L以上溶液,充分溶解1 h。
1.0 mol/l NaOH溶液。
饲料残渣制备:取适量饲料原样大约10 g于瘤胃尼龙袋内,每4个袋子固定于一根绳上,在早晨投入奶牛瘤胃中,16 h后取出,冲洗至清澈后,于40℃烘48 h至恒重。
测定方法为体外离体酶法(两步法):①加入60 ml酸性胃蛋白酶溶液到24个装有2 g过瘤胃胆碱样品的培养瓶中,将其置于水浴摇床培养(39℃),培养1 h;②每个瓶子加入1.5 ml 1mol/l氢氧化钠,并加入80 ml胰酶液培养,分别在2、4、8、12、16、24、36、48 h取出三个瓶子,在清水中缓缓冲洗5~10 min,直到水流清净为止,然后在40℃烘箱中烘干48 h至恒重,称重,测定过瘤胃胆碱样品在小肠中的降解率。
1.4.2 移动尼龙袋法测定过瘤胃胆碱在小肠中的降解率
选择孔径10~40μm的尼龙布,制成3 cm×6 cm的移动尼龙袋。称取1.4.1中制备的饲料残渣2~3 g,装入做好的尼龙袋中,热封仪封口。每头牛准备6个尼龙袋。将移动尼龙袋浸泡于含0.004 mol/l的HCl溶液中,25℃培养1 h,然后在0.01%胃蛋白酶的盐酸溶液中40℃振荡培养2 h。处理后的移动尼龙袋经十二指肠瘘管每30 min投放1次,每次投袋2个。自投袋后12 h开始,每隔2 h定时检查一次,及时从粪便中回收移动尼龙袋。清理尼龙袋上的粪便,细流冲洗,直至尼龙袋中流出的水清澈无味为止,然后在40℃烘箱中烘干48 h至恒重,称重,计算过瘤胃胆碱样品在小肠中的降解率。
1.5 血液生化指标测定
选取6头干奶期奶牛,按体重(BW)、体况评分(BCS)配对,并随机分成对照组和试验组每组各3头。试验分预饲期和试验期两个阶段,预饲期为6 d,试验期为14 d。试验预饲期间,所有奶牛饲喂1.4 kg/d精料并自由采食饲草,在预饲第6 d采食后4~5 h,进行尾部静脉采血10 ml,加入抗凝剂,冷藏保存,进行血液指标分析。从第7 d开始进行诱导脂肪肝期,奶牛饲喂1.4 kg/d精料,限制饲草采食量,同时试验组添加20 g/(d·头)过瘤胃胆碱产品C1,对照组不添加,此时奶牛采食的能量大约为维持所需总能量的30%。从试验期第11 d开始每天在奶牛采食后4~5 h进行尾静脉采血[7],每次采血10 ml,进行血液指标分析。预饲期第6 d结果作为校正处理。采集血液的管中加入肝素钠抗凝。采样后立即离心15 min,离心速度3 500 r/min,取全部上清液分成2份,收集血浆,-20 ℃保存[8]。
①血浆葡萄糖浓度的测定:用葡萄糖氧化酶/过氧化酶法,通过葡萄糖氧化酶(GOD)氧化,产生葡萄糖酸和过氧化氢。过氧化氢又通过氧化物酶(POD)作用,分解出氧,能够与无色的4-氨基安替比林和酚偶联氧化,合成红色的醌亚胺[9]。醌亚胺在500 nm处有最大吸收峰,其吸光度与浓度成正比,可以通过测定标准管的吸光度计算样品中葡萄糖的浓度[10]。
②非酯化脂肪酸(NEFA)含量测定:用试剂盒比色法,非酯化脂肪酸(NEFA)能与铜离子结合形成能溶于氯仿的脂肪酸铜盐中,其量与非酯化脂肪酸含量成正比。通过测定铜离子的量来计算非酯化脂肪酸的含量[11]。
③ β-羟基丁酸(β-HBA)含量测定:β-羟基丁酸的浓度与pH值8.5时烟酰胺腺嘌呤二核苷酸(NADH)在340 nm波长下的吸光度上升速率成正比,因此可以通过测定NADH在340 nm波长下的吸光度上升速率来计算β-羟基丁酸的含量[12]。
1.6 数据统计分析
数据用Excel2010进行初步整理,然后采用SPSS 13.0软件对数据进行方差分析过程(ANOVA)进行分析,均值的多重比较采用Duncan's法进行多重比较,结果以“平均值±标准误”表示。
1.7 结果计算
装袋样品逃逸率(%)=降解重(g)/料重(g)×100;
降解重(g)=袋重(g)+料重(g)-降解后重(g);
干重损失(%)=[样品校正处理前重量(g)-样品处理后重量(g)]/样品校正处理前重量(g)×100;
瘤胃保护率(%)=样品过瘤胃后重量(g)/样品校正过瘤胃前重量(g)×100;
小肠降解率(%)=[1-样品小肠降解后重量(g)/样品校正小肠降解前重量(g)]×100。
2 结果与分析
2.1 过瘤胃胆碱(C1)的性能评定
2.1.1 过瘤胃胆碱在瘤胃中的保护率测定(见表2)

表2 体外法与半体内法测过瘤胃胆碱瘤胃保护率(%)
由表2可以看出,用体外法与半体内法所测结果虽然在数值上有较大差异但是在趋势上一致,都是随着培养时间的增大,在瘤胃的保护率有逐渐减小的趋势。通过多重比较发现在2、8、24、36、48 h时间点两种方法所测结果差异显著(P<0.05),而在4、12、16 h时候所测结果表现差异不显著(P>0.05)。在培养48 h时候体外法测得保护率在80%以上,用半体内(尼龙袋)法测得结果在70%以上,虽然结果有差异但能够说明新研发的C1产品在瘤胃内基本能够得到有效的保护。
2.1.2 过瘤胃胆碱在小肠中的降解率测定(见表3、表4)
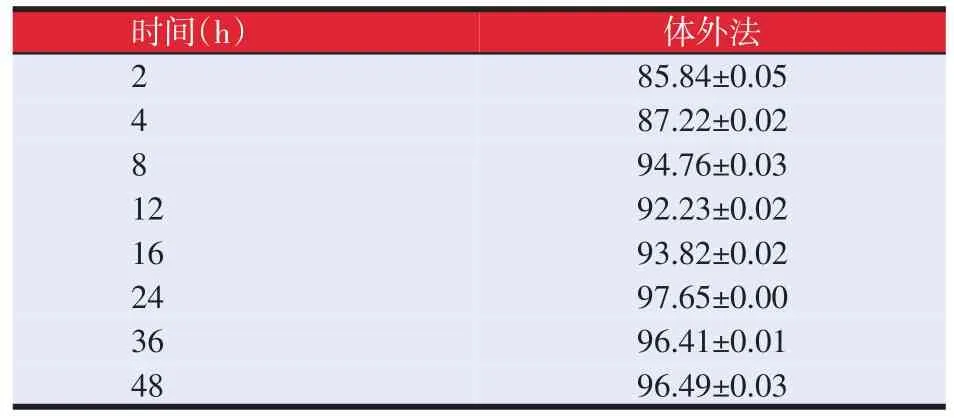
表3 体外法测过瘤胃胆碱小肠降解率(%)

表4 半体内移动尼龙袋法测过瘤胃胆碱小肠降解率(%)
半体内移动尼龙袋法以3头奶牛分为A、B、C3组做为平行组,每个平行6个重复,所得A、B、C3组值分别为各组6个重复的平均值。从表3和表4可以看出,用移动尼龙袋法得出的3组结果与体外小肠法测得的4 h时候降解率相似,在4 h时候体外法测定小肠降解率为87.22%,移动尼龙袋测得各组降解率平均值为88.04%,两种方法测得结果看出在4 h时候产品C1的小肠释放率在85%以上,通过上面两种方法所测的结果可以看出,此过瘤胃胆碱产品在小肠环境中能够迅速的释放。由此可以说明C1产品在小肠内没有发生过保护现象。

表5 试验第11~14 d血液中三种指标测定
2.2 过瘤胃胆碱对奶牛血液指标的影响
试验中当P≤0.05时具有统计学意义,P≤0.15时具有统计学趋势。从表5可以看出,奶牛采食过瘤胃胆碱(RPC)后血液NEFA浓度显著下降(P<0.05),RPC对血浆β-HBA浓度没有影响(P>0.05),饲喂RPC对血糖浓度有增加的趋势(P<0.15)。
3 讨论
3.1 新研发C1产品性能评定
试验采用体外法与半体内法相结合检测新研发胆碱是否能够满足对过瘤胃产品基本性能的要求,试验测定了新研发C1产品在瘤胃内的保护率及小肠的降解率,这两个指标也是最便捷的反映过瘤胃产品性能的指标。据报道,通过这两个指标测定了某过瘤胃胆碱产品的瘤胃保护率以及小肠降解率,试验结果表明这种过瘤胃胆碱产品的瘤胃保护率达到85%以上,小肠降解率达到95%以上。此研发的过瘤胃胆碱产品的瘤胃保护率与小肠降解率较以上产品还有差距,有待进一步改进,但通过研究发现此研发的过瘤胃胆碱产品的瘤胃保护率能够达到70%以上,小肠降解率在85%以上,也能够达到过瘤胃产品的基本要求,即在奶牛生理消化期间产品在瘤胃内基本稳定不被降解,大部分能够通过瘤胃。在小肠内也能够在短时间迅速释放。
有研究表明[13],采用移动尼龙袋法测定饲料在小肠的降解情况,首先需要将饲料样品在瘤胃内预培养16 h,因为普遍认为16 h这个时间能反映到达小肠前瘤胃代谢的状况。因此本试验也采用16 h的瘤胃非降解饲料残渣作为小肠消化率的测定。试验采用体外法与移动尼龙袋法两种方法测定小肠降解率,从测得结果来看,这两种方法都能够较准确的测定胆碱的小肠降解率,但移动尼龙袋法不能显示出各个时间点的降解率。有研究指出[14],用三步法与体内法测定蛋白质的小肠消化率,两种方法数值间的相关性是很高的(R2=0.91)。所以,在测定过瘤胃胆碱的小肠消化率时使用三步法是可行的,而其所测得的结果也是可靠的。
3.2 过瘤胃胆碱对血糖含量的影响
王俊峰等(2004)[15]研究发现,血液中葡萄糖含量反映了机体对糖的消化、吸收、代谢的过程,它能够体现机体的能量代谢水平,反刍动物90%的血糖来自于肝糖异生。奶牛体内葡萄糖主要用于维持组织器官的需要以及泌乳需要,奶牛产后产奶量上升很快,因此对葡萄糖的需要量逐渐增多,奶牛在这个阶段很容易发生能量负平衡。Goselink等(2012)[16]研究发现,在日粮中添加经过过瘤胃保护的氯化胆碱可以提高奶牛的血糖含量,能够维持高产期血糖平衡。Hartwell等(2001)[17]报道饲喂过瘤胃保护氯化胆碱对血糖含量无显著影响。徐国忠等(2005)[18]通过对围产期奶牛添加RPC后发现,RPC有增加血糖和降低非酯化脂肪酸的趋势,但差异不显著(P>0.05),这些试验结果显示了过瘤胃胆碱能够稳定奶牛血糖水平,提高抵抗能量负平衡的能力。本次试验表明饲喂RPC有增加血糖浓度的趋势,由于采样期间限饲两组采食量相近,血糖浓度的改变与能量摄入无关。由此可以看出血糖浓度的改变与摄入的RPC有关。
3.3 过瘤胃胆碱对β-羟基丁酸含量的影响
过瘤胆碱对奶牛血浆β-羟基丁酸的影响,β-羟基丁酸是酮体中含量最多的成分,是判断奶牛酮病的一个重要指标。Pinotti等(2001)[14]发现,日粮中添加胆碱具有降低奶牛血浆β-羟基丁酸水平的趋势。有研究结果显示,在产后的35 d内,奶牛饲喂10 g/d的过瘤胃胆碱,血浆内β-羟基丁酸含量低于未添加过瘤胃胆碱的对照组。Hartwell等(2001)[17]研究也指出 RPC对产犊时血浆β-羟基丁酸无影响。本次试验测得RPC对血浆β-羟基丁酸浓度没有影响,表明过瘤胃胆碱产品对肝脏生酮作用没有影响。
3.4 过瘤胃胆碱对非酯化脂肪酸(NEFA)含量的影响
围产期的高产奶牛机体通常处于能量负平衡状态,脂肪动员是围产期奶牛能量负平衡的必然结果。脂肪的分解一方面能够降低糖异生所引起的能量欠缺,另一方面由于脂肪分解产生的大量非酯化脂肪酸(NEFA)进入血液及肝脏,使得血液中的NEFA浓度升高,由此可引发脂肪肝和酮病。NEFA与奶牛体内能量代谢相关,是脂肪分解的产物,所以是反映体内脂肪代谢程度的可靠指标。研究表明,过瘤胃胆碱能降低奶牛围产期能量负平衡时期的血液中NEFA含量。Hartwell等(2001)[17]报道,奶牛饲喂 6 g/d 过瘤胃胆碱可降低血清内的非酯化脂肪酸含量,每头饲喂12 g/d的过瘤胃胆碱的奶牛在分娩时能保持较低的非酯化脂肪酸浓度。有前人在围产期奶牛添加过瘤胃胆碱结果显示,奶牛肝脏内糖原比对照组增加,而非酯化脂肪酸、β-羟基丁酸无显著差异。有一些研究发现,在奶牛饲料中添加过瘤胃胆碱,奶牛血清中NEFA浓度与对照组无显著差异[19]。研究采用RPC产品代替皱胃灌注方式,结果表明RPC产品的添加对血清中NEFA浓度无影响,还有研究表明,添加RPC28 d后肥育萨福羊血液中NEFA浓度显著升高(P<0.05)。前人研究结果大多表明,产前28 d或21 d补充RPC可降低围产期奶牛血浆NEFA浓度[20]。但这些研究同时也发现饲喂RPC的奶牛干物质采食量和能量摄入量提高,这可能是NEFA下降的原因[21]。本试验限饲阶段,奶牛摄入的能量仅为妊娠和维持所需总能的30%,奶牛采食RPC后血浆NEFA浓度下降(P<0.05)。添加RPC后血浆NEFA浓度下降,表明胆碱对脂肪组织动员或血液NEFA清除具有一定作用,改善了奶牛的能量负平衡。
4 结论
①新研发过瘤胃胆碱产品C1能够达到在过瘤胃产品的基本要求。
②对能量负平衡时期奶牛补充过瘤胃胆碱产品C1可以降低能够引起脂肪肝的非酯化脂肪酸含量,但对能够引起酮病的β-羟基丁酸含量没有显著影响。对奶牛能量代谢有改善的趋势。

