饲粮添加芽孢杆菌对感染大肠杆菌K88仔猪脾脏TLRs表达的影响
■ 李海花 张全红 朱 琪 韩红杰
(1.天津市畜牧兽医研究所,天津300381;2.天津市畜禽健康养殖技术工程中心,天津300381;3.国家知识产权局专利局专利审查协作北京中心,北京100096;4.洛阳瑞莱生物工程有限公司,河南洛阳471000)
先天性免疫是机体抵抗病原感染的第一道防线。病原微生物感染机体后,宿主细胞通过模式识别分子(PRRs)识别病原相关分子模式(PAMPs),从而诱导先天性免疫。Toll-样受体(TLRs)是目前研究最为广泛和深入的一类PRRs,能够广泛识别细菌、病毒、真菌和原虫等(Akira等,2006)。不同动物中TLRs的种类和数量都不相同,猪有10种TLRs,主要分布在巨噬细胞、树突状细胞和单核细胞等免疫细胞中,也表达于一些非免疫细胞,例如成纤维细胞和上皮细胞。TLRs识别病原后,能够将免疫信号通路活化,产生免疫效应因子,最终调节机体细胞免疫和体液免疫,从而清除感染的病原体,促使机体尽快恢复到健康状态。芽孢杆菌能调节猪的免疫功能,
增强抗病能力,发挥促生长作用(于新友等,2016),但是在病原菌感染状态下,芽孢杆菌对猪TLRs表达的影响目前还不清楚。因此,本研究利用大肠杆菌感染仔猪炎症模型,研究枯草芽孢杆菌对仔猪脾脏TLRs表达的影响,为研究其免疫调节的作用机理奠定基础。
1 材料与方法
1.1 主要试剂
动物组织总RNA提取试剂盒购自天根生化科技(北京)有限公司;RNA反转录试剂盒和荧光定量PCR试剂盒购自GeneCopoeia公司。
1.2 引物
试验所用引物序列见表1,引物由上海生工生物工程股份有限公司合成。

表1 引物序列
1.3 试验动物
选择体重(6.8±0.5)kg“杜×长×大”商品杂交仔猪8头,按完全随机区组设计分为2个处理,每个处理4个重复,单栏饲养于专用代谢笼中。对照组饲喂基础饲粮,试验组饲喂基础饲粮+0.1%芽孢杆菌制剂,芽孢杆菌为新筛选出的菌株,冻干粉中活菌含量为1×1012CFU/g。
1.4 试验日粮
根据NRC(2012)配制玉米-豆粕-膨化大豆-鱼粉型饲粮,基础饲粮配方及营养水平如表2所示。
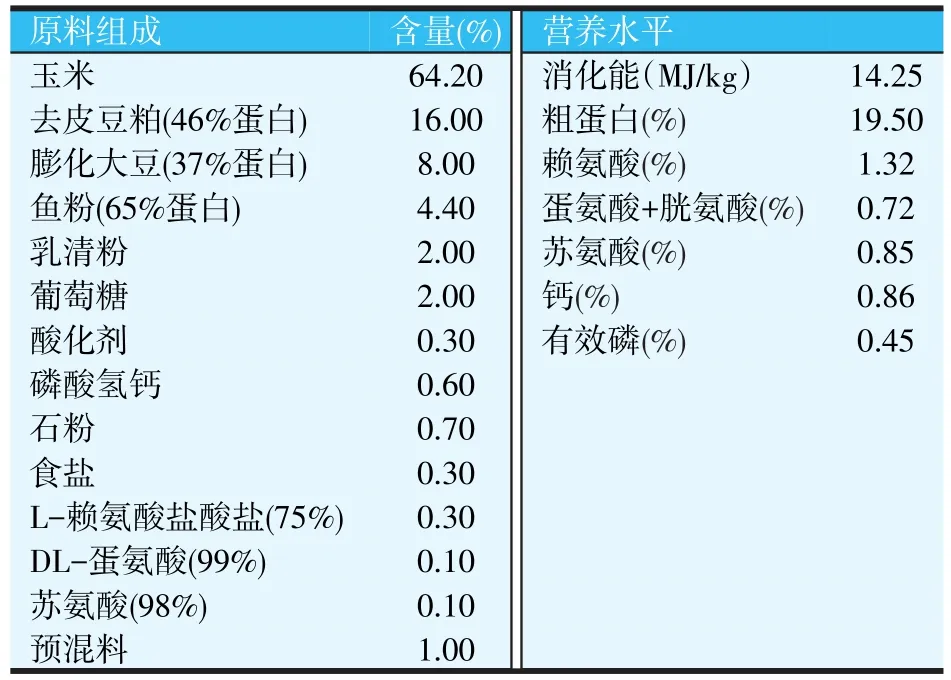
表2 基础饲粮配方及营养水平
1.5 饲养管理
所有猪只自由采食和饮水,猪舍温度控制在25~28℃。试验期7 d,攻毒前12 h所有猪只断水、断料。试验组仔猪每头灌服5 ml大肠杆菌K88(每头猪灌服1×1011CFU),对照组仔猪每头灌服5 ml生理盐水,攻毒后2 h开始供水,但仍然停止供料直至试验结束。攻毒6 h后仔猪全部屠宰,取脾脏放入液氮中速冻,然后将脾脏转移至-80℃超低温冰箱保存备用。
1.6 Toll-样受体测定
按照动物组织总RNA提取试剂盒说明书提取试验组和对照组脾脏总RNA。采用紫外分光光度法对RNA进行定量后,按照RNA反转录试剂盒说明书将RNA反转录成cDNA。以cDNA作为模板采用qPCR方法检测TLR2和TLR4基因的表达。qPCR反应体系:上游引物(2 μM)、下游引物(2 μM)各2 μl,50'ROX Reference Dey 0.4 μl,cDNA 5 μl,2'All-in-one qPCR Mix 10 μl,加DEPC处理水至20 μl。qPCR反应条件:95 ℃ 10 min;95 ℃ 10 s,62 ℃ 20 s,72 ℃15 s,收集荧光,共40个循环;熔解曲线条件:72~95℃,收集荧光。TLR2和TLR4的基因表达通过GAPDH进行标准化,并以相对于对照组的倍数表示。
1.7 统计分析
以每头猪为单位进行统计,试验数据用Excel 2007对数据进行初步处理;采用SAS统计软件下的Compare Means模块中的 One-Way ANOVA进行方差分析,并采用T-test组间差异显著性检验,P<0.05为差异显著,结果以“平均值±标准差”表示。
2 结果与分析
由表3和图1可知,在大肠杆菌K88感染下,饲粮添加枯草芽孢杆菌与对照组相比,能显著降低仔猪脾脏中TLR2(P<0.05)和TLR4(P<0.05)的表达量,其中TLR2的表达量下降了46%,TLR4的表达量下降了50%。

表3 饲粮添加芽孢杆菌对断奶仔猪脾脏TLR2和TLR4表达的影响
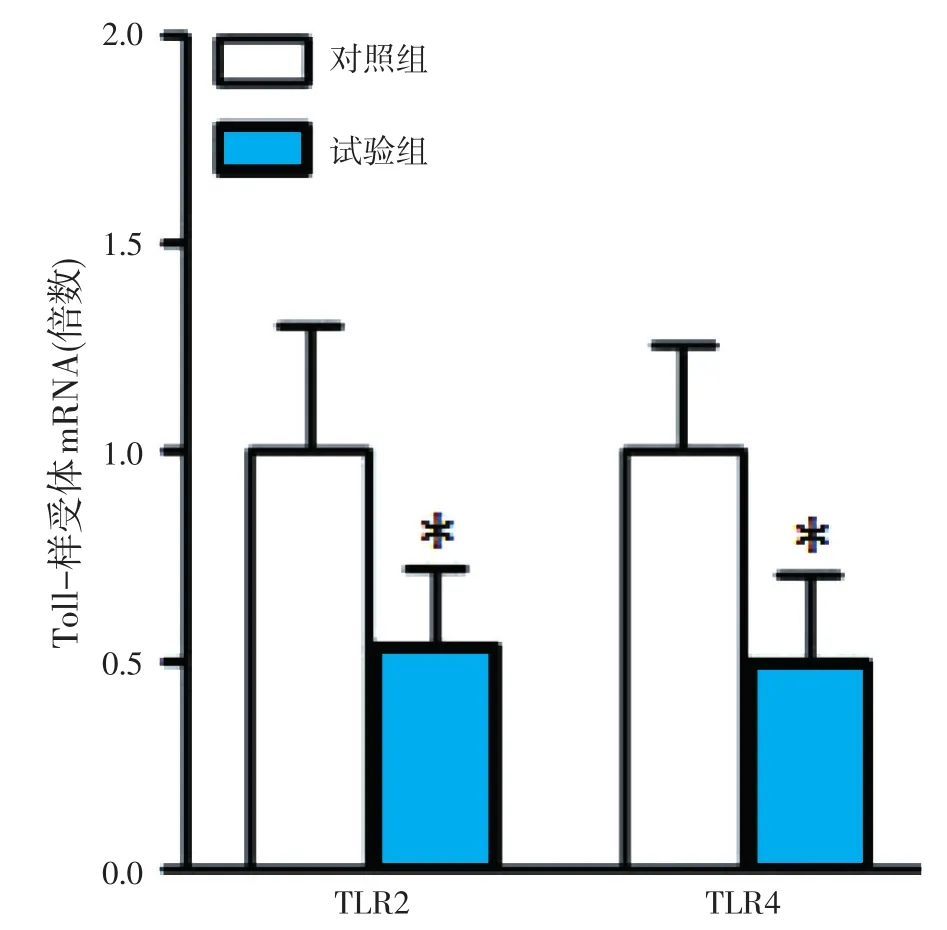
图1 饲粮添加芽孢杆菌对断奶仔猪脾脏TLR2和TLR4表达的影响
3 讨论
目前已经发现的PRRs有5种,包括Toll-样受体(TLRs)、视黄酸诱导基因-样受体(RLR)、NOD-样受体(NLRs)、C型凝集素受体(CLRs)和AIM2-样受体(ALRs)(Lan等,2012;DiDonato等,2012),以TLRs的研究最为广泛和深入。TLRs一旦识别PAMPs和DAMPs,就能够激活宿主的信号转导反应,启动先天性免疫应答和获得性免疫应答(Kaisho等,2008)。免疫应答的类型和强度都与PRRs识别PAMPs有关,根据识别PAMPs的性质,启动相应的免疫应答信号转导途径,其中核因子-κB(NF-κB)信号途径是宿主细胞产生先天性免疫应答的主要信号途径(Lan等,2012;DiDonato等,2012),当TLRs与相应的配体结合后,招募和活化接头分子向下游传递信号,激活IκB激酶并使IκB磷酸化,磷酸化的IκB进而被泛素化,通过蛋白酶体途径降解,解除IκB对NF-κB的限制,NF-κB核定位序列被暴露,从而使NF-κB从细胞浆转移到细胞核内,活化的NF-κB能够调控多种细胞因子的表达。
细胞因子具有多种生物功能,在刺激活化免疫细胞增殖分化、分泌抗体,增强CTL细胞杀伤活性、刺激单核细胞等合成、分泌细胞因子,导致炎性细胞浸润和增强吞噬细胞的杀灭能力等方面发挥着重要作用。TLRs不仅大量表达于脾脏和外周血白细胞等与免疫相关的组织及器官中,还大量表达于肺脏及胃肠道等易受外界环境侵袭的组织器官中(周敬禹等,2015)。TLR2和TLR4属于跨膜受体,能够识别病原菌的PAMPs,并将信号进行传递,最终激活NF-κB而诱导细胞因子的表达(Kaisho等,2008)。
有研究表明,在生理状态下枯草芽孢杆菌对十二指肠和回肠TLR2的mRNA相对表达量无显著影响(李云峰等,2011),该研究结果给我们的提示是,饲喂芽孢杆菌后能够保持仔猪的健康状态。在本试验中,通过给仔猪灌服致病性大肠杆菌K88建立致病模型,研究在病理状态下枯草芽孢杆菌对TLRs表达的影响,结果发现枯草芽孢杆菌能够显著降低大肠杆菌感染仔猪脾脏TLR2和TLR4的mRNA表达水平,说明大肠杆菌感染仔猪时TLR2和TLR4参与调节机体炎症反应。TLR2能够识别细菌表面的脂肽,TLR4识别革兰氏阴性菌表面的脂多糖,TLR4是识别革兰氏阴性细菌胞壁成分(内毒素)的关键分子,大肠杆菌细胞壁上的脂多糖是其主要的PAMP。研究表明,大肠杆菌能够激活TLR2和TLR4从而诱导TNF-α、IL-1和IL-8等炎症因子的表达(Li等,2012;Chytilova等,2013)。我们的研究结果显示,饲喂枯草芽孢杆菌的仔猪在遭受大肠杆菌感染时,可以通过降低TLR2和TLR4的表达达到减轻机体炎症反应的目的。
4 小结
在致病性大肠杆菌感染模式下,日粮添加枯草芽孢杆菌能降低断奶仔猪脾脏TLR2和TLR4的表达水平。
(参考文献14篇,刊略,需者可函索)

