饲粮粗蛋白质水平对中国荷斯坦奶牛产奶性能、氮利用及血液激素的影响
王星凌 刘春林 赵红波 游 伟 成海建
(1.山东省农业科学院畜牧兽医研究所,济南 250100;2.山东科技大学电气信息系,济南 250031)
确定泌乳奶牛饲粮粗蛋白质(CP)水平需要综合考虑乳和乳蛋白质产量、饲料成本及环境污染等方面的因素[1-2]。高饲粮 CP水平可以提高乳和乳蛋白质产量,但导致饲料氮(N)浪费,降低乳氮效率,提高饲料成本和增加粪、尿氮排放;低饲粮CP水平可以提高乳氮效率和减少粪、尿氮排放,但也可能降低乳和乳蛋白质产量。Broderick[3]研究了在3种不同能量水平条件下饲喂15.1%、16.7%和18.4%CP水平饲粮对泌乳奶牛氮代谢的影响,发现随着饲粮CP水平提高,尿氮占摄入氮的比例增加。Castillo等[1]提出了饲粮CP水平降低到15%可以提高乳氮效率和减少粪、尿氮排泄,与饲粮CP水平20%相比,减少了粪氮排泄(21%)和尿氮排泄(66%)。适当降低泌乳奶牛饲粮CP水平不仅可以减少氮排泄[4],并且能提高乳氮效率却不降低产奶量[5]。Austin 等[6]和Akayezu等[7]报道了饲喂奶牛饲粮 CP水平在16%~18%可获得相似的乳蛋白质产量。Powers等[8]报道了饲粮CP水平从14%提高到18%只轻微增加乳产量和乳蛋白质产量。随着评定奶牛CP供给和需要的不断改进,从CP供给转到降解和未降解CP,最近提出了对奶牛真实有效的CP水平,即代谢蛋白质(MP)[9-11]。当MP由均衡的氨基酸组成时,MP在合成乳蛋白质过程提供更为有效的氨基酸[12]。Schwab[13]强调,可饲喂类似豆粕这些高赖氨酸(Lys)蛋白质饲料来满足可代谢Lys的最佳需求量。Lys和蛋氨酸(Met)是泌乳奶牛的第一和第二限制性氨基酸[14-16],尤其是以玉米为基础的奶牛饲粮。本试验以饲粮CP水平为主要指标,用Lys含量评估饲粮蛋白质品质,测定4种不同饲粮CP水平对中国荷斯坦奶牛泌乳性能、氮利用和内分泌调节的影响。
1 材料与方法
1.1 试验设计和饲养管理
试验根据产奶量、泌乳天数(DIM)、胎次和体况选择8头平均体重(587±64)kg和 DIM(85.8±13.43)d的中国荷斯坦经产奶牛,按重复4×4拉丁方设计随机分为4个处理和4个试验周期。每个试验周期为18 d,其中适应期14 d,粪、尿和奶收集期4 d,血样采集在收集期最后1 d早晨饲喂后4 h进行。
4个饲粮处理的CP水平分别为12.56%、13.96%、15.53%和16.93%。为了评估试验饲粮的蛋白质品质,特别强调饲粮Lys含量,饲粮Lys含量依次配制成 0.48%、0.58%、0.68%和0.78%;4个饲粮处理的产奶净能(NEL)范围在6.95~7.28 MJ/kg。为了配制4种饲粮CP水平12.56% ~16.93%、饲粮Lys含量0.48% ~0.78%的产奶饲粮,4种饲粮 CP水平设计从12.56%按1.50%梯度等量递增,饲粮Lys含量从0.48%按0.10%梯度等量递增,配方必须优先考虑氨基酸组成良好的豆粕添加量。4种泌乳饲粮配方均采用CPM-Dairy软件程序[17],瘤胃降解蛋白质(RDP)和瘤胃未降解蛋白质(RUP)含量被很好平衡[9],可代谢赖氨酸(MP-Lys)含量仅发生很小变化(6.46%~6.26%)。试验饲粮组成及营养水平见表1。
所有试验奶牛日喂2次全混合日粮(TMR),TMR干物质含量45%。饲喂时间06:00和18:00。日饲喂量调整到剩料干物质约7%。剩料在每天06:00喂料之前收集和称重。试验奶牛自由饮水,水质保持新鲜,并和奶牛场其他泌乳奶牛一样运动和休息。试验奶牛每天挤奶2次,挤奶时间05:30和17:30,同其他泌乳奶牛一样在挤奶厅挤奶。
1.2 样品收集
在收集期,每天测定采食量和剩料量并进行取样,收集期结束时把每头牛4 d的饲粮和剩料样品分别混合均匀,各取约0.5 kg饲粮和剩料混合样品于-20℃保存待分析。
试验奶牛每天到挤奶厅挤奶2次,每次挤出的牛奶都流入已知重量的手提挤奶桶,单独称重和记录,每天随2次挤奶时间采取2份奶样。一份加到预先放入0.03 g重铬酸钾防腐剂的奶样管内用于乳成分分析;另一份按比例收集奶样,并将4 d奶样混合均匀于-20℃保存待定氮分析。为了确保奶牛排泄物的完整收集,从代谢牛舍到挤奶厅有专人护理。
在收集期之前,对8头试验奶牛采用人工收集粪尿训练,试验奶牛适应试验人员接近和接受粪尿收集。试验奶牛排粪时用铁锨靠近肛门下方接收,然后置入收粪容器;试验奶牛排尿时用收集桶接收,然后置入收尿容器。每12 h对收集的粪尿分别称量和取样。在收尿容器里按1 L尿液添加1 mL浓硫酸比例,使尿液pH<3。
每天全量收集粪便并称重,每12 h收样1次,取每天5%的粪样储藏于4℃,每期试验结束时,将每头牛4 d的粪样混合均匀后于-20℃冷冻保存待分析。每天全量收集尿样并称量,每次样品收集时尿样经纱布过滤,测定体积和重量,然后从收集尿液中取5%于-20℃保存。4 d收尿期结束后,将每头牛4 d的尿样混合均匀,再从中取适当比例尿样,-20℃冷冻保存备用。
在收集期的最后1天,早晨饲喂后4 h每头牛颈静脉采血,10 mL血样置入含肝素钠的离心管。采血结束后立即于3 000×g下离心15 min,吸取血浆保存于-20℃待分析。
1.3 样品分析
收集的TMR样品和粪样在烘箱内60℃鼓风干燥,称重风干样,冷却后粉碎过40目筛,以备干物质(DM)和总氮测定。饲料、粪、尿和奶样中的氮用全自动凯氏定氮仪(Kjeltec 8400,瑞典)测定。每一个收集期所有奶样采用乳成分及体细胞分析仪(CombiFoss FT+,丹麦Foss公司)红外技术分析乳样中的乳脂肪、乳蛋白质、乳糖、总固形物和体细胞[18]。

表1 试验饲粮组成及营养水平(干物质基础)Table1 Composition and nutrient levels of the experimental diets(DM basis) %
血糖、血浆尿素氮(PUN)以及血浆中的甘油三酯(TG)、非酯化脂肪酸(NEFA)和β-羟丁酸(BHBA)用全自动生化分析仪(日立7170A)测定。血糖用葡萄糖氧化酶比色法测定[19];PUN用脲酶比色法测定[20];TG用激酶比色法测定;NEFA用酰基辅酶A合成酶和氧化酶比色法测定;BHBA用脱氢酶比色法测定[21]。试剂盒由南京建成生物工程研究所提供。
血浆中的胰岛素(INS)、催乳素(PRL)、瘦素(leptin)、生长激素(GH)和胰岛素样生长因子1(IGF-1)用双抗体放射免疫法测定[22-34],试剂盒由北京普尔伟业生物科技有限公司提供。
1.4 数据统计
试验数据采用SAS 9.1中的GLM程序处理[25],统计模型为 Yijk= μ +Ci+Pj+Tk+Eijk,其中μ为总平均值,Ci为奶牛效应,Pj为周期效应,Tk为处理效应,Eijk为标准误。对处理效应和周期效应的所有最小二乘均值采用TDIFF比较。
2 结果
2.1 4个处理的饲粮组成
4个处理的饲粮CP水平分别为12.56%、13.96%、15.53%和16.93%,以1.50%梯度依次增加;饲粮 Lys含量分别为 0.48%、0.58%、0.68%和0.78%,以0.10%梯度依次增加。4个饲粮处理的NEL没有刻意调节,4个饲粮处理的RDP和 RUP基本相近,RDP变幅为61.4% ~60.4%,RUP变幅38.6% ~39.6%;4个饲粮处理的以 MP为基础的Lys含量基本相近,依次为6.46%、6.37%、6.30%和6.26%,与本试验饲粮Lys含量变化趋势不同。
2.2 饲粮CP水平对中国荷斯坦奶牛干物质摄入量(DMI)、产奶量和乳成分的影响
由表2可见,4个处理的饲粮DMI基本相同,这有利于测定不同饲粮CP水平对奶牛产奶量和乳成分的饲喂效果。饲粮CP水平12.56%的产奶量(26.45 kg/d)显著低于其他3个饲粮处理(P<0.05、P<0.01),比饲粮 CP水平 13.96%至16.93%分别低 1.73(P=0.015)、1.69(P=0.015)和2.27 kg/d(P=0.004)。能量校正奶(ECM)由公式(ECM=0.327×产奶量+12.95×乳脂含量+7.20×乳蛋白质产量)[26]计算而来。饲粮CP水平12.56%的ECM(29.44 kg/d)比饲粮CP水平13.96%低3.20 kg/d(P=0.050),乳蛋白率比饲粮CP水平16.93%低0.14%(P=0.006)。4个饲粮处理的乳脂率、乳糖率、总固形物和体细胞数(SCC)等指标均无明显变化(P>0.05)。
对于饲粮转化牛乳的饲料效率,饲粮CP水平12.56%的饲粮DM转化效率明显低于其他3个饲粮处理(P<0.01),比饲粮CP水平13.96%和15.53%均低0.09(P=0.006),比饲粮CP水平16.93%低0.11(P=0.002);对饲粮转化ECM的饲料效率,饲粮CP水平12.56%的饲粮DM转化效率比饲粮CP水平13.96%低0.15(P=0.050)。无论牛奶还是ECM的饲料效率,饲粮CP水平13.96%明显优于饲粮CP水平12.56%(P<0.05、P<0.01),与饲粮 CP水平15.53%和16.93%相近(P>0.05),但饲粮CP水平13.96%远低于饲粮CP水平15.53%和16.93%2个处理的饲粮CP和Lys含量。

表2 饲粮CP水平对中国荷斯坦奶牛干物质摄入量、产奶量、乳成分和饲料效率的影响Table2 Effects of dietary CP levels on DMI,milk production and composition,and feed efficiency of Chinese Holstein cows
2.3 饲粮CP水平对中国荷斯坦奶牛氮利用的影响
由表3可见,饲粮CP水平12.56%至16.93%的饲粮摄入氮含量依次增加,分别为437.08、485.23、540.45和588.50 g/d(P <0.01);消化氮含量由饲粮摄入氮含量与粪氮含量之差计算而得,消化氮含量变化与饲粮摄入氮含量变化呈相同趋势(P<0.01)。来自粪、尿、乳的氮排出量随着饲粮摄入氮含量增加而增加(P<0.05、P<0.01)。饲粮CP水平12.56%至15.53%的粪氮排出量明显低于饲粮CP水平16.93%(P<0.05),饲粮CP水平12.56%至15.53%的粪氮排出量则无显著差异(P>0.05)。饲粮CP水平12.56%至15.53%的尿氮排出量差异显著(P<0.01),饲粮CP水平15.53%和16.93%的尿氮排出量则无显著差异(P>0.05);饲粮 CP水平12.56%的尿氮排出量比饲粮CP水平13.96%至16.93%依次低23.20(P=0.033)、49.36(P=0.001)和60.74 g/d(P=0.000 4)。饲粮 CP水平12.56%的乳氮排出量显著低于饲粮CP水平为15.53%和16.93%(P <0.05、P<0.01),饲粮 CP水平13.96%的乳氮排出量与其他饲粮处理差异均不显著(P>0.05);饲粮CP水平12.56%的乳氮排出量比饲粮CP水平15.53%和16.93%分别低13.06(P=0.042)和 23.63 g/d(P=0.003)。由于饲粮CP水平13.96%至16.93%的乳氮排出量没有显著差异(P>0.05),体内氮沉积随着饲粮CP水平升高而增多,饲粮CP水平12.56%的氮沉积比饲粮CP水平15.53%和16.93%分别低35.39(P=0.025)和 41.75 g/d(P=0.013)。
尽管4个饲粮处理的饲粮CP水平不同,仅饲粮CP水平12.56%的氮表观消化率明显低于饲粮CP水平15.53%(P=0.024),同时4个饲粮处理的氮表观利用率没有显著变化(P>0.05),范围在31.09% ~34.17%。
4个饲粮处理的粪、尿、乳氮排出量和氮沉积占摄入氮的比例并不一致,其中粪氮、乳氮和沉积氮占摄入氮的比例差异显著(P<0.05)。饲粮CP水平12.56%的粪氮占摄入氮的比例比饲粮CP水平15.53%高4.97%(P=0.024);乳氮占摄入氮的比例比饲粮CP水平15.53%和16.93%分别高3.46%(P=0.014)和 3.89%(P=0.008),乳氮占摄入氮的比例明显受饲粮氮摄入量的影响,饲粮氮摄入量越大,乳氮占摄入氮的比例越小,降低饲粮CP水平有利于提高乳氮占摄入氮的比例;沉积氮占摄入氮的比例比饲粮CP水平15.53%和16.93%分别低6.91%(P=0.031)和7.48%(P=0.023),沉积氮占摄入氮的比例主要受饲粮氮摄入量和产奶量的影响,饲粮氮摄入量增多,产奶量不变,沉积氮占摄入氮的比例就提高。4个饲粮处理的尿氮占摄入氮的比例似乎受饲粮氮摄入量的影响,但没有显著变化(P>0.05),范围分别在37.53%~39.51%。
4个饲粮处理的乳氮和沉积氮占消化氮的比例差异显著(P<0.01),饲粮CP水平12.56%的乳氮占消化氮的比例比饲粮CP水平15.53%和16.93%分别高8.08%(P=0.005)和7.78%(P=0.006);沉积氮占消化氮的比例比饲粮CP水平15.53%和16.93%分别低8.94%(P=0.032)和9.68%(P=0.023)。4个饲粮处理的尿氮占消化氮的比例有随着饲粮氮摄入量增多而下调的趋势(P>0.05),范围分别在54.72% ~52.82%。
2.4 饲粮CP水平对中国荷斯坦奶牛血液代谢物和激素的影响
由表4可见,4个饲粮处理的血糖、TG、BHBA和NEFA浓度差异不显著(P>0.05),但PUN差异极显著(P<0.01),其中饲粮CP水平12.56%的PUN浓度比饲粮CP水平13.96%至16.93%分别低 0.65(P=0.08)、2.43(P<0.01)和3.23 mmol/L(P<0.01),PUN浓度随着饲粮CP水平提高明显升高;4个饲粮处理的胰岛素、PRL、GH和IGF-1浓度差异不显著(P>0.05),但瘦素差异显著(P<0.05),其中饲粮CP水平12.56%的瘦素浓度比饲粮CP水平13.96%和15.53%分别高1.83(P=0.016)和1.74 ng/mL(P=0.020)。
饲粮CP水平12.56%的血糖、NEFA、BHBA、PRL和IGF-1浓度高于其他3个饲粮处理(P>0.05),而TG和胰岛素浓度低于其他3个饲粮处理(P>0.05)。
3 讨论
3.1 4个处理的饲粮组成
Broderick[3]示范了在3种不同能量水平条件下饲喂15.1%、16.7%或18.4%CP水平饲粮对乳蛋白质产量的影响,在低和中等能量水平(6.44、6.74 MJ/kg NEL),饲粮CP水平从15.1%增加到16.7%,产奶量和乳蛋白质产量显著提高,继续提高饲粮CP水平,产奶量和乳蛋白质产量没有变化;在高水平能量条件下(6.86 MJ/kg NEL),能量和饲粮CP水平没有互作,产奶量和乳蛋白质产量的变化归结于饲粮CP水平。本试验饲粮NEL为6.95~7.28 MJ/kg,能量没有作为试验结果的影响因子。
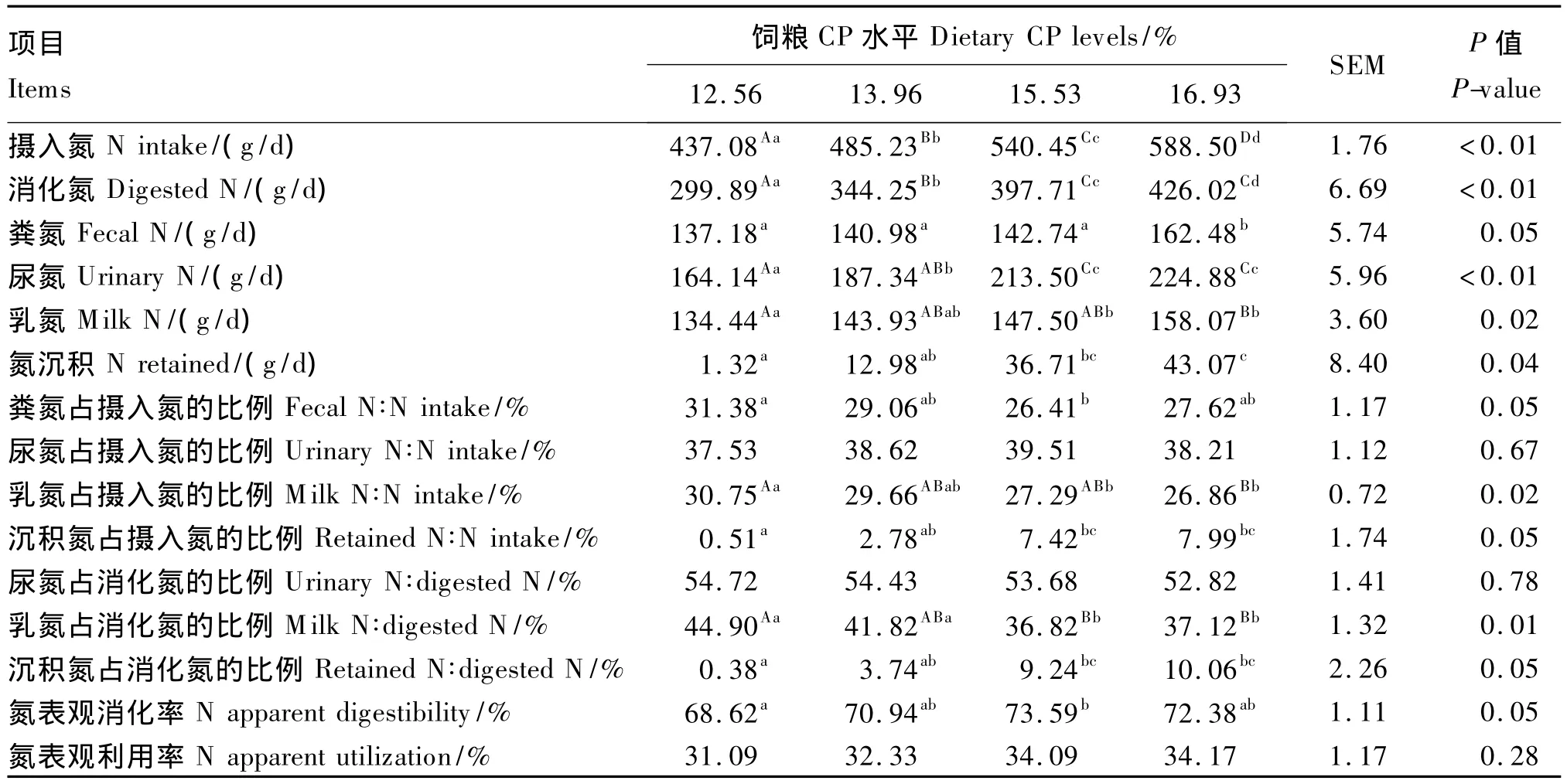
表3 饲粮CP水平对中国荷斯坦奶牛氮利用的影响Table3 Effects of dietary CP levels on nitrogen utilization of Chinese Holstein cows

表4 饲粮CP水平对中国荷斯坦奶牛血液代谢物和激素浓度的影响Table4 Effects of dietary CP levels on plasma metabolite and hormone concentrations of Chinese Holstein cows
Tomlinson等[27]针对奶牛饲粮养分在排泄物的损失,饲喂12%、15%和18%CP水平的饲粮,测定不同产奶量的奶牛对粪尿的氮排泄量的影响。Metcalf等[28]利用饲粮 CP水平 11.9% ~19.0%测定MP对乳蛋白质的转化效率。饲粮CP水平和摄入量是评定奶牛对蛋白质供给的最简单和实用方法,主要因为饲粮CP水平容易在实验室测定,同样饲粮Lys含量也很容易在实验室测定。饲粮Lys含量可以直接评估饲粮蛋白品质,MP中Lys代表MP的品质,MP-Lys通常为计算值[14]。本试验4个饲粮均采用相同的饲料原料,饲粮RUP和 RDP含量相近,设计饲粮 CP水平12.56%~16.93%、饲粮Lys含量0.48% ~0.78%的4个产奶饲粮,使4个饲粮对奶牛产奶性能和氮利用的作用具有可比性。本试验采用CPM-Dairy[17]计算了 4 个饲粮的 MP-Lys含量,发现用MP-Lys含量不易用以比较本试验不同CP水平的饲粮蛋白品质差异。本试验用Lys含量表达试验饲粮的蛋白质品质,饲粮主要指标选择CP水平。
3.2 饲粮CP水平对中国荷斯坦奶牛DMI、产奶量和成分的影响
Colmenero等[29]用饲粮 CP水平 13.5% ~19.4%测定日产41 kg奶牛的产奶量和乳成分,发现饲粮CP水平13.5%~16.5%对奶牛产奶量影响较大,饲粮CP水平16.5% ~19.4%的奶牛产奶量基本没有变化,或呈下降趋势;乳蛋白质产量也呈相似趋势。Cunningham 等[30]和 Leonardi等[31]发现饲粮CP水平从16.5%提高到18.5%和从16.1%提高到18.9%对奶牛产奶量没有影响。Broderick[3]证实饲粮 CP水平从 15.1% 提高到16.7%奶牛产奶量从33.0提高到34.1 kg,但饲粮CP水平提高到18.4%奶牛产奶量还是34.1 kg。
Santos等[32]认为,尽管豆粕不是RUP高含量的蛋白质饲料来源,豆粕是仅次于微生物蛋白质的乳合成的最有效蛋白质来源,含有相当优秀的氨基酸组成。Chen等[33]报道饲粮Lys从0.6%提高到1.0%可增加泌乳奶牛的产奶量和和乳蛋白质产量。孙建全等[34]用饲粮CP水平14.1%、Lys 0.60%和饲粮CP水平12.6%、Lys 0.58%测定中国荷斯坦奶牛产奶性能,两者产奶量分别为23.51和23.08 kg/d。很显然,饲粮Lys在改进奶牛产奶量和乳蛋白质产量方面具有重要作用。
本试验设计饲粮Lys含量随着饲粮CP水平提高而提高,用饲粮CP水平12.56%、13.96%、15.53%和16.93%的4个处理测定中国荷斯坦奶牛产奶性能。产奶量依次为26.45、28.18、28.14和28.72 kg/d;ECM整合了乳产量、乳脂产量和乳蛋白质产量,ECM 依次为29.44、32.64、31.46和32.04 kg/d。饲粮CP水平13.96%的产奶性能和饲粮CP水平16.93%相近,产奶量分别为28.18和28.72 kg/d、ECM 分别为32.64和32.04 kg/d,产奶量/饲粮干物质分别为1.30和1.32、ECM/饲粮干物质分别为1.50和1.47,饲粮 CP水平13.96%可以实现中国高产奶牛理想的产奶性能。4个饲粮处理的乳蛋白率逐渐上升,依次为3.21%、3.23%、3.27%和3.35%,说明饲粮 CP水平和Lys含量可以有效改进乳蛋白率。乳蛋白率的提高与其他的结果报道一致[35-37]。国外荷斯坦泌乳奶牛的饲粮CP水平16.5%,或不超过18.0%,产奶量保持最佳;本试验的中国荷斯坦泌乳奶牛的饲粮CP水平13.96%,或饲粮CP水平不超过15.53%,产奶量保持最佳。
3.3 饲粮CP水平对中国荷斯坦奶牛氮利用的影响
通常情况下,摄入氮越多,排泄氮就越多,一般以尿氮排出量为多,但是,奶氮排出量和氮沉积之和的氮利用率变化较小[27,38]。当饲粮CP水平从13.0%提高到17.0%[39]和从15.0%提高到16.5%[3],粪氮和尿氮排出量均增加。本试验饲粮CP水平从12.56%到15.53%的粪氮排出量差异不明显,仅饲粮CP水平16.93%的粪氮排出量高于其他3个饲粮处理;随着饲粮CP水平从12.56%提高到16.93%,尿氮排出量明显依次增加,但饲粮CP水平15.53%和16.93%的尿氮排出量相近。饲粮CP水平12.56%的粪氮排出量比饲粮CP水平13.96%至16.93%依次降低了2.77%、4.05%和18.44%,而尿氮排出量依次降低了14.13%、30.07%和37.00%。饲粮CP水平12.56%获得最低粪氮和尿氮排出量,饲粮CP水平13.96%可以缓解粪氮和尿氮排出量,饲粮CP水平达到15.53%,尿氮排出量不再明显增加。
一般而言,乳氮占摄入氮的比例即乳氮效率随饲粮CP水平提高而降低。乳氮占摄入氮的比例取决于乳氮排出量和饲粮摄入氮含量,而乳氮排出量取决于产奶量和乳氮含量。Colmenero等[29]提出饲粮 CP水平13.5% ~19.4%时,乳氮占摄入氮的比例36.5% ~25.4%,饲粮CP水平16.5%略高于17.9%和19.4%的产奶量,其乳氮占摄入氮的比例30.8%,优于饲粮CP水平17.9%和19.4%的乳氮效率。Broderick[3]应用饲粮 CP水平15.1%、16.7%和18.4%,乳氮占摄入氮的比例分别为30.3%、27.0%和23.4%,由于饲粮CP水平16.7%和18.4%的产奶量相同,饲粮CP水平16.7%的乳氮占摄入氮比例27.0%,优于饲粮CP水平18.4%。类似结果也被其他研究证实[28,35,40]。本试 验 应 用 饲 粮 CP 水 平 12.56%、13.96%、15.53%和16.93%4个饲粮处理,测定乳氮占摄入氮的比例分别为30.75%、29.66%、27.29%和26.86%、乳氮占消化氮的比例分别为44.90%、41.82%、36.82%和37.12%,饲粮 CP水平12.56%和13.96%的乳氮占摄入氮的比例或乳氮占消化氮的比例没有差异,和其他2个高饲粮CP水平差异显著。饲粮CP水平13.96%的产奶量高于12.56%(分别为28.18和26.45 kg/d),与其他2个高饲粮CP水平相近,乳氮占摄入氮的比例或乳氮占消化氮的比例也就优于2个高饲粮CP水平。
粪氮表观消化率容易受饲料原料的消化率影响,一般随饲粮CP水平下降而降低。Groff等[41]发现饲粮CP水平15.00%上升到18.75%,泌乳奶牛粪氮表观消化率随之提高。Colmenero等[29]提出饲粮CP水平13.5% ~19.4%时,粪氮表观消化率为59.7%~70.4%。类似结果也被其他研究证实[3,40]。有研究将这一现象归结于随着饲粮CP水平提高,内源代谢氮排出量减少,粪氮表观消化率则上升[42];Broderick[3]在认可内源代谢氮排出量的同时,随着饲粮CP水平提高,高消化的蛋白质饲料原料也是同等重要因素。这就解释了为什么本试验饲粮CP水平12.56%的粪氮消化率最低。
3.4 饲粮CP水平对中国荷斯坦奶牛血液代谢物和激素的影响
PUN是氮代谢在动物机体的终产物,也是本试验唯一的非能量血液代谢物。PUN浓度主要来自瘤胃氨氮的转运,也反映了饲粮CP水平和摄入量。如果提供低饲粮CP,PUN势必进入瘤胃提供氮来源以维持瘤胃微生物正常发酵,导致低浓度的PUN。高水平的饲粮CP导致高浓度的PUN,高浓度的PUN意味着奶牛对饲粮CP的无效利用[43]。本试验饲粮CP水平低,PUN浓度则低;饲粮CP水平高,PUN浓度也就随之明显升高。
血糖、TG、NEFA和BHBA均为血液能量代谢物,反映奶牛机体能量代谢状况。Socha等[44]认为是饲粮养分影响NEFA、BHBA和血糖浓度的效应很短暂,在平衡状态下NEFA、BHBA和血糖浓度不受饲粮养分影响。Miller等[45]认为血糖浓度不会限制乳合成。血浆高浓度BHBA引起肝脏酮体生成增多,提高NEFA浓度。本试验血糖、TG、NEFA和BHBA浓度不随饲粮CP水平的提高发生改变,但饲粮CP水平12.56%的血糖、NEFA和BHBA浓度略高于其他3个饲粮处理。
在养分不足条件下,奶牛需要动员额外激素来适应机体能量代谢,维持产奶需求[46-47]。通常提高GH分泌,降低胰岛素对骨骼肌肉和白脂组织的作用,导致白脂组织合成瘦素,饲粮养分尤其能量是调节瘦素合成的主要因子[48-49]。PRL也可能与瘦素合成有关[50]。PRL是泌乳开始和泌乳持续所必需的蛋白质激素。本试验饲粮CP水平12.56%的瘦素浓度明显高于其他3组,血液瘦素高浓度可能与NEFA和BHBA较高浓度有关;同时PRL、GH和IGF-1浓度也略高于其他3个饲粮处理,这可能意味着饲粮CP水平12.56%不能满足奶牛泌乳需求,需要动员相关激素。
提高饲粮CP水平或氨基酸含量,乳蛋白率或产量也随之提高,同时血浆胰岛素水平上升[51-52]。在本试验,随着饲粮 CP水平和 Lys含量提高,胰岛素浓度不断升高,产奶量尤其是乳蛋白率也增加。也有研究表明,提高饲粮CP水平不影响胰岛素、PRL或 GH浓度[53-55],而且饲粮氨基酸失衡容易提高IGF-1浓度和降低GH浓度[36]。胰岛素和其他激素如GH、IGF-1的互作在乳合成对养分利用的调控起重要作用。GH抑制氨基酸分解,促进IGF-1合成,提高或维持产奶量;胰岛素刺激乳腺上皮细胞繁殖和乳腺细胞的氨基酸转运,IGF-1主要控制乳腺上皮细胞数量,胰岛素浓度升高则刺激乳蛋白质合成。随着饲粮CP水平提高,增加GH刺激肝脏IGF-1的释放,然后通过反馈机制,IGF-1又抑制垂体GH的释放。本试验饲粮CP水平12.56%的GH和IGF-1浓度较高,但胰岛素浓度较低,这些激素浓度和低饲粮CP或Lys含量可能导致产奶量和乳蛋白率明显减少;而饲粮CP水平16.93%的胰岛素和GH浓度较高,IGF-1浓度较低,可能导致产奶量和饲粮CP水平13.96%和15.53%相近,但乳蛋白率明显提高。
4 结论
①饲粮CP水平从12.56%按1.50%等同梯度提高到16.93%,产奶量和ECM没有呈线性增加。饲粮CP水平13.96%达到最佳的产奶量和ECM,其ECM的饲料转化效率占有优势,乳氮效率明显高于其他2个高饲粮CP水平。
②随着饲粮CP水平的提高,尿氮排出量随之增加,乳氮排出量缓慢上涨,体内沉积氮明显增加,而粪氮排出量只在饲粮CP水平16.93%出现明显增加。
③不同饲粮CP水平引发不同激素和血液代谢物浓度的变化,差异大多不显著。
[1]CASTILLO A R,KEBREAB E,BEEVER D E,et al.A review of efficiency of nitrogen utilization in lactating dairy cows and its relationship with environmental pollution[J].Journal of Animal and Feed Sciences,2000,9(1):1-32.
[2]JONKER J S,KOHN R A,HIGH J.Dairy herd management practices that impact nitrogen utilization efficiency[J].Journal of DairyScience,2002,85:1218-1226.
[3]BRODERICK G A.Effects of varying dietary protein and energy levels on the production of lactating dairy cows[J].Journal of Dairy Science,2003,86(4):1370-1381.
[4]FRANK B,SWENSSON C.Relationship between content of crude protein in rations for dairy cows and milk yield,concentration of urea in milk and ammonia emissions[J].Journal of Dairy Science,2002,85(7):1829-1838.
[5]CHRISTENSEN R A,CAMERON M R,KLUSMEYER T H,et al.Influence of amount and degradability of dietary protein on nitrogen utilization by dairy cows[J].Journal of Dairy Science,1993,76:3497-3513.
[6]AUSTIN C L,SCHINGOETHE D J,CASPER D P,et al.Influence of bovine somatotropin and nutrition on production and composition of milk from dairy cows[J].Journal of Dairy Science,1991,74(11):3920-3932.
[7]AKAYEZU J M,HANSEN W P,OTTERBY D E,et al.Yield response of lactating Holstein dairy cows to dietary fish meal or meat and bone meal[J].Journal of Dairy Science,1997,80(11):2950-2963.
[8]POWERS W J,VAN HORN H H,HARRIS B,Jr.,et al.Effects of variable sources of distillers dried grains plus solubles on milk yield and composition[J].Journal of Dairy Science,1995,78(2):388-396.
[9]NRC.Nurtient requirements of dairy cattle[M].7th ed.Washington,D.C.:The National Academies Press,2001.
[10]FOX D G,TEDESCHI L O,TYLUTKI T P,et al.The cornell net carbohydrate and protein system model for evaluating herd nutrition and nutrient excretion[J].Animal Feed Science and Technology,2004,112:29-78.
[11]TYLUTKI T P,FOX D G,DURBAL V M,et al.Cornell net carbohydrate and protein system:a model for precision feeding of dairy cattle[J].Animal Feed Science and Technology,2008,143:174-202.
[12]BLOUIN J P,BERNIER J F,REYNOLDS C K,et al.Effect of supply of metabolizable protein on splanchnic fluxes of nutrients and hormones in lactating dairy cows[J].Journal of Dairy Science,2002,85:2618-2630.
[13]SCHWAB C G.Balancing diets for amino acids:nutritional,environmental and financial implications[C]//Tri-State Dairy Nutrition Conference.Fort Wayne:[s.n.],2010,1-13.
[14]RULQUIN H,GUINARD J,VERITE R.Amino acid nutrition of dairy cows:production effects and animal requirements[M].[S.l.]:Nottingham University Press,1993,55-77.
[15]SCHWAB C G,BOZAK C K,WHITEHOUSE N L,et al.Amino acid limitation and flow to the duodenum at four stages of lactation.I.Sequence of lysine and methionine limitation[J].Journal of Dairy Science,1992,75:3486-3502.
[16]SCHWAB C G,BOZAK C K,WHITEHOUSE N L,et al.Amino acid limitation and flow to duodenum at four stages of lactation.2.Extent of lysine limitation[J].Journal of Dairy Science,1992,75:3503-3518.
[17]CPM-Dairy,Version 3.0.Dairy cattle ration analyzer[CP].Department of Animal Sciences,Cornell University:Ithaca,2006.
[18]AOAC.Official methods of analysis[M].16th ed.Gaithersburg,M.D.:Association of Official Analytical Chemists,1997.
[19]GOCHMAN N,SCHMITZ J M.Application of a new peroxide indicator reaction to the specific,automated determination of glucose with glucose oxidase[J].Clinical Chemistry,1972,18:943-950.
[20]MARSH W H,FINGERHUT B,MILLER H.Automated and manual direct methods for the determination of blood urea[J].Clinical Chemistry,1965,11:624-627.
[21]CANT J P,DEPETERS E J,BALDWIN R L.Mammary uptake of energy metabolites in dairy cows fed fat and its relationship to milk protein depression[J].Journal of Dairy Science,1993,76:2254-2265.
[22]VERNON R G,CLEGG R A,FLINT D J.Metabolism of sheep adipose-tissue during pregnancy and lactation-adaptation and regulation[J].Biochemical Journal,1981,200:307-314.
[23]MCGUIRE M A,DWYER D A,HARRELL R J,et al.Insulin regulates circulating insulin-like growth factors and some of their binding proteins in lactating cows[J].American Journal of Physiology,1995,269:E723-E730.
[24]EHRHARDT R A,SLEPETIS R M,VANAMBURGH M E,et al.Development of a specific RIA to measure physiological changes of circulating leptin in cattle and sheep[J].Journal of Endocrinology 2000,166:519-528.
[25]SAS Institute.SAS user’s guide:statistics[M].Cary,N.C.:SAS Institute Inc.,2001.
[26]TYRRELL H F,REID J T.Prediction of the energy value of cow’s milk[J].Journal of Dairy Science,1965,48:1215-1223.
[27]TOMLINSON A P,POWERS W J,VAN HORN H H,et al.Dietary protein effects on nitrogen excretion and manure characteristics of lactating cows[J].Trans of the ASAE,1996,39(4):1441-1448.
[28]METCALF J A,MANSBRIDGE R J,BLAKE J S,et al.The efficiency of conversion of metabolisable protein into milk true protein over a range of metabolisable protein intakes[J].Animal,2008,2(8):1193-1202.
[29]COLMENERO J J,BRODERICK G A.Effect of dietary crude protein concentration on milk production and nitrogen utilization in lactating dairy cows[J].Journal of Dairy Science,2006,89:1704-1712.
[30]CUNNINGHAM K D,CECAVA M J,JOHNSON T R,et al.Influence of source and amount of dietary protein on milk yield by cows in early lactation[J].Journal of Dairy Science,1996,79:620-630.
[31]LEONARDI C,STEVENSON M,ARMENTANO L E.Effect of two levels of crude protein and methionine supplementation on performance of dairy cows[J].Journal of Dairy Science,2003,86:4033-4042.
[32]SANTOS F A,SANTOS J E,THEURER C B,et al.Effects of rumen-undegradable protein on dairy cow performance:a 12-year literature review[J].Journal of Dairy Science,1998,81:3182-3213.
[33]CHEN K H,HUBER J T,THEURER C B,et al.Effect of supplemental protein quality and evaporative cooling on ladation performance of Holstein cows in hot weather[J].Journal of Dairy Science,1993,76:819-825.
[34]孙建全,赵红波,刘春林,等.改变日粮蛋白质和赖氨酸含量对奶牛产奶性能和氮利用及代谢激素的影响[J].南京农业大学学报,2011,34(2):124-128.
[35]NOFTSGER S,ST-PIERRE N R.Supplementation of methionine and selection of highly digestible rumen undegradable protein to improve nitrogen efficiency for milk production[J].Journal of Dairy Science,2003,86:958-969.
[36]WEEKES T L,LUIMES P H,CANT J P.Responses to amino acid imbalances and deficiencies in lactating dairy cows[J].Journal of Dairy Science,2006,89:2177-2187.
[37]HADROVÁ S,K RˇÍŽOVÁ L,BJELKA M,et al.The effect of administration of soya-protein with Lys,Met,and His in two forms on casein yield and composition and AA profile in milk[J].Journal of Animal and Feed Sciences,2007,16:3-17.
[38]FLIS S A,WATTIAUX M A.Effects of parity and supply of rumen-degraded and undegraded protein on production and nitrogen balance in Holsteins[J].Journal of Dairy Science,2005,88:2096-2106.
[39]KAUFFMAN A J,ST-PIERRE N R.The relationship of milk urea nitrogen to urine nitrogen excretion in Holstein and Jersey cows[J].Journal of Dairy Science,2001,84:2284-2294.
[40]DAVIDSON S,HOPKINS B A,DIAZ D E,et al.Effects of amounts and degradability of dietary protein on lactation,nitrogen utilization,and excretion in early Holstein cows[J].Journal of Dairy Science,2003,86:1681-1689.
[41]GROFF E B,WU Z.Milk production and nitrogen excretion of dairy cows fed different amounts of protein and varying proportions of alfalfa and corn silage[J].Journal of Dairy Science,2005,88:3619-3632.
[42]HOLTER J B,BYRNE J A,SCHWAB C G.Crude protein for high milk production[J].Journal of Dairy Science,1982,65:1175-1188.
[43]BRODERICK G A,CLAYTON M K.A statistical evaluation of animal and nutritional factors influencing concentrations of milk urea nitrogen[J].Journal of Dairy Science,1997,80:2964-2971.
[44]SOCHA M T,PUTNAM D E,GARTHWAITE B D,et al.Improving intestinal amino acid supply of preand postpartum dairy cows with rumen-protected methionine and lysine [J].Journal of Dairy Science,2005,88:1113-1126.
[45]MILLER P S,REIS B L,CALVERT C C,et al.Patterns of nutrient uptake by the mammary glands of lactating dairy cows[J].Journal of Dairy Science,1991,74(11):3791-3799.
[46]VERNON R G,POND C M.Adaptations of maternal adipose tissue to lactation[J].Journal of MammaryGland Biology and Neoplasia,1997,2:231-241.
[47]BAUMAN D E.Regulation of nutrient partitioning during lactation:homeostasis and homeorhesis revisited[C]//Proceedings of the 9th international symposium on ruminant physiology.New York:CABI Publishing,2000:311-328.
[48]MUELLER W M,GREGOIRE F M,STANHOPE K L,et al.Evidence that glucose metabolism regulates leptin secretion from cultured rat adipocytes[J].Endocrinology,1998,139:551-558.
[49]WELLHOENER P,FRUEHWALD-SCHULTES B,KERN W,et al.Glucose metabolism rather than insulin is a main determinant of leptin secretion in humans[J].Journal of Clinical Endocrinology and Metabolism,2000,85:1267-1271.
[50]GUALILLO O,LAGO F,GARCIA M,et al.Prolactin stimulates leptin secretion by rat white adipose tissue[J].Endocrinology,1999,140:5149-5153.
[51]KUHARA T,KATOH K,ODA S,et al.Responses of metabolic hormones to prolonged intradueodenal infusion of AAs in sheep[J].Animal Science Technology,1992,63:1123-1133.
[52]LEMOSQUET S,RIDEAU N,RULQUIN H,et al.Effects of duodenal glucose infusion on the relationship between plasma concentrations of glucose and insulin in dairy cows[J].Journal of Dairy Science,1997,80:2854-2865.
[53]RODRIGUEZ N R,PRIGGE E C,LOUGH D S,et al.Glucogenic and hormonal responses to abomasal casein and ruminal volatile fatty acid infusions in lactating goats[J].Journal of Dairy Science,1985,68:1968-1975.
[54]COHICK W S,VICINI J L,STAPLES C R,et al.Effects of intake and postruminal casein infusion on performance and concentrations of hormones in plasma of lactating cows[J].Journal of Dairy Science,1986,69:3022-3031.
[55]GUINARD J,RULQUIN H,VERITE R.Effect of graded levels of duodenal infusions of casein on mammary uptake in lactating cows.1.Major nutrients[J].Journal of Dairy Science,1994,77:2221-2231.

