低蛋白质饲粮中添加尿素对肉兔生长发育及血液指标的影响
汪水平 田兴舟 何 琴 王红杨 邓红丽 李岑曦
(1.西南大学荣昌校区,重庆 402460;2.西南大学重庆市牧草与草食家畜重点实验室,重庆 400716)
蛋白质是动物生长发育及其产品产量和质量提高的重要物质基础。随着我国畜牧业的发展,蛋白质饲料供给日趋紧张,成为制约产业发展和生产效率提高的重要因素之一。将尿素等非蛋白氮(non-protein nitrogen,NPN)作为反刍动物的蛋白质饲料来源,是缓解目前蛋白质饲料资源短缺的有效途径之一。家兔是小型草食性单胃动物,具有发达的盲肠微生物区系和独特的食粪习性,具备利用NPN的消化生理基础[1]。目前,有关家兔能否利用尿素及其利用效率的研究很多,但不同试验的结论不尽相同[2]。本试验拟给肉兔饲喂尿素添加量不同的低蛋白质饲粮,通过对其生长性能、主要脏器与胃肠道发育及血液指标的考察,评估尿素的应用效果,确定适宜用量,为NPN作为肉兔氮源提供科学依据。
1 材料与方法
1.1 试验材料
尿素(分析纯)购自北京康普汇维科技有限公司,含量为99%,系白色柱状结晶,实测氮含量为46.49%。玉米过1 mm筛粉碎,实测干物质含量为86.85%,粗蛋白质含量为8.68%(干物质基础)。将玉米粉和尿素按80∶20的比例混匀,使用洋工EXT50G精英型单螺杆干法膨化机在140℃下膨化,得糊化淀粉缓释尿素。将制得的糊化淀粉缓释尿素过1.5 mm筛粉碎,实测干物质含量为92.00%,氮含量为9.89%(干物质基础)。
1.2 基础饲粮
参考 NRC(1998)[3]推荐的青年兔营养需要量并兼顾试验目的,配制粗蛋白质含量较低的基础饲粮,其组成及营养水平见表1。在配制试验饲粮时,需在基础饲粮玉米数量上,扣除各自添加的糊化淀粉缓释尿素所含的玉米数量。试验所用玉米均按糊化淀粉缓释尿素制备工艺进行膨化。所有饲料原料过1.5 mm筛粉碎,按不同试验组分别混匀,再采用冷制粒工艺制成粒径为4 mm的颗粒料。
1.3 试验设计
选用50日龄、体重相近的健康新西兰兔作为试验动物。采用单因子随机区组试验设计,将120只新西兰兔随机分为4组,1个对照组和3个试验组,每组15个重复,每个重复2只。对照组饲喂基础饲粮,3个试验组分别饲喂在基础饲粮中添加1%、2%和3%尿素(折合糊化淀粉缓释尿素添加量分别为5%、10%和15%)的试验饲粮。预试期为10 d,正试期为30 d。试验组肉兔在预试期内由基础饲粮逐渐过渡到试验饲粮。
1.4 饲养管理
试验于2011年6月1日至2011年7月10日在重庆市荣昌县西南大学荣昌校区“7+5”肉兔养殖创业组进行。各组试验兔公母各占1/2,相同性别的2只试验兔饲养在同一笼中,兔舍为2层双列式。采用颗粒料饲喂,自由采食与饮水,日喂2次(07:00和18:00),每次投料少量多添,每次投料时间不少于2 h。兔舍自然采光,自然通风,日打扫卫生1次,保持兔舍清洁卫生。试验期间按兔场规定进行防疫、驱虫和消毒,并密切观察试验兔行为,发现异常立即处理。
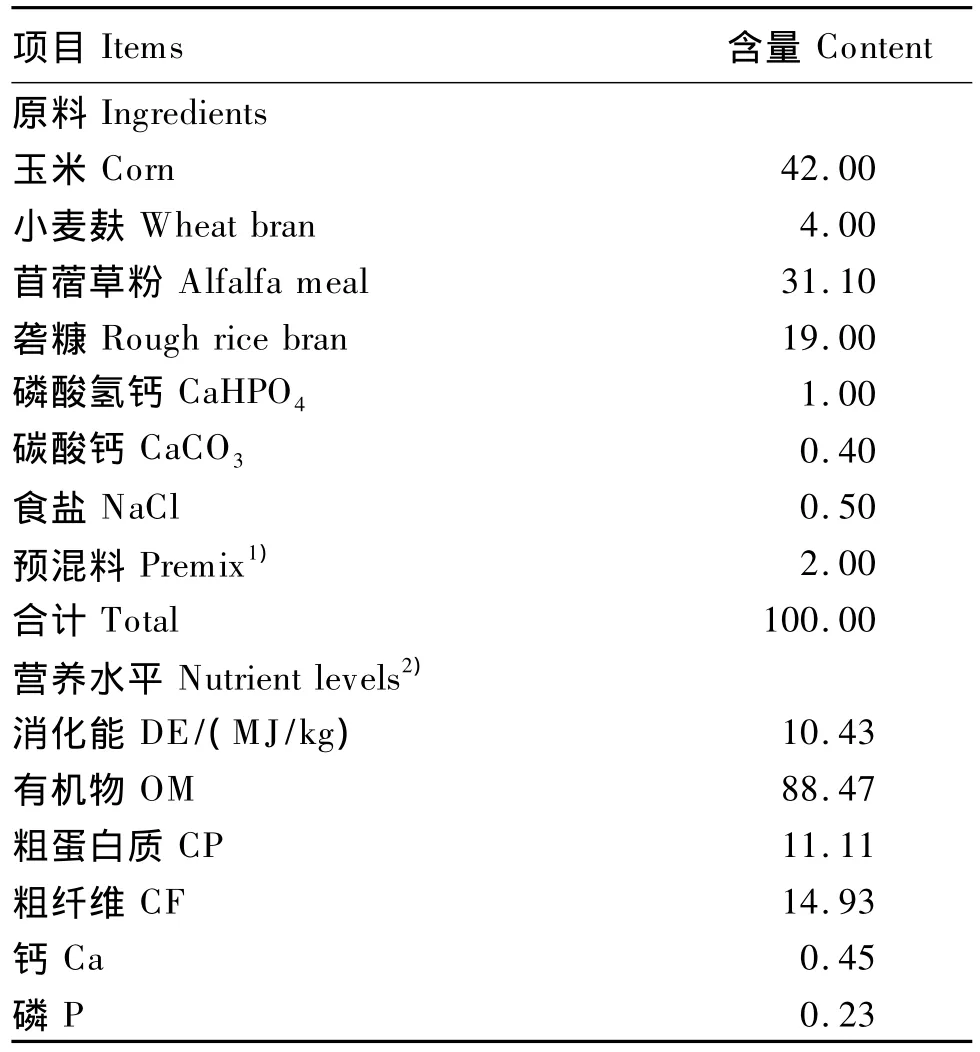
表1 基础饲粮组成及营养水平(干物质基础)Table1 Composition and nutrient levels of the basal diet(DM basis) %
1.5 测定指标与方法
1.5.1 饲养环境参数
试验兔饲养环境参数主要包括环境温度、相对湿度和温湿指数。在兔舍中部1.5 m高处挂置多频道无线温湿度计(EMR 812 HGN,Oregon Scientific,Inc.Portland,Oregon USA)主装置,每日 02:00、08:00、11:00、14:00、20:00 测定舍内温度和相对湿度。温湿指数计算公式为:
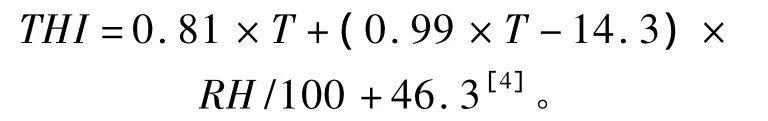
式中:THI为温湿指数;T为温度;RH为相对湿度。
1.5.2 生长性能
在正试期开始和结束时分别在晨饲前给试验兔称重,两者相减即为增重,再计算日增重。在正试期内每天记录试验兔的进食量,计算日干物质进食量。日干物质进食量与日增重之比,即为料重比。
1.5.3 血液指标
在正试期结束的次日,从每个重复中随机挑选1只试验兔,晨饲前心脏采血6 mL。取1 mL全血立即采用水杨酸钠-靛酚蓝显色法[5]测定氨氮(ammonia nitrogen,NH3-N)含量,其余血液室温斜置静放1~2 h,3 000 r/min低温离心15 min,所得血清于-80℃下保存待测。所有血清指标均使用贝克曼库尔特SYNCHRON CX5 PRO全自动生化仪测定,其中葡萄糖(glucose,GLU)含量采用己糖激酶终点法测定,尿素氮(urea nitrogen,UN)含量采用脲酶UV法测定,谷丙转氨酶(glutamate-pyruvate transaminase,GPT)和谷草转氨酶(glutamicoxaloacetic transaminase,GOT)活性均采用 IFCC速率法测定,碱性磷酸酶(alkaline phosphatase,AKP)活性采用SFBC速率法测定。
1.5.4 育肥性能
采血后的试验兔采用耳缘静脉注射空气法致死后,称重(宰前重),立即剥皮,在同一位置去头和去蹄,并移走除肾脏以外内脏,静止30 min后称重,即为胴体重,再计算屠宰率。
1.5.5 主要脏器发育状况
从试验兔脏器中分离心脏、肝脏、脾脏及肾脏,分别称重,再除以宰前重,即得各脏器系数,以评估试验兔主要脏器发育状况。
1.5.6 胃肠道发育状况
从试验兔胃肠道中分离出胃、十二指肠、空肠、回肠、盲肠、蚓突及大肠,测定各段的长度,再将胃肠道划开,用生理盐水冲洗干净,随即用吸水纸轻轻擦拭,清除表面附着水分后分别称重,再除以宰前重,即得各自的系数,以评估试验兔胃肠道发育状况。
1.6 数据统计与分析
试验数据采用Excel 2003软件进行处理,结果采用SPSS 11.5软件中的GLM模块进行方差分析和显著性检验,用Duncan氏法进行多重比较。
2 结果与分析
2.1 试验兔健康状况
在预试期由基础饲粮逐渐过渡到试验饲粮时,试验兔的反应依尿素添加量而异。1%和2%尿素组试验兔没有出现不良反应,过渡顺利。3%尿素组试验兔进食量逐渐减少,甚至拒食,以致逐渐消瘦;排粪、排尿频率和数量明显减少,粪便颗粒变小,且呈干结状;部分精神萎靡,蜷卧成团,畏冷,不时颤抖;在完全饲喂试验饲粮的第2天,有80%的试验兔出现呼吸急促、平衡失调、歪头斜脑等表征,并在出现上述表征后不久高声鸣叫数声后头歪向一侧而亡;解剖可见腹部臌气,胃壁及肠壁稀薄,触手可破,后肠内粪便颗粒黏结呈线状,肝脏和肾脏暗红,未发现病灶,血液暗红,黏滞度较高,可以断定为氨中毒。鉴于3%尿素组试验兔的健康状况,剩余的20%未进入正试期,转喂基础饲粮,之后逐渐恢复进食,体况好转。1%尿素组试验兔进入正试期后,一切正常。2%尿素组试验兔在正试期前期进食和健康状况正常,后期进食量逐渐减少,体况消瘦,排粪、排尿频率和数量减少,粪便颗粒变小,有氨中毒征兆,但未危及生命,直至试验结束。由于基础饲粮粗纤维水平较高,粗料高、低质搭配合理,同时试验期间环境卫生保持良好,故试验兔均未出现腹泻现象。
2.2 试验兔饲养环境参数
由图1可知,试验期兔舍内温度、相对湿度和温湿指数最高分别为33.42℃、91.75%和84.92,最低分别为22.70℃、58.77%和69.49,表明试验兔处于高温高湿饲养环境中。由表2可知,试验期兔舍内温度平均为27.86℃,相对湿度平均为78.91%,温湿指数平均为79.22。
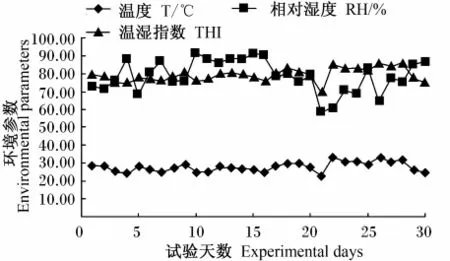
图1 试验兔饲养环境参数日变曲线Fig.1 Daily change curves of feeding environmental parameters for experimental rabbits

表2 试验兔饲养环境参数Table2 Feeding environmental parameters for experimental rabbits
2.3 试验兔生长、育肥性能
由表3可知,3组试验兔始重差异不显著(P>0.05)。1%尿素组试验兔末重、增重和日增重均极显著高于对照组和2%尿素组(P<0.01)。2%尿素组试验兔日干物质进食量、胴体重和屠宰率均极显著低于对照组和1%尿素组(P<0.01),而料重比则极显著高于对照组和1%尿素组(P<0.01)。
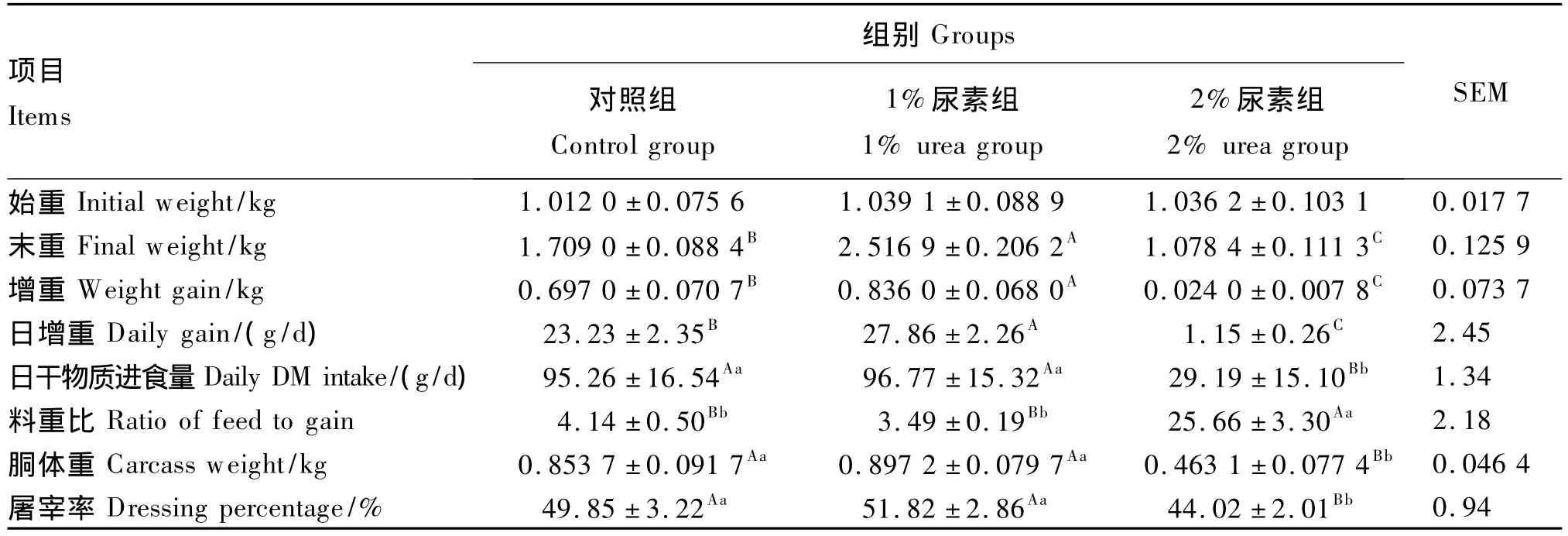
表3 试验兔生长、育肥性能Table3 Growth and finishing performance of experimental rabbits
2.4 试验兔血液指标
由表4可知,3组试验兔血清葡萄糖含量差异不显著(P>0.05)。1%和2%尿素组试验兔全血氨氮含量和血清谷丙转氨酶活性显著或极显著高于对照组(P<0.05或P<0.01)。此外,2%尿素组试验兔血清尿素氮含量以及谷草转氨酶、碱性磷酸酶活性均极显著高于对照组和1%尿素组(P<0.01)。
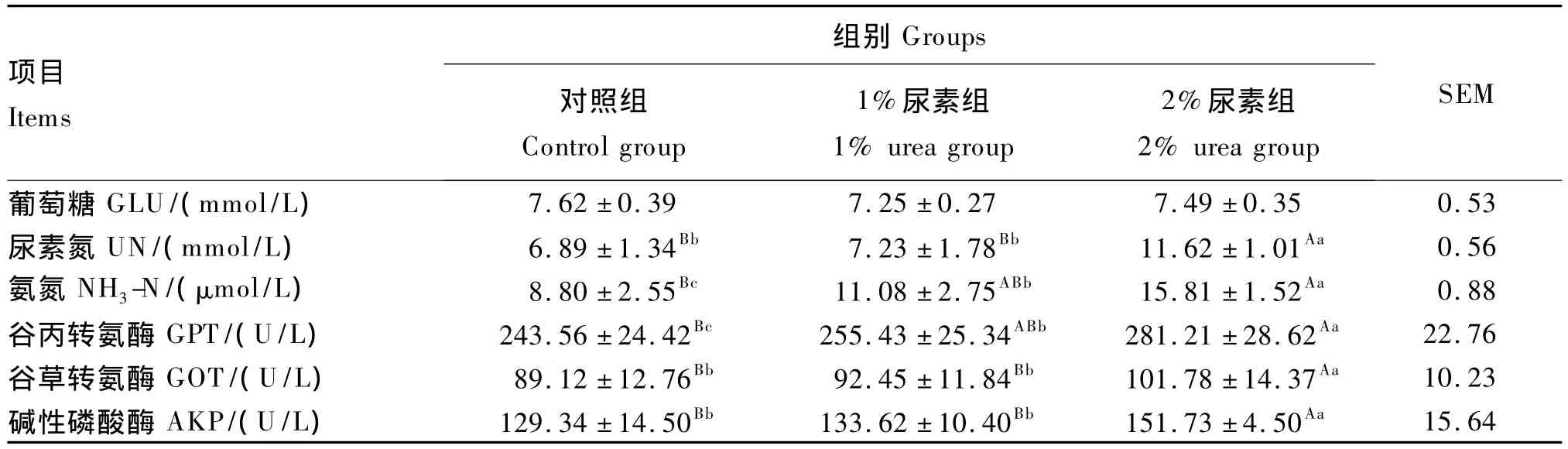
表4 试验兔血液指标Table4 Blood indices of experimental rabbits
2.5 试验兔主要脏器发育状况
由表5可知,3组试验兔心脏和脾脏系数均差异不显著(P>0.05),而肝脏重和系数均差异显著或极显著(P<0.05或P<0.01)。2%尿素组试验兔心脏、脾脏和肾脏重均显著低于对照组和1%尿素组(P<0.05),而肾脏系数则极显著高于对照组和1%尿素组(P<0.01)。
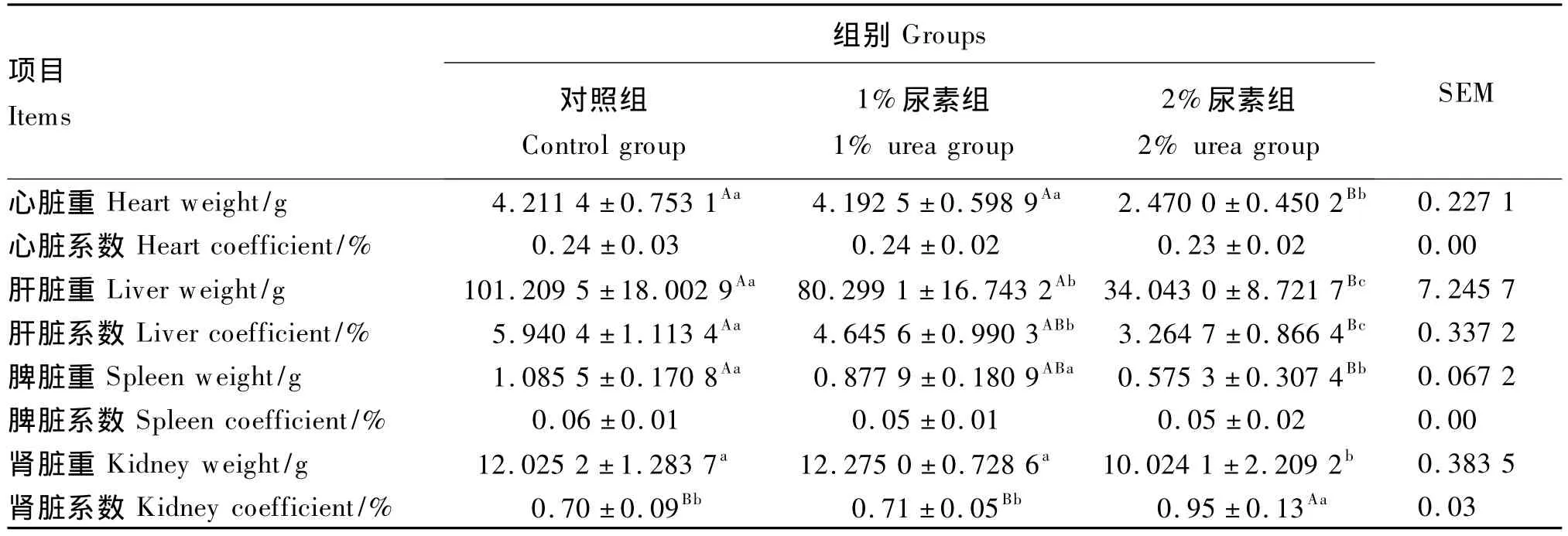
表5 试验兔主要脏器重量与系数Table5 Weight and coefficient of main organs of experimental rabbits
2.6 试验兔胃肠道发育状况
由表6可知,3组试验兔胃、十二指肠、空肠和大肠系数均差异不显著(P>0.05)。2%尿素组试验兔胃重、十二指肠重与长、空肠重与长、回肠重与长、盲肠重与系数、蚓突重与系数及长、大肠重与长显著或极显著低于对照组和1%尿素组(P<0.05或P<0.01)。此外,2%尿素组试验兔回肠系数及盲肠长显著或极显著低于对照组(P<0.05或 P<0.01)。
3 讨论
3.1 低蛋白质饲粮中添加尿素对肉兔生长、育肥性能的影响
动物短时间进食大量尿素会导致氨中毒,这一点在反刍动物上早有定论[6]。本试验表明,肉兔也不例外。事实上,为使尿素能很好地充当肉兔氮源,本试验做了以下措施:1)制备糊化淀粉缓释尿素,改善尿素饲粮的适口性,降低尿素分解速度;2)配制粗蛋白质含量(11.11%)较低的基础饲粮,提高尿素氮利用率;3)基础饲粮中玉米所占比例较大,且经过糊化,供能效果更佳。然而,肉兔在完全进食3%尿素饲粮的第2天就出现大批因氨中毒造成的死亡。尽管肉兔可长达30 d完全进食2%尿素饲粮,但其后期一直处于亚健康状态,表现出氨中毒的征兆,说明肉兔对2%尿素饲粮的耐受能力有限,这是2%尿素组试验兔生长发育几乎停滞的原因。本试验中,饲粮中添加1%的尿素能极显著提高肉兔日增重,具有降低料重比的趋势,对屠宰率亦能略微提高,表明1%尿素添加量可改善肉兔的生长、育肥性能。研究者对尿素在家兔饲粮中的应用效果一直存在争议。张宝庆等[7]将27只生长獭兔随机分为3组,分别饲喂含有0、1%和2%尿素的饲粮,结果獭兔增重、日增重、日进食量及屠宰率均差异不显著,而综合考虑生长性能、屠宰性能及肉和毛皮品质等指标,认为1%尿素添加量效果较好。孔祥浩等[8]报道,在玉米秸粉含量为50%的颗粒料中添加1%的尿素会显著降低3月龄塞北兔日增重,而对日进食量和料重比分别具有降低和提高的趋势。周维仁等[9]在低蛋白质基础饲粮(粗蛋白质含量为10.12%)中添加1%、2%和3%的尿素,分别饲喂5只2.5月龄的新西兰兔30 d,发现肉兔日增重有随尿素添加量增加而提高的趋势,而综合考虑血清氨氮、尿素氮含量及谷丙转氨酶、谷草转氨酶活性等指标,认为各添加量均不会影响肉兔的生长,且长时间高剂量饲喂不会对肉兔生理状况产生不良影响。周维仁等[10]报道,给5只2月龄新西兰公兔饲喂添加3%尿素的低蛋白质饲粮(粗蛋白质含量为10.12%),与饲喂粗蛋白质含量为15.30%的饲粮相比,日增重略有降低。周维仁等[11]认为,饲粮中添加1%~2%的尿素作为饲粮蛋白质的补充,可促进兔的生长;饲粮中添加3%的尿素后,兔的生长比对照组略有加快,饲料报酬明显改善,试验过程中未出现氨中毒现象。对比上述试验可以发现,基础饲粮的配方与配制、试验动物的品种与年龄、参与试验的动物只数及饲养管理等因素使得不同研究结果缺乏可比性。
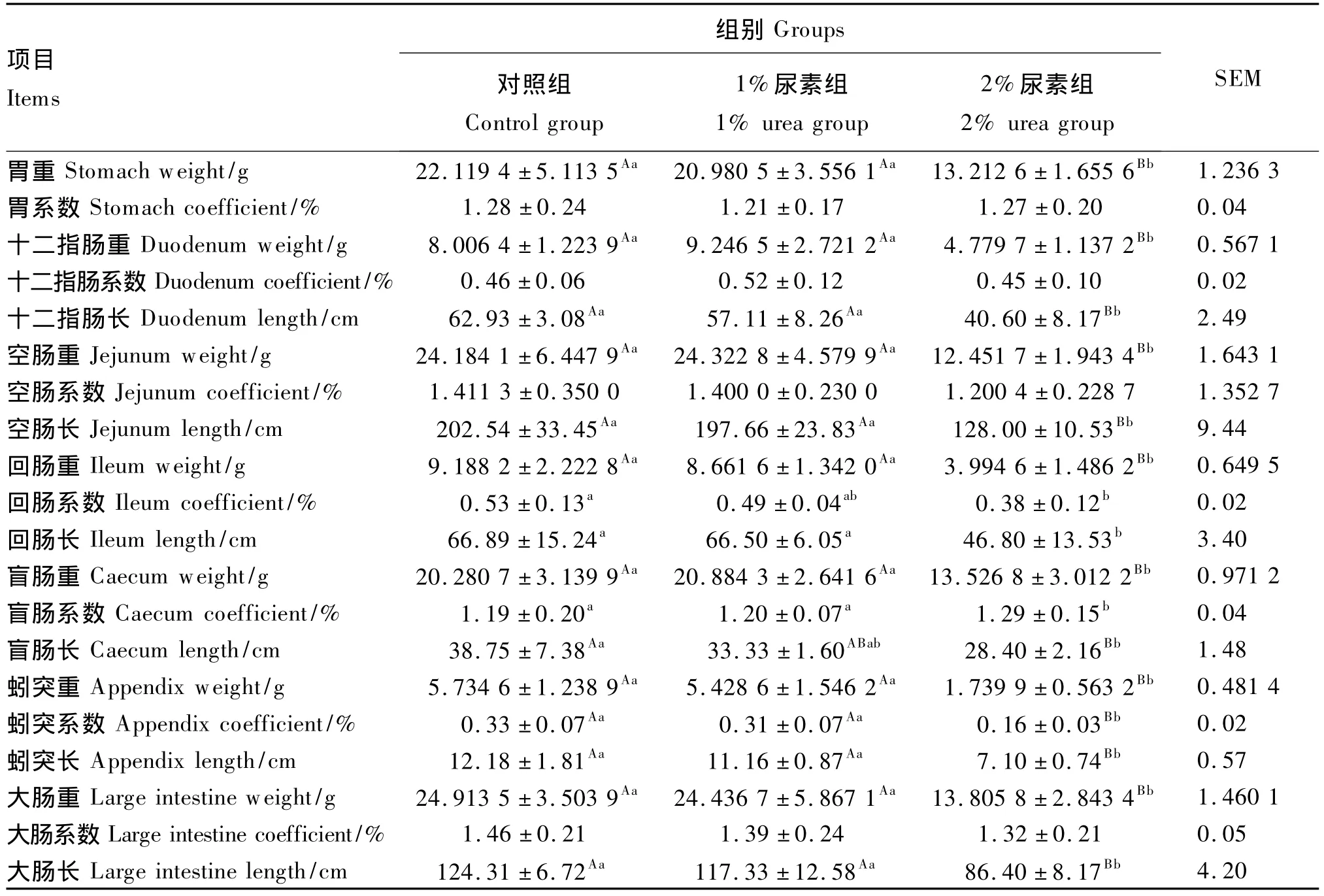
表6 试验兔胃肠道重量与系数及肠道长度Table6 Weight and coefficient of gastrointestinal tract and length of intestinal tract of experimental rabbits
3.2 低蛋白质饲粮中添加尿素对肉兔血液指标的影响
尿素水解是尿素在脲酶的作用下分解成氨和二氧化碳,而脲酶是由消化道内厌氧微生物产生的,其活性最适pH为7~9,当pH低于3或高于9时,脲酶几乎无活性[12]。家兔的胃和小肠pH较低,且微生物数量少,脲酶活性不高,故尿素在其中几乎不被水解[13]。但是,尿素是小分子物质,进入动物体内可不经改变就从胃和小肠中吸收进入血液[14]。因此,家兔食入尿素后,一部分很快通过胃和小肠吸收进入血液,再循环至盲肠和肝脏;另一部分直接进入盲肠,在微生物分泌的脲酶作用下,分解成氨和二氧化碳。其中,一部分氨扩散到血液中,进入肝脏合成尿素去毒。本试验中,肉兔血清尿素氮主要来自食入尿素的直接吸收和氨的合成,而全血氨氮主要是尿素分解产生的。因此,随着饲粮尿素添加量的增加,肉兔血清尿素氮和全血氨氮含量升高。葡萄糖作为重要的营养性单糖,是动物代谢活动快速应变需能的最有效营养素,是大脑神经系统、肌肉组织、脂肪组织、胎儿生长发育及乳腺等代谢的唯一能源[15]。本试验中,肉兔血清葡萄糖含量组间差异不显著,表明饲粮中添加尿素不会影响肉兔葡萄糖的供应。血清中的酶绝大部分来自动物的各种组织器官,其活性高低与相应组织器官的代谢水平和功能状态有关,而机体的调节和适应能力在很大程度上取决于各组织器官的机能水平[4]。通常,各种酶以恒定的活性存在于血清中,当某一种组织细胞的结构或功能改变时,与之相关的酶的活性在血清中会随之发生改变[4]。谷丙转氨酶主要存在于肝细胞浆中,是动物最敏感的肝功能检测指标之一;谷草转氨酶在肝细胞、心肌和骨骼肌中含量均较高,对肝脏不具特异性[16]。随着动物长大成熟和骨骼成年化,来自成骨细胞的碱性磷酸酶逐渐减少,而来自肝细胞的碱性磷酸酶逐渐增多[16]。当肝功能损害时,上述酶即释放于血清中,使其活性急剧升高。本试验中,随着饲粮尿素添加量的增加,试验兔血清谷丙转氨酶、谷草转氨酶及碱性磷酸酶活性增强,表明肉兔肝脏受损害程度逐渐加强。实际上,无论是处理多余的尿素还是多余的氨,都会增加肝脏负担,从而影响肉兔健康。
3.3 低蛋白质饲粮中添加尿素对肉兔主要脏器和胃肠道发育状况的影响
由于2%尿素组试验兔生长几乎停滞,这会严重影响其主要脏器及胃肠道发育,故无论主要脏器重或系数,还是胃肠道重或系数,亦或肠道长度,低于对照组和1%尿素组都在可理解范围内。例外的是,2%尿素组试验兔肾脏和盲肠系数要大于对照组和1%尿素组,表明饲粮中添加2%的尿素实际上促进了肉兔肾脏和盲肠的发育。尿素在兔体内首先是被盲肠微生物利用,合成微生物蛋白,而无法利用的尿素则由肾脏排出[1]。因此,盲肠和肾脏是兔处理尿素的重要器官。按照拉马克的“用进废退”进化论观点,2%尿素组试验兔肾脏和盲肠在活跃地处理尿素,换句话说,饲粮中添加2%的尿素增加了肉兔肾脏和盲肠新陈代谢的强度。1%尿素组和对照组试验兔生长正常,但前者的肝脏重和系数却显著低于后者,同时结合血液指标来看,可以认为饲粮中添加1%的尿素对肉兔肝脏的发育产生了不利影响。由于没有设立正常蛋白质饲粮的对照组,故无法得知究竟是蛋白质不足增强肝脏利用内源尿素的能力而促进了对照组试验兔肝脏发育,还是盲肠吸收氨的毒性作用抑制了1%尿素组试验兔肝脏发育。此外,1%尿素组试验兔胃肠道重量与系数及肠道长度与对照组相比均无显著差异,表明饲粮中添加1%的尿素不会影响肉兔胃肠道的发育。
4 结论
本试验条件下,低蛋白质饲粮中添加3%的尿素会造出肉兔氨中毒死亡;添加2%的尿素会使肉兔生长发育停滞;添加1%的尿素可改善肉兔生长、育肥性能,但会对肝脏的发育产生不利影响。
[1]LANG J.The nutrition of the commercial rabbit:Ⅰ.Physiology,digestibility and nutrientrequirements[J].Nutrition Abstract and Reviews,1981,51:197-225.
[2]路复员,周维仁.兔利用尿素的研究进展[J].畜牧与兽医,2001(33):37-39.
[3]NRC.Nutrient requirements of rabbit[S].Washington,D.C.:National Academy Press,1998:34-42.
[4]王文娟,汪水平,左福元,等.中药复方对夏季肉牛的影响:Ⅰ.育肥性能、生理指标及血清激素水平和酶活性[J].畜牧兽医学报,2010,41(10):1260-1267.
[5]邓健,陈玉玉,袁亚莉,等.水杨酸钠-靛酚蓝显色法直接测定血氨[J].数理医药学杂志,2000,13(2):176-177.
[6]杨凤.动物营养学[M].北京:中国农业出版社,2000:57-58.
[7]张宝庆,郑艳华,赵国先,等.在生长獭兔日粮中添加尿素的试验研究[J].中国养兔杂志,1996(5):18-23.
[8]孔祥浩,郭金双,周学勇,等.玉米秸粉颗粒料添加尿素饲喂商品肉兔试验[J].河北畜牧兽医,2001,17(11):16.
[9]周维仁,路复员,王恬,等.日粮中不同尿素水平对兔生长及血液生化指标的影响[J].江苏农业学报,2002,18(2):106-110.
[10]周维仁,路复员,王恬,等.尿素日粮添加脲酶抑制剂对兔生长及血液生化指标的影响[J].江苏农业学报,2002,18(3):167-171.
[11]周维仁,薛飞,徐小明,等.日粮中不同脲酶抑制剂和尿素水平对兔生产性能及屠宰性能的影响[J].江苏农业科学,2005(1):78-80.
[12]CROCIANI F,BIAVATI B,CASTAGNOLI P,et al.Anaerobic ureolytic bacteria from cecal content and soft feces of rabbit[J].Journal of Applied Bacteriology,1984,57:83-88.
[13]THOMAS E S.Bacteria of the rabbit gut and their role in the health of the rabbit[J].Journal of Applied Rabbit Research,1988,11:142-150.
[14]FORSYTHE S J,PARKER D S.Ammonia-nitrogen turnover in the rabbit caecum and exchange with plasma urea-N[J].British Journal of Nutrition,1985,54:285-292.
[15]王文娟,汪水平,左福元.反刍动物淀粉消化与葡萄糖吸收研究进展[J].西北农林科技大学学报:自然科学版,2008,36(5):27-34.
[16]东北农业大学.兽医临床诊断学[M].北京:中国农业出版社,2010:189-198.

