鲈鱼视黄酸受体α和视黄酸受体γ cDNA克隆和基因表达分析
钱云霞 韩 柳 童彩环 郑伟贤
(宁波大学生命科学与生物工程学院,应用海洋生物技术教育部重点实验室,宁波 315211)
维生素A(视黄醇)是机体必需的一种营养素,在哺乳动物的生长、发育、免疫和繁殖等生命过程中起着非常重要的作用[1]。与哺乳动物一样,维生素A也是鱼类必不可少的营养素,维生素A不足会导致鱼类生长减慢,出现眼、鳍和表皮出血等症状,严重时会引起死亡[2-4]。维生素A在体内的代谢产物主要是视黄酸,即由视黄醇类氧化成视黄醛,视黄醛再氧化成视黄酸[5]。维生素A的多种生物学功能都是通过视黄酸信号途径实现的,视黄酸作为配体只有运输到细胞核内与视黄酸受体(retinoic acid receptor,RAR)和视黄醇类X受体(retinoid X receptor,RXR)形成的异源二聚体结合,才能识别并结合到目的基因启动子上的视黄酸作用元件(retinoic acid response element,RARE),进而实现对目的基因的转录调节[6-7]。RARE的结构特点是5'-AGGTCA-3'单元的直接重复序列(direct repeat,DR),DR间存在1~5个碱基的插入,分别称为 DR1、DR2、DR3、DR4 和 DR5,而RAR二聚体主要识别 DR5,也识别 DR1和DR2[8]。RAR在哺乳动物中有3种亚型,即RARα、RARβ 和 RARγ,分别由不同的基因编码[9]。作为核受体超家族的成员,RAR分子具有典型的核受体结构,由非保守的N端转录激活域(transactivation domain,A/B 区)、保守的DNA 结合区(DNA-binding domain,DBD,C 区)、铰链区(linker region,D 区)、配体结合区(ligand-binding do-main,LBD,E 区)和 F 区组成[10]。所有的全反式视黄酸和9-顺式视黄酸都是RAR的配体,与其他配体依赖的转录激活受体不同,当配体存在时,RAR二聚体与RARE结合并进一步激活转录;而配体不存在时,RAR二聚体也可以与RARE结合,但同时与维甲酸和甲状腺激素受体沉默调节子(silencing mediator of retinoic acid receptor and thyroid hormone receptor,SMRT)和核受体辅阻遏物(nuclear receptor corepressor,N-CoR)等抑制子结合,从而抑制目的基因的转录[11]。由于许多基因都受RAR途径的调控,因而RAR参与机体的许多生命过程[12-13],但关于鱼类RAR的研究只有很少的报道,RAR基因仅在斑马鱼(Danio rerio)、红鳍东方鲀(Takifugu rubripes)、佛罗里达雀鳝(Lepisosteus platyrhincus)和褐牙鲆(Paralichthys olivaceus)等少数几种鱼类中被分离和鉴定[14-15]。
鲈鱼(Lateolabrax japonicus),属鲈形目鮨科鲈属,属于广盐性肉食性凶猛鱼类,是我国沿海主要的海水养殖鱼类之一。本研究克隆了鲈鱼的RARα和RARγ基因cDNA序列,并分析了它们的结构及在各个组织中的表达,期望能为研究RAR基因在鲈鱼视黄酸信号中的作用提供基础资料。
1 材料与方法
1.1 试验材料
试验用2龄鲈鱼购买于宁波水产品大世界。
总RNA提取试剂(Trizol)购自美国Invitrogen公司;扩增试剂盒(SMARTTMRACE cDNA Amplification Kit)购自美国Clontech公司;逆转录试剂(PrimeScriptTM1stStrand cDNA Synthesis Kit)、Taq酶和pMD-18T载体均购自日本TaKaRa公司;间氨基苯甲酸乙酯甲磺酸盐(MS-222)为美国Sigma公司产品;其他试剂为国产分析纯试剂。试验所用引物由上海捷瑞生物工程有限公司合成。大肠杆菌(Escherichia coli)DH5α由本实验室保存。
1.2 总RNA的提取和cDNA第1条链的合成
鲈鱼经MS-222麻醉后取肝脏组织,参照Trizol试剂操作说明提取总RNA,经紫外分光光度计(NanoDrop 1000 Spectrophotometer)检测总RNA的浓度和纯度,用1.2%的琼脂糖凝胶电泳检测总RNA的完整性。取总RNA 1 μg参照逆转录试剂盒操作说明书合成cDNA第1条链。
1.3 RAR全长cDNA扩增
根据人(Homo sapiens,BC071733)、牛(Bos Taurus,NM_001014942)、鸡 (Gallusgallus,X78335)、大西洋鲑(Salmo salar,AF290610)、佛罗里达雀鳝(Lepisosteus platyrhincus,AB292640)、斑马鱼(Danio rerio,NM_131399)和红鳍东方鲀(Takifugu rubripes,NM_001032753)的 RARα 基因cDNA序列设计RACE兼并引物(表1)。
同理根据人(BC098421)、小鼠(Mus musculus,NM_001042727)、鸡 (X73973)、牛 (NM_001130756)、青鳉鱼(Oryzias latipes,EF546455)、佛罗里达雀鳝(AB292642)、斑马鱼(BC098519)和虹鳟(Oncorhynchus mykiss,NM_001246348)的RARγ基因cDNA序列设计RACE兼并引物(表1)。
以上述肝脏cDNA为模板,用兼并引物分别扩增 RARα和 RARγ基因核心片段。其中 RARα基因的扩增条件为:预变性94℃ 3 min;94℃30 s,56~52 ℃ 30 s,72 ℃ 1 min,共进行 36 个循环(前4个循环退火温度每循环下降1℃);最后72℃延伸5 min。RARγ基因的梯度退火温度为60~55℃,其他条件均与RARα基因相同。PCR产物经1.2%的琼脂糖凝胶电泳检测,目标片段割胶纯化后与pMD18-T载体连接,连接产物转化大肠杆菌DH5α感受态细胞。PCR检测后将阳性克隆送上海英骏生物工程公司进行序列测定。
参照SMARTTMRACE cDNA Amplification Kit说明书,将鲈鱼肝脏总RNA分别合成5'端和3'端RACE cDNA片段(5'-and 3'-RACE-ready cDNA)。在测序得到的核心序列的基础上,分别设计RARα和RARγ基因5'端和3'端 RACE特异性引物(表1)。PCR产物纯化、克隆和测序方法同上。最后对所获得的序列进行拼接,获得RAR全长cDNA序列。
1.4 序列分析
应用BioEdit软件进行氨基酸序列推导及同源性分析。经 ScanProsite软件(http://www.expasy.ch/prosite/)对锌指结构进行预测。使用MEGA 4.0软件,通过邻位相连(neihbor joining,NJ)法对鲈鱼RAR氨基酸序列和GenBank中已收录的其他已知动物进行分子进化树聚类分析。
1.5 RAR基因在各组织中表达分析
根据得到的RAR基因序列设计逆转录PCR特异性引物,序列见表1。提取鲈鱼肝脏、肌肉、心脏、眼、肠、肾脏、脂肪、脾脏、鳃和大脑10个组织的总RNA,分别用无RNA酶的DNA酶(RNase free DNase)消化,各取1 μg参照 PrimeScriptTM1stStrand cDNA Synthesis Kit说明书逆转录合成cDNA。以18S RNA为内参基因(序列见表1),检测RAR基因在不同组织中的相对表达量。18S RNA的PCR反应条件如下:94℃预变性3 min;94 ℃ 50 s,54 ℃ 40 s,72 ℃ 40 s,26 个循环(18S RNA的表达量较目标基因高);72℃延伸2 min。RARα与RARγ基因的退火温度分别56和54℃,循环数均为28,其他条件与18S RNA相同。
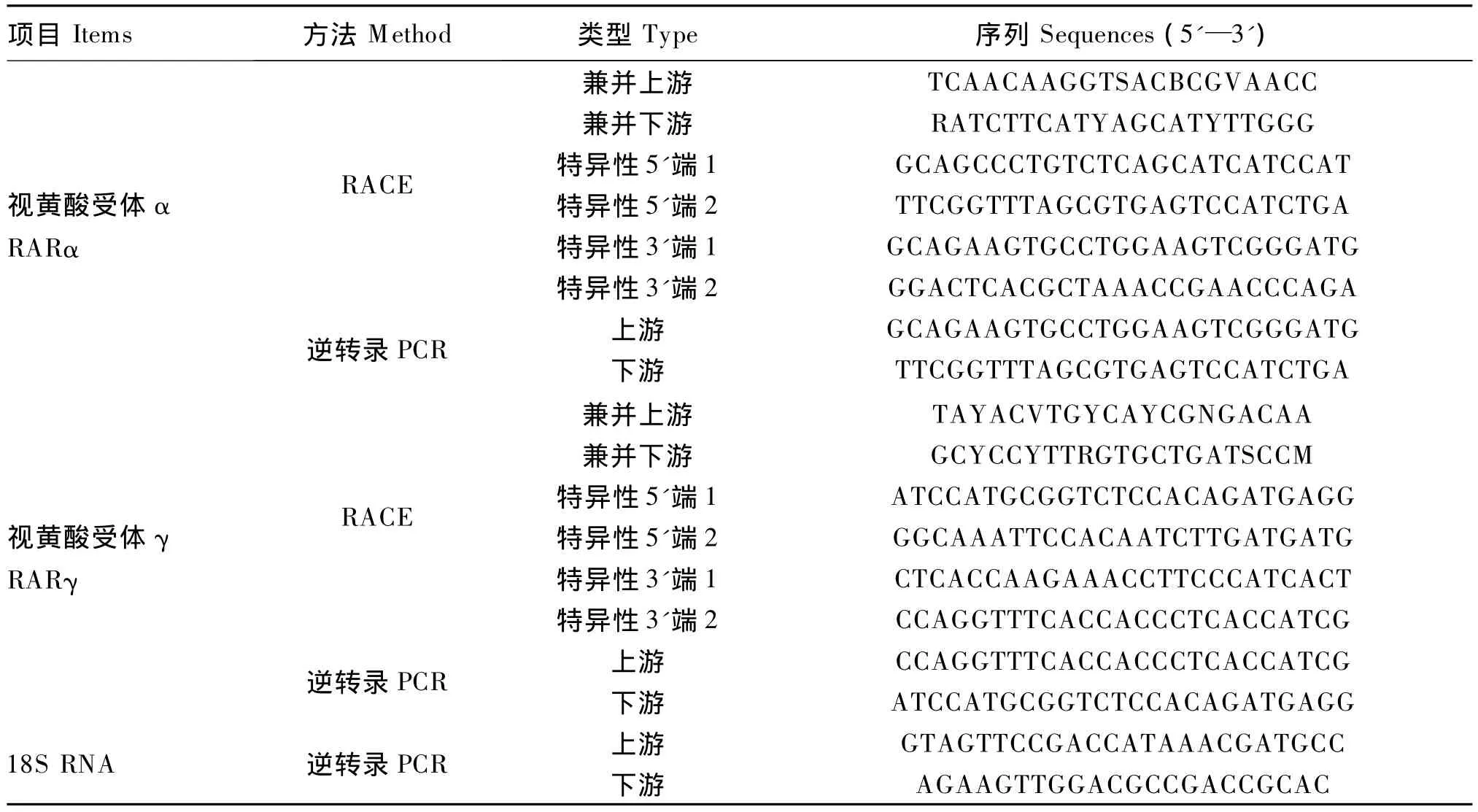
表1 PCR引物序列Table1 Primer sequences for PCRs
2 结果
2.1 RAR cDNA的克隆及序列分析
首先,利用RARα的兼并引物从鲈鱼肝脏cDNA中PCR得到749 bp的核心片段,再由RACE特异性引物5'端1和5'端2进行2轮RACE,得到5'RARα产物1 001 bp,与核心序列有489 bp的重叠区域。由RACE特异性引物3'端1和3'端2得到3'RACE产物1 112 bp,与核心序列有279 bp的重叠区域。拼接结果表明,RARα cDNA全长序列为2 094 bp,其中5'非翻译区(5'-untranslated region,5'-UTR)为 124 bp,3'非翻译区(3'-untranslated region,3'-UTR)为 608 bp,开放阅读框(open readingframe,ORF)为 1 362 bp,编码 453 个氨基酸(图1),分子质量为50.64 ku,理论等电点为8.20,GenBank登陆号为JN226572。氨基酸序列同源性分析发现,鲈鱼RARα与尼罗罗非鱼(Oreochromis niloticus)、红鳍东方鲀、斑马鱼和人的RARα的同源性分别为97.6%、96.9%、91.0%和83.5%。
同样,利用RARγ兼并引物克隆得到815 bp的RARγ核心片段,在得到的核心序列的基础上,设计5'端RACE和3'端RACE特异性引物分别进行2轮RACE,得到5'RACE产物和3'RACE产物分别为758和927 bp,与核心序列分别有369和437 bp的重叠。最后拼接获得RARγ cDNA全长序列共 1 671 bp,其中 5'-UTR 36 bp,3'-UTR 129 bp,ORF 1 506 bp,共编码 501 个氨基酸(图2),理论等电点为4.96,分子质量为56.20 ku,GenBank登陆号为 JU226571。分析表明,鲈鱼RARγ氨基酸序列与红鳍东方鲀、斑马鱼、大西洋鲑和人的同源性分别为95.2%、90.2%、89.9%和74.1%。

图1 鲈鱼RARα基因的全长cDNA序列及推导的氨基酸序列Fig.1 The full length cDNA and the deduced amino acid sequences of the RARα gene of Lateolabrax japonicus
2.2 RAR的结构与系统进化分析
用BioEdit软件将鲈鱼RARα和RARγ氨基酸序列和斑马鱼 RARα(NP_571481)、RARγ(CAM16092)以及人 RARα(NP_001019980)、RARγ(NP_001036193)的氨基酸序列进行比对分析。结果显示,鲈鱼RARα和RARγ的N端为保守性很低的A/B区,A/B区末端为非配体依赖的激活功能(ligand-independent transactivation function,AF-1)区结构。其次,鲈鱼RARα和RARγ均具有保守的DBD和LBD,DBD包括参与识别目标基因作用元件的P盒子(P box)结构和参与二聚体形成的D 盒子(D box)结构[16],经 ScanPros-ite预测,DBD含有2个锌指结构(图3)。鲈鱼RARα和RARγ的LBD均含有11个α螺旋(H1和H3~H12)和2个β转角结构,其H12的C端均含有配体依赖的激活功能(ligand-dependent transactivation function,AF-2)区,其序列分别为LIQETLEN和LIREMLEN。图4为用MEGA 4.0软件的NJ法构建的鲈鱼RARα、RARγ和其他物种的RAR氨基酸序列的系统树。结果显示,RARα、RARβ和RARγ 3种亚型分别成簇,鲈鱼的RARα和RARγ分别与红鳍东方鲀的 RARα和RARγ聚为一支,再与斑马鱼等其他鱼类的RARα和RARγ聚合,然后与哺乳类和两栖动物聚合。

图2 鲈鱼RARγ的全长cDNA序列及其推导的氨基酸序列Fig.2 The full length cDNA and the deduced amino acid sequences of the RARγ gene of Lateolabrax japonicus
2.3 RAR基因在各组织中的表达
从图5可见,RARα基因除在心脏和大脑中表达量较少外,其他组织中的表达量均较高,以眼、鳃和肠中的表达量最高,其次是肝脏、脾脏、脂肪和肾脏。RARγ基因仅在鳃和脾脏中有较高表达,其他组织检测到的表达量都较低。

图3 鲈鱼RARα和RARγ的氨基酸序列与斑马鱼和人的多重比对结果Fig.3 Multiple alignment of amino acid sequences of RARα and RARγ among Lateolabrax japonicus,Danio rerio and Homo sapiens
3 讨论
维生素A的多种生物学功能都是通过RAR和RXR 2种核受体起作用的[7]。人和小鼠RARα、RARβ和 RARγ分别由3种不同基因编码,由于不同的拼接方式或使用不同的启动子使得每个亚型又会产生多种不同的类群,同一亚型的不同类群在DBD和LBD的序列是完全相同的,差异主要在A/B区[17]。本研究分离到了鲈鱼RARα和RARγ 2种视黄酸受体基因,二者氨基酸序列同源性高达63.1%,但没有克隆到RARβ基因亚型,Hale等[15]对斑马鱼的研究中也没克隆到该亚型。
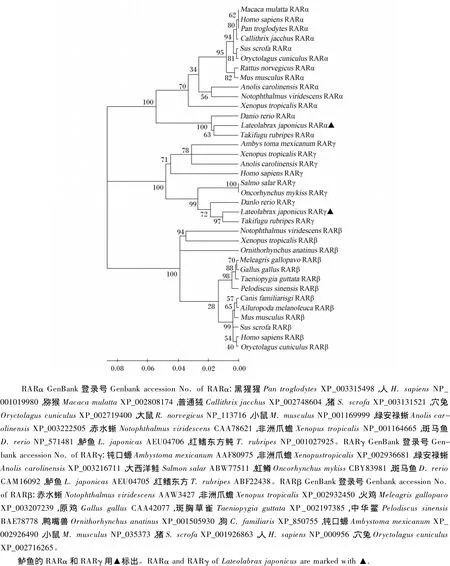
图4 鲈鱼和其他动物RAR的氨基酸序列构建的系统进化树Fig.4 Phylogenetic analysis of RARs based on amino acid sequence of Lateolabrax japonicus and other species
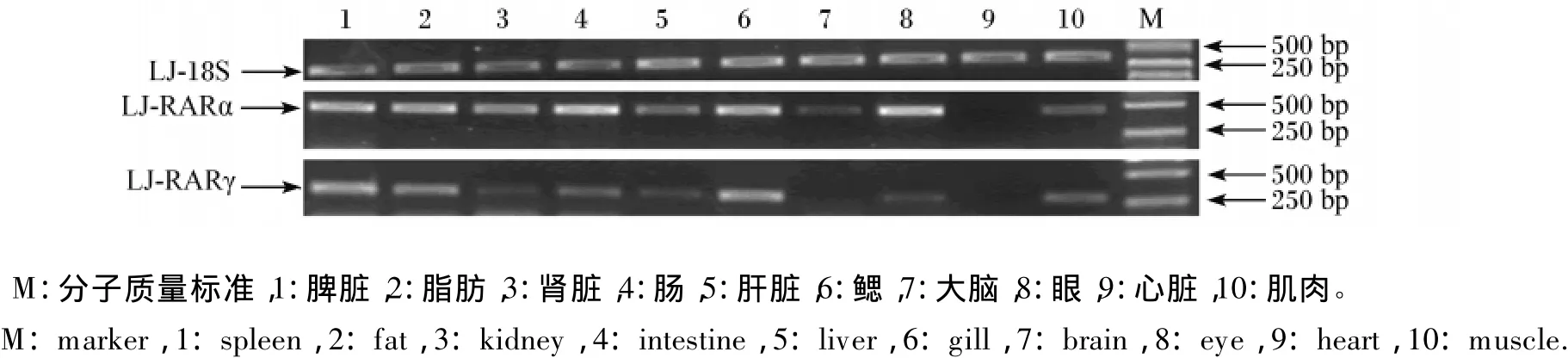
图5 鲈鱼RARα和RARγ基因在各组织中的表达Fig.5 Expressions of RARα and RARγ genes of Lateolabrax japonicus in various tissues
RAR的结构分析发现,鲈鱼的 RARα和RARγ包括保守性低的A/B区、非常保守的DBD和LBD、D区和C端的F区6个功能区。DBD非常保守,鲈鱼RARα的DBD共76个氨基酸,与斑马鱼、小鼠和人RARα的DBD的同源性高达97.3%、97.3%和94.7%。鲈鱼RARγ与斑马鱼、人和小鼠在DBD的同源性分别为100.0%,96.0%和93.7%。另外,鲈鱼RARα和RARγ的在DBD的同源性也高达92.1%。可见DBD作为最保守的功能区不仅在不同物种的同一亚型间同源性很高,且在不同亚型间也很保守。序列分析发现,鲈鱼DBD含有2个锌指结构(每个锌指结构中有4个不变的半胱氨酸)及P盒子和D盒子结构。多重比对分析发现,鲈鱼、斑马鱼和人的RARα和RARγ的P盒子序列完全相同,均为EGCKG,但鲈鱼和斑马鱼的D盒子在RARα和RARγ中分别是CHREKN和CHRDKN,而人的却都是CHRDKN。相比之下,LBD的保守性没有 DBD高,鲈鱼RARα的 LBD与斑马鱼、小鼠和人的 RARα的LBD的同源性分别为96.7%、90.2%和89.7%,鲈鱼RARγ与斑马鱼、小鼠和人的LBD的同源性分别为97.5%、97.1%和92.6%。鲈鱼RARα与RARγ在LBD同源性为82.0%。核受体超家族成员的LBD大多有12个α螺旋,而鲈鱼的RARα和RARγ与人的RARγ相似,其LBD都缺少H2结构[18]。另外,鲈鱼和其他动物一样,配体激活域AF-1和AF-2在RARα和RARγ中均只有1个氨基酸的差异,即AF-1的第3个氨基酸在RARα为P,而在 RARγ为 S,AF-2的第 3个氨基酸在RARα为Q,而在RARγ为R。作者还发现,与其他动物的AF-2第5个氨基酸都为M不同,鲈鱼的RARα为T,但这种差异对鲈鱼RARα的转录激活功能是否有影响还有待研究。与RARα和人的RARγ不同,鲈鱼和斑马鱼的RARγ在C末端延伸区(F区)都有不同数目的氨基酸序列多出,但是其功能尚不清楚。
鲈鱼2种RAR在肝脏、肌肉、心脏、眼、肠、肾脏、脂肪、脾脏、鳃和大脑等10个组织中均有表达,这种广泛的组织分布表明这些组织都可能存在RAR的目标基因。其中鲈鱼RARα基因在眼、肠、肝、脾、脂肪和肾等检测组织中都有明显的表达,以眼、鳃和肠中表达量最高,这点与哺乳动物的RARα广泛地分布于的大脑、皮肤、肌肉、心脏和肾脏等组织中的结果一致[19-20]。相比之下,RARγ基因在所检测组织中表达量均较低,仅在鳃和脾脏中有较高表达。鲈鱼RARα和RARγ基因在组织中这种表达特点与小鼠类似,在小鼠胚胎发育过程中RARα基因在大多数组织中都有表达,而RARγ基因的表达有一定的选择性[21]。虽然单个亚型的RAR缺陷小鼠都没有视力缺陷,但胎儿或出生后个体会出现维生素A缺乏症状,且RARα无效突变体小鼠出现生精上皮退化,最终导致雄性不育,而RARγ失活会导致个体骨骼和上皮缺陷,说明RARα和RARγ在不同的组织中可能有着不同的功能[22-23],所以RARα和RARγ在鲈鱼的各个组织中的功能差异及其在鲈鱼维生素A的信号传导过程中所起的作用还有待研究。
4 结论
①本试验成功克隆了RARα和RARγ的全长cDNA。
②鲈鱼RARα和RARγ有着典型的核受体结构,在各组织中广泛分布。
[1]CLAGETT-DAME M,DELUCA H F.The role of vitamin A inmammalian reproduction and embryonic development[J].Annual Review of Nutrition,2002,22:347-381.
[2]MOREN M,OPSTAD I,HAMRE K,et al.An optimum level of vitamin A supplements for Atlantic halibut(Hippoglossus hippoglossus L.)juveniles[J].Aquaculture,2004,235:587-599.
[3]HEMRE G I,DENG D F,WILSON R P,et al.Vitamin A metabolism and early biological responses in juvenile sunshine bass(Morone chrysops×M.saxatilis)fed graded levels of vitamin A[J].Aquaculture,2004,235:645-658.
[4]YANG Q H,ZHOU X Q,JIANG J,et al.Effect of dietary vitamin A deficiency on growth performance,feed utilization and immune responses of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Research,2008,39:902-906.
[5]DUESTER G.Retinoic acid synthesis and signaling during early organogenesis[J].Cell,2008,134(6):921-931.
[6]LIU R Z,SHARMA M K,SUN Q,et al.Retention of the duplicated cellular retinoic acid-binding protein 1 genes(crabp1a and crabp1b)in the zebrafish genome by subfunctionalization of tissue-specific expression[J].Federation of European Biochemical Societies,2005,272(14):3561-3571.
[7]ROCHETTE-EGLY C,GERMAIN P.Dynamic and combinatorial control of gene expression by nuclear retinoic acid receptors(RARs)[J].Nuclear Receptor Signaling,2009,7:e005.
[8]DELACROIX L,MOUTIER E,ALTOBELLI G,et al.Cell-specific interaction of retinoic acid receptors with target genes in mouse embryonic fibroblasts and embryonic stem cells[J].Molecular Cell Biology,2010,30:231-244.
[9]BASTIEN J,ROCHETTE-EGLY C.Nuclear retinoid receptors and the transcription of retinoid-target genes[J].Gene,2004,328:1-16.
[10]GERMAIN P,STAELS B,DACQUET C,et al.Overview of no menclature of nuclear receptors[J].Pharmacological Reviews,2006,58:685-704.
[11]KOIDE T,DOWNES M,CHANDRARATNA R A,et al.Active repression of RAR signaling is required for head formation[J].Genes & Development,2001,15:2111-2121.
[12]NAGASHIMA M,SAKURAI H,MAWATARI K,et al.Involvement of retinoic acid signaling in goldfish optic nerve regeneration[J].Neurochemistry International,2009,54:229-236.
[13]LINVILLE A,RADTKE K,WAXMAN J S,et al.Combinatorial roles for zebrafish retinoic acid receptors in the hindbrain,limbs and pharyngeal arches[J].Developmental Biology,2009,325:60-70.
[14]WENTWORTH J M,SCHOENFELD V,MEEK S,et al.Isolation and characterisation of the retinoic acid receptor-alpha gene in the Japanese pufferfish,F.rubripes[J].Gene,1999,236(2):315-323.
[15]HALE A,TALLAFUSS A,YAN Y L,et al.Characterization of the retinoic acid receptor genes raraa,rarab and rarg during zebrafish development[J].Gene Expression Patterns,2006,6(5):546-555.
[16]PERLMANN T,RANGARAJAN P N,UMESONO K,et al.Determinants for selective RAR and TR recognition of direct repeat HREs[J].Genes & Development,1993,7:1411-1422.
[17]CHAMBON P.A decade of molecular biology of retinoic acid receptors[J].Federation of American Societies for Experimental Biology,1996,10:940-954.
[18]RENAUD J P,ROCHEL N,RUFF M,et al.Crystal structure of the RAR-γ ligand-binding domain bound to all-trans retinoic acid[J].Nature,1995,378:681-689.
[19]MENG Q Y,CHEN X N,ZHAO J,et al.Distribution of retinoic acid receptor-α immunoreactivity in the human hypothalamus[J].Neuroscience,2011,174:132-142.
[20]DAY R M,LEE Y H,PARK A M,et al.Retinoic acid inhibits airway smooth muscle cell migration[J].A-merican Journal of Respiratory Cell and Molecular Biology,2006,34:695-703.
[21]DOLLE P,RUBERTE E,LEROY P,et al.Retinoic acid receptors and cellular retinoid binding proteins.Ⅰ.A systematic study of their differential pattern of transcription during mouse organogenesis[J].Development,1990,110:1133-1151.
[22]LUFKIN T,LOHNES D,MARK M,et al.High postnatal lethality and testis degeneration in retinoic acid receptor α mutant mice[J].Proceedings of the National Academy of Sciences,1993,90:7225-7229.
[23]CHAPELLIER B,MARK M,MESSADDEQ N,et al.Physiological and retinoid-induced proliferations of epidermis basal keratinocytes are differently controlled[J].The EMBO Journal,2002,21:3402-3413.

