一些抗氧化剂的抗/促氧化作用及其机制
陈 伟 林映才 马现永 蒋宗勇
(广东省农业科学院畜牧研究所,畜禽育种国家重点实验室,农业部华南动物营养与饲料重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广州 510640)
生理条件下机体的抗氧化与氧化系统处于动态平衡,而当在多种环境诱发条件下(如低氧和中毒),机体氧化与抗氧化平衡失调,从而诱导氧化应激的产生。目前研究已证实,氧化应激可诱发心血管等多种疾病,严重影响人类和动物健康。国内外学者在动物整体和细胞学水平上对氧化应激的诱导和效应方面开展了大量研究,在一定程度上揭示了氧化应激诱导相关疾病的机理。理论上,通过添加抗氧化剂等方式增加清除活性氧(reactive oxygen species,ROS)的能力或减少ROS的产生是发挥抗氧化作用的有效途径。但实践中盲目使用抗氧化剂不仅不能有效发挥机体抗氧化能力,反而可能使得氧化应激更加严重。本文就氧化应激中ROS的产生、作用途径、抗氧化剂的抗氧化及潜在的促氧化机制作一综述,为氧化应激研究提供更多信息,也为动物的健康、高效生产提供参考。
1 ROS的产生及其生理功能
1.1 ROS的产生
氧化还原反应是生命机体的重要生理生化反应,由自由基参与的氧化还原反应最为常见。自由基是指一类任何含有1个或多个不成对电子并能独立存在的物质,包括分子、原子、原子团或离子。由氧诱发的自由基称为ROS,ROS是含氧且有高度化学活性的几种分子的总称,主要包括超氧阴离子(·)、羟自由基(·OH)、H2O2、单线态氧(1O2)以及脂质过氧化物的中间产物烷氧自由基(LO·)等,这些不成对的电子使ROS具有不稳定性和高反应活性,其中·OH是化学性质最活泼的一种ROS分子,它几乎能和所有的生物大分子发生反应,并有非常高的速率常数。ROS的产生有2个重要来源[1]:1)通过线粒体中呼吸链的电子传递而生成;2)由细胞质中还原型辅酶Ⅱ(NADPH)氧化酶(Nox)和黄嘌呤氧化酶参与O2的催化生成H2O2。
1.2 ROS的生理功能
ROS在动物体内是正常的代谢产物,其生理功能具有积极意义的一面。正常生理条件下生成的微量ROS对维持细胞的正常功能(包括信号传导和转录调控)具有十分重要的作用。但机体中过量的ROS会造成细胞损伤,并引发细胞凋亡和坏死。因而,机体中ROS的生理学功能取决于其浓度的高低(即自由基产生和清除的平衡性)。
1.2.1 ROS与氧化损伤
ROS攻击不饱和脂肪酸,促使其氧化或过氧化,生成脂质过氧化物,并降解成丙二醛。生物膜中富含不饱和脂肪酸,对维持膜的流动性和生物膜的众多功能发挥着极其重要的作用。当细胞膜中的不饱和脂肪酸受到ROS的攻击后,含量迅速减少,导致膜的流动性降低,并最终影响膜的生物学功能(包括膜通透性、膜受体、膜蛋白酶和离子通道的活性改变)。此外,ROS可引发细胞内蛋白氧化(主要发生在对自由基敏感的半胱氨酸或蛋氨酸残基位点上),线粒体损伤,并诱发DNA结构破坏,促使端粒变短,激活细胞凋亡信号,最终影响细胞寿命。
1.2.2 ROS作为细胞内代谢调节的分子信号
虽然ROS的产生会引起细胞脂质氧化、蛋白变性以及DNA损伤等负面影响,但ROS也是细胞内的重要信号传递分子。研究证实,ROS抑制细胞增殖,激活或抑制细胞凋亡,并在高浓度条件下促发细胞坏死[1],对细胞的生命代谢具有重要意义。由于ROS分子结构较小,并能短距离扩散,ROS在很多途径上发挥了信号分子的作用。较早研究报道,H2O2可促进多个转录因子的表达,包括 c-fox[2]、c-myc[2]、c-jun[3]和 egr-1[4]。此后更多研究证实·和H2O2是广泛参与转录激活调节的重要信号调节分子,在各种细胞影响因子的作用下都能发生作用(图1),Jak/Stat信号是主要的多个转录控制系统[5]。细胞质膜中由Nox和组成型NADPH氧化酶(CNOX)产生的·和H2O2作为信号分子,激活 Jak-Stat系统[6-7],参与细胞内相关信号通路[包括核因子-κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)信号通路]的调控。胞内细胞ROS与抗氧化酶协同作用,共同参与氧化还原反应,并通过cAMP介导的信号路径打开或关闭一些酶活性[8]。
高等动物机体中神经细胞内需要维持较高的ROS水平才能发挥正常生理功能,且能对ROS浓度的变化能作出较敏感的反应。最新的研究发现,ROS可通过PI3K/Akt信号通过增强脑组织来源的神经细胞的自我更新和修复[9],暗示着ROS在神经细胞中发挥的第二信使作用。研究发现,ROS可增强体内胰岛素信号的敏感性[10]。这表明,ROS可能作为细胞内生命代谢的介导物,并作为一种信号分子从细胞外环境到细胞进行传递。
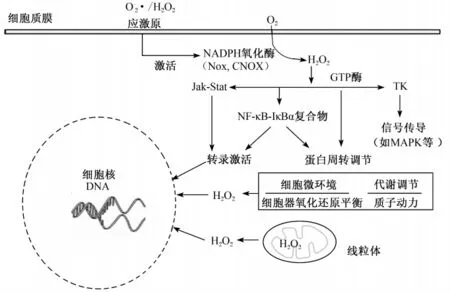
图1 ·和H2O2对基因表达和细胞代谢的氧化还原调节Fig.1 The role of superoxide anion/hydroxyl superoxide in the redox regulation of gene expression and cellular metabolism[11]
1.3 动物体内ROS清除机制
虽然机体中在生理或病理条件下不可避免地产生ROS,但生命体在演化过程中建立了较完善的ROS清除的生理机制,从而使得机体中ROS含量维持在相对稳定的浓度。机体中存在着大量的生物活性酶(酶促系统),可将ROS转化为活性较低的分子,并能阻止这些活性物质转变为危害性更强的物质转变,进而减少对细胞的氧化损伤。此外,抗氧化类物质对ROS的清除作用是降低促氧化效应的另一重要途径,包括金属结合蛋白(铁和铜)、谷胱甘肽、尿酸、胆红素、维生素C和维生素E等。
1.3.1 酶促系统
细胞内抗氧化酶主要包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT),他们协同完成细胞内抗氧化作用。SOD是一种含金属的酶,可分为2类:位于线粒体中的Mn-SOD和位于胞浆的Cu/Zn-SOD。SOD可歧化·形成 H2O2(· +2H+→H2O2+O2),消除·对机体的毒性作用。在还原型谷胱甘肽(GSH)作为电子受体条件下,GSH-Px可催化有机过氧化氢(ROOH)和 H2O2,生成醇和H2O。含有金属铁的CAT与GSH-Px共同完成细胞内 H2O2的分解CAT存在于红细胞及组织细胞内微体,主要生理作用是催化 H2O2转变为 H2O和 O2。相比GSH-Px,CAT更能有效清除高浓度的 H2O2,而GSH-Px对低剂量的H2O2清除更为有效。除上述酶系统之外,细胞中其他酶促系统对维持氧化平衡也起到十分重要的作用,包括硫氧还酶(thioredoxin,TRX)、谷氧还蛋白、过氧化还原蛋白(peroxiredoxin,Prx1)等。
1.3.2 非酶促系统
细胞中存在许多抗氧化的非酶促系统,包括GSH、尿酸、胆红素和辅酶Q等。根据溶解性质可分为2类:一类为水溶性抗氧化剂,如维生素C、谷胱甘肽、半胱氨酸、白蛋白、金属结合蛋白等,另一类为脂溶性抗氧化剂,如维生素E、类胡萝卜素(或维生素A)、胆红素等。该类物质大多能提供电子使自由基还原,参与抗氧化作用。如维生素E能还原·、1O2、过氧化脂质自由基等;维生素C具有相同作用且能协助维生素E维持其还原状态。胞浆中的GSH与NADPH在某些酶如GSH-Px、CAT等协同作用下,还原 H2O2、过氧化脂质、二硫化物等。
2 氧化应激的诱导
3 抗氧化研究
3.1 营养限制与抗氧化
多年来国内外学者关于氧化应激的机制在多个方面做了深入研究。从代谢角度而言,细胞代谢率增加时可提高ROS的产生,引起细胞损伤,进而影响到细胞生命周期。人类医学发现,能量限制(caloric restriction,CR)可提高啮齿类动物的寿命达到50%,人的饮食CR可提高平均寿命[16],很可能与降低细胞代谢速率和氧化应激有关[17]。能量限制一方面降低ROS的产生,另一方面还可能提高了抗氧化酶的表达[18],从而成为缓解氧化应激的有效潜在营养手段。尽管能量限制能有效抑制ROS的生成,但在人类医学或动物实际生产应用中因为多种因素其应用仍不现实。越来越多的证据表明,天然植物中存在着众多抗氧化物质(如维生素A、维生素 C、维生素 E、α-硫辛酸、异黄酮),对机体中ROS的清除及抗氧化功能具有十分重要的贡献。
3.2 抗氧化剂的抗氧化作用与潜在的促氧化效应
3.2.1 维生素A和β-胡萝卜素
维生素A族维生素是属于全反式视黄醇的一组有活性的β-紫香酮衍生物,包括视黄醇、视黄醛、视黄酸类。β-胡萝卜素是维生素A原,是体内重要的脂溶性抗氧化营养素,它可以保护脂膜免受过氧化损伤,其主要功能是清除生理损伤产生的大量自由基或ROS。由于已知维生素A抑制脂质过氧化的作用不是清除引发脂质过氧化的自由基,而是作为阻断反应链的抗氧化剂,与有机过氧化自由基结合。视黄醇、视黄醛、视黄酰酯与视黄酸均能在生物体系中抑制脂质过氧化[19]。因而,维生素A和β-胡萝卜素是重要的抗氧化物质。
细胞中缺乏维生素A增加ROS的产生,诱发线粒体膜通透性转变和细胞色素c的释放,暗示着维生素A在细胞中的抗氧化作用[20]。大鼠试验证实,与维生素A缺乏组相比,补充维生素A可上调大鼠血清的GSH-Px水平,并抑制脂质过氧化[21]。相似的体外和体内试验都证实了β-胡萝卜素的抗氧化作用[22-24]。维生素A和β-胡萝卜素发挥抗氧化的主要机制是通过电子转移、脱氢反应和加合反应3种途径而进行。
与其低剂量下的抗氧化作用相反的是,大剂量的维生素A可能引发促氧化反应[25]。研究报道,当大剂量补充维生素A时可导致大鼠脂质过氧化[26]。研究报道,高剂量的β-胡萝卜素可促进白血细胞(HL-60)中ROS的产生[27],表明高剂量的β-胡萝卜素是细胞中潜在的ROS诱导剂。高浓度β-胡萝卜素造成促氧化的机理可能是:由于β-胡萝卜素结构中大量的共轭双键使得β-胡萝卜素更易受到自由基的攻击[28],从而加快β-胡萝卜素代谢产物的自氧化过程[29],进而减弱β-胡萝卜素的抗氧化能力,同时诱导促氧化效应的发生。此外,β-胡萝卜素的抗氧化与促氧化的二重性效应可能与氧分压有关。当处于低分压状态下,β-胡萝卜素与过氧自由基(ROO-)反应转化成β-胡萝卜素自由基(CAR-),后者与另一个ROO-继续反应:CAR+ROO-→CAR-ROO,从而以1分子β-胡萝卜素清除2个ROO-,阻断脂质过氧化链式反应。但在高氧分压状态下,β-胡萝卜素与ROO-反应生成β-胡萝卜素过氧化自由基(CAR-OO-),后者可与不饱和脂肪酸(LH)发生反应:CAR→CAR-OO-+LH→CAR+LOOH,从而诱导脂质发生过氧化扩增反应[30-33]。可见,β-胡萝卜素发挥抗氧化与氧化作用与其作用的环境有关。
3.2.2 维生素E
维生素E是苯并二氢呋喃的衍生物,具有β-色酮环和1个侧链。根据侧链结构的不同分为生育酚和生育三烯醇,而根据其甲基在色酮环上的位置不同则分为α、β、γ、δ 4种,共8种异构体,其中以α-生育酚活性最强。维生素E可作为氧自由基和单线氧的清扫剂,因而是机体抗氧化系统中非酶促反应体系的重要组成成分。在铅、乙醇诱发的肝、肾损伤动物模型中,维生素E可通过清除活性自由基起到明显保护作用[34]。此外,试验还表明维生素E可抑制细胞的脂质氧化[35],减少细胞中H2O2诱导的 DNA损伤[36]。维生素 E清除脂质过氧化自由基作用可能通过以下机制完成:1)维生素E的断链反应,即维生素E打断脂质过氧化链式反应,清除高反应性脂质过氧化物和烷氧自由基;2)抑制核酸内切酶的活化,该酶可被细胞内的氧化应激触发;3)促进受损DNA的清除[37]。
人类医学研究发现,在吸烟者摄入的含高不饱和脂肪酸的饮食中,添加维生素E可提高受试者血清中的同型F2-前列腺素水平,表明添加维生素E可促进脂类氧化[38]。动物试验表明,饲料中添加高剂量的维生素E(10 000 mg/kg)引起大鼠红细胞中抗氧化酶(SOD、CAT等)活性下降且红细胞中谷胱甘肽浓度也下降[39];而另一小鼠试验发现,当接受饲粮添加(600 mg/kg)的维生素E达6周可诱导脂质过氧化,同时降低了血浆中SOD活性和GSH-Px活性[40]。体外细胞试验也证实,在Cu2+诱导的低密度脂蛋白(LDL)氧化过程中,维生素E的水溶性同类物trolox的添加可起到抗氧化作用,但随着添加时间的延长,trolox却发生促氧化作用[41]。维生素E的高剂量不仅参与了促氧化作用,而且有可能造成患者死亡的危险[42]。
以上研究证实了维生素E在机体中的抗氧化和促氧化的双重生物学效应。目前,关于维生素E对促氧化机制研究报道较少,但相关研究发现高剂量维生素E下调了抗氧化酶的活性,因而维生素E的促氧化作用可能与抗氧化酶的调节有关。新的研究表明,维生素E抑制了蛋白激酶C和二酰基甘油激酶[43],而蛋白激酶C可上调Mn-SOD蛋白[44]。因而,维生素E可通过信号通路下调抗氧化酶的活性,降低抗氧化防御进而促进了抗氧化。
3.2.3 维生素C
维生素C是含有1个共轭双键的己糖醛酸内酯。由于维生素C可以从双键中提供2个电子作为电子供体,从而发挥清扫自由基的作用。维生素C能缓解许多ROS和硝基自由离子的负面作用,在防止或减少由于氧自由基和硝基自由基所导致的疾病(如动脉粥样硬化)治疗中发挥重要的抗氧化效应。国内外关于其抗氧化的效应及可能的机制已做了大量研究,详见 Padayatty等[45]的综述。
尽管低剂量的维生素C发挥抗氧化作用,而在高剂量条件下维生素C则表现为促氧化。在0.1、0.25 mmol/L维生素C剂量下,能明显降低H2O2所诱导HeLa细胞的DNA氧化性损伤,而过量的维生素C对H2O2诱导的DNA损伤具有明显的增强作用[46]。动物试验也发现,对豚鼠静脉大剂量注射维生素 C可促使脂类的过氧化[47]。人类医学研究显示,妊娠妇女摄入量为14 mg/d的铁离子和500 mg/d维生素C后,也发现血浆中硫代巴比妥酸反应物水平上升[48]。此后,维生素C的促氧化作用也在临床医学研究中被陆续报道,包括损伤后恢复期患者[49]、血液透析病人[50]及缺氧症[51]。在健康人接受高剂量注射维生素C也可导致促氧化的发生。肌肉损伤运动员每千克体重注射12.5 mg维生素 C引起脂类过氧化[52]。对健康人静脉注射高剂量的螯合维生素C(5 g/d)可引发短期自由基的产生,并导致DNA氧化损伤[53]。一个重要的体外细胞试验发现,在存在有血清的情况下,浓度为5 mmol/L时维生素C可诱导产生高浓度的H2O2并选择性杀死各种癌细胞系,而此高浓度下的H2O2对其他正常细胞没有产生影响[50]。但难以解释的是,为什么H2O2对癌细胞系的杀伤作用是选择性的。
以上体内体外试验表明,适宜剂量的维生素C在机体中发挥抗氧化作用,但高剂量的维生素C则表现为促氧化。其促氧化作用可能与维生素C对抗氧化酶的抑制有关。研究发现,人体中高剂量注射维生素C降低了红细胞中抗氧化的GSH-Px和SOD活性,血液中还原型谷胱甘肽/氧化型谷胱甘肽比(GSH/GSSG)也显著下降[53]。但维生素C对抗氧化酶活性抑制的可能机制尚不清楚。此外,维生素C的促氧化作用可能是由于维生素C分解产物的作用。崔乃杰等[54]研究发现,维生素C的促氧化作用可能是由于自身在存放期被空气氧化,提供一个电子后形成去氢抗坏血酸负离子自由基(AH-+R·→A-·+RH)。维生素C除了可以直接清除·OH外,同时又产生A-(H2A→H++HA-,HA-+·OH→A-+H2O)。维生素C在有氧情况下通过自氧化反应产生去氢抗坏血酸负离子自由基(A-)、·和H2O2(H2A→H++HA-,HA-+O2→A-+H++·+2H+→H2O2+O2),从而诱发一系列自由基连锁反应,造成机体氧化损伤。在中性金属离子的存在下,维生素C可将Fe3+还原形成Fe2+,且还原 Cu2+形成 Cu+,并诱导 Fenton反应[55],从而引发自由基链反应。另据报道,维生素C可以夺走铁结合蛋白的铁离子,最终诱导氧化应激[56]。由此可见,与其在低剂量下抗氧化作用相反的是,在高剂量的维生素C可通过多种途径表现出促氧化作用。
3.2.4 异黄酮
异黄酮是天然存在于各种植物中(如大豆)的黄酮类化合物中的一类。异黄酮具有活性羟基,能够有效清除自由基,螯合金属离子(Fe2+、Cu2+),与重金属形成复合物,从而降低重金属的毒性[57]。由于异黄酮能减少自由基形成和清除自由基的抗氧化活性[58-59],在畜禽生产及食品加工业,异黄酮作为猪、鸡等动物的抗氧化剂,并能起到改善肉质,延长肉品货架期[60-61]。异黄酮发挥抗氧化作用的可能机制是:1)提高抗氧化酶促反应体系的作用[62];2)通过提供氢原子和氧自由基结合[63],从而减少自由基的产生;3)螯合金属铁离子,降低金属铁诱导的过氧化反应[64]。
但近年来的相关研究发现,异黄酮在低浓度条件下发挥抗氧化作用,在高浓度条件下却表现促氧化作用,导致DNA损伤,细胞死亡率提高[65-66]。相似的研究报道,在细胞培养基中加入高剂量的异黄酮,H2O2的含量明显增加[67],表明高剂量的异黄酮具有促氧化作用。许宗运[68]报道,在油脂中添加异黄酮,剂量较低时防止油脂氧化,但是当添加剂量超过一定限量,在添加初期就发生助油脂氧化现象。朱宇旌等[69]在猪油中添加苜蓿异黄酮,发现在较低剂量添加范围(0.02%~0.2%)内,异黄酮对猪油的抗氧化效果随添加量的增大而增大,但在较高剂量添加范围(0.2% ~1%)内,异黄酮的抗氧化效果却随着添加量的增高而降低。程忠刚等[70]报道,猪饲料中添加10~20 mg/kg异黄酮能提高机体抗氧化能力,但随着剂量的进一步添加,机体GSH-Px与SOD活性下降,机体抗氧化能力也呈下降趋势。细胞培养试验亦证实异黄酮在一定条件下表现促氧化效应。Lu等[71]发现,在高浓度条件下,黄酮化合物能够损伤人的红细胞膜蛋白构象,造成细胞严重损伤。肠内皮细胞培养试验研究发现,低浓度异黄酮具有较强的抗氧化作用,但是当异黄酮浓度超过1 mmol/L,不具有抗氧化作用甚至表现促氧化特性[72]。另有研究表明,高剂量的黄酮在红细胞内能够产生自由基,降低维生素C、还原型辅酶Ⅰ以及血红蛋白含量[73]。
目前关于高剂量异黄酮促氧化机制的研究报道尚不多,但初步的研究表明异黄酮的的促氧化机制可能与抗氧化酶系统的下调有关。由于高剂量的异黄酮能显著降低含巯基的酶的活性[74],因而可能影响到γ-谷氨酰半胱氨酸合成酶(γ-GCSyn,合成GSH的限速酶)活性,进而降低了GSH在机体中的生成。研究发现,高剂量的异黄酮促进大鼠体内GSH转化为GSSG,显著降低了GSH/GSSG值,并降低了与其代谢相关物质(如金属硫蛋白和GSH依赖性酶)的活性[75]。此外,异黄酮由于可氧化生成H2O2[76],而 H2O2通过氧化半胱氨酸残基抑制酪氨酸磷酸化,从而一次激活酪氨酸激酶(如MAPK)及其下游区域的信号通路[77]。
3.2.5 α-硫辛酸
α-硫辛酸是一种含有二硫键的辛酸衍生物,是线粒体中脱氢酶的含硫辅酶,参与三磷酸腺苷形成过程中的脱氢反应。α-硫辛酸及其主要还原形式——二氢硫辛酸(DHLA),都属于含巯基化合物,可以清扫氧自由基,与其他抗氧化剂发生还原反应,并抑制脂质过氧化。α-硫辛酸可通过4个方面发挥抗氧化作用:金属螯合能力、清除ROS、再生内源性抗氧化剂和修复氧化损伤,可与Mn2+、Cu2+、Zn2+、Cd2+、Pb2+等形成复合物,并能与维生素C竞争结合Fe,阻止维生素C将Fe3+还原为Fe2+,参与脂质过氧化损伤的保护作用。此外,α-硫辛酸可直接清除 ROS,如:·OH、H2O2、1O2、过氧化亚硝基(·ONOO)和次氯酸等,也可作为氧化还原反应链中的阻断剂参与抗氧化[78]。
同前述抗氧化物质一样,硫辛酸也对机体或细胞表现出抗氧化或促氧化的双重效应。α-硫辛酸在清除ROS过程中,可产生比原来ROS氧化能力更强的氧化中间产物如含巯自由基(HSRS·),导致蛋白质氧化损伤,从而表现出促氧化效应。研究发现,二氢硫辛酸通过增加线粒体或线粒体亚结构中·的产生而提高线粒体通透性[78-79]。研究进而表明,二氢硫辛酸可诱导肝脏中线粒体膜通透性发生转化,而该效应可受到2,6-二叔丁基对甲酚(自由基清扫剂)的抑制[80]。这暗示着二氢硫辛酸可能通过诱导 ROS的生成或抑制线粒体抗氧化能力诱发促氧化效应。但,α-硫辛酸的抗氧化或促氧化作用与动物的生理代谢状态有关。糖尿病模型小鼠口服α-硫辛酸(每千克体重30 mg)通过降低NADPH诱导的生成从而对肾脏发挥抗氧化作用,但对于健康小鼠却表现出促进NADPH诱导的·生成,即促氧化作用[81]。目前关于α-硫辛酸的促氧化机理还不十分清楚,但相关研究暗示其促氧化的可能机制是与DHLA氧化形成巯基自由基或二硫键自由基团,并通过自氧化而产生[82]。
4 小结
总之,抗氧化剂可通过螯合或清扫已存在的ROS,或抑制ROS的产生,从而发挥抗氧化作用。但由于抗氧化剂的抗氧化及促氧化的双重效应,目前在人类医学上还没有足够的证据表明,注射抗氧化剂(如维生素C、维生素E和β-胡萝卜素等)能有效改善或防止氧化损伤等所引发的人类疾病[11,83]。此外,已被证明有抗氧化和促氧化双重性质的物质还包括芦荟提取物[84]、绿茶酚[85]、槲皮素等。由此可见,绝大多数具有抗氧化作用的物质在其浓度或动物生理条件发生改变条件下也会表现出抗氧化→促氧化转变的特点。
生理条件下生成的微量ROS,是细胞生命中分子信号传导的重要信使。正常生理条件下细胞中低剂量的ROS处于平衡状态,并对维持细胞稳态和生理功能起着十分重要的作用。当通过基因敲除等多种方式诱发自由基清除功能的缺失或增加自由基的产生提高ROS的净生成,都会对动物和细胞造成健康损伤甚至引发死亡[86]。反之,当在生理条件下添加抗氧化剂过度清除ROS,而导致氧化还原失衡,也可诱发细胞信号紊乱,触发机体中自我代偿性的促氧化系统的启动。即使在动物发生氧化应激条件下补充抗氧化剂,也需考虑剂量效应。有研究表明,大剂量补充抗氧化剂易导致患者死亡[87]。由上可知,无论正常生理条件还是病理条件下大剂量补充抗氧化剂对机体是有害的,非氧化应激条件下抗氧化剂的补充也存在着促氧化的潜在可能。因而,无论在医学或动物生产中,明确试验对象的生理状态,以及确定适宜的剂量对抗氧化剂的抗氧化效应的发挥至为关键。
关于抗氧化剂的促氧化机理研究目前仍处于探索阶段。大多抗氧化剂在清除自由基同时自身产生活性更强的不对称电子自由基,从而诱发氧化反应。但几乎所有抗氧化剂的促氧化作用都表现为下调抗氧化系统(酶促或非酶促),这暗示着这些抗氧化剂可能通过影响自由基的清除功能,从而表现出促氧化作用。但目前尚不能回答的问题是,是否这些抗氧化物质都通过同一途径启动抗氧化系统的抑制作用?虽然动物遭受外来环境或病理等应激所诱发的促氧化研究已经引起研究者们的广泛关注,但对于外源抗氧化剂的促氧化转变尚未得到足够的重视,这对未来深入认识氧化应激及抗氧化研究具有重要的意义。
[1]THANNICKAL V J,FANBURG B L.Reactive oxygen species in cell signaling pathway[J].American Journal of Physilogy-Lung Cellular and Molecular Physiology,2000,279:1005-1028.
[2]CRAWFORD D,AMSTAD P,ZBINDEN I,et al.Oxidant stress induces the proto-oncogenes c-fos and cmyc in mouse epidermal cells[J].Oncogene,1988,3:27-32.
[3]DEVARY Y,GOTTIEB R A,LAU L F,et al.Rapid and preferential activation of the c-jun gene during the mammalian UV response[J].Molecular Cellular Biology,1991,11:2804-2811.
[4]NOSE K,SHIBANUMA M,KIKUCHI K,et al.Transcriptional activation of early-response genes by hydrogen peroxide in a mouse osteoblastic cell line[J].European Journal Biochemistry,1991,201:99-106.
[5]DARNELL J E Jr.Studies of IFN-induced transcriptional activation uncover the Jak-Stat pathway[J].Journal of Interferon Cytokine Research,1998,18:549-554.
[6]SCHIEFFER B,LUCHTEFELD M,BRAUN S,et al.Role of NAD(P)H oxidase in angiotensinⅡ-induced JAK/STAT signaling and cytokine induction[J].Circulation Research,2000,87:1195-2001.
[7]GROTE M,LUCHTEFELD M,SCHIEFFER B.JANUS under stress-role of JAK/STAT signaling pathway in vascular diseases[J].Vascular Pharmacology,2005,43:357-363.
[8]HOU Y C,JANCZUK A,WANG P G.Current trends in the development of nitric oxide donors[J].Current Pharmaceutical Design,1999,5(6):417-471.
[9]LE BELLE J E,OROZCO N M,PAUCAR A A,et al.Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner[J].Cell Stem Cell,2011,8(1):59-71.
[10]LOH K,DENG H,FUKUSHIMA A,et al.Reactive oxygen species enhance insulin sensitivity[J].Cell Metabolism,2009,10:260-272.
[11]LINNANE A W,KIOS M,VITETTA L.Coenzyme Q10-Its role as a prooxidant in the formation of superoxide anion/hydrogen peroxide and the regulation of the metabolome[J].Mitochondrion,2007,7:51-61.
[12]ST-PIERRE J,BUCKINGHAM J,ROEBUCK S J,et al.Topology of superoxide production from different sites in the mitochondrial electron transport chain[J].The Journal of Biological Chemistry,2002,277:44784-44790.
[13]NOHL H,GILLE L,STANIE K.Intracellular generation of reactive oxygen species by mitochondria[J].Biochemical Pharmacology,2005,69:719-723.
[14]CHANCE B,SIES H,BOVERIS A.Hydroperoxide metabolism in mammalian organs[J].Physiological Reviews,1979,59:527-605.
[15]胡文琴,王恬,孟庆利.动物中活性氧的产生及清除机制[J].家畜生态,2004,25(3):64-67.
[16]WILLCOX D C,WILLCOX B J,TODORIKI H,et al.Caloric restriction and human longevity:what can we learn from the Okinawans?[J].Biogerontology,2006,7:173-177.
[17]REDMAN L M,HEIBRONN L K,MARTIN C K,et al.Metabolic and behavioral compensations in response to caloric restriction:implications for the maintenance of weight loss[J].PLoS One,2009,4(2):1-9.
[18]STREEKUMAR R,UNNIKRISHNAN J,FU A,et al.Effects of caloric restriction on mitochondrial function and gene transcripts in rat muscle[J].American Jour-nal ofPhysiology-Endocrinology and Metabolism,2002,283(1):38-43.
[19]彦怀城,刘同华.A族维生素的抗氧化和促氧化作用[J].中国药业,2006,15(20):3-5.
[20]CHIU H J,FISCHMAN D A,HAMMERLING U.Vitamin A depletion causes oxidative stress,mitochondrial dysfunction,and PARP-1-dependent energy deprivation[J].The Journal of the Federation of American Societies for Experimental Biology,2008,22:3878-3887.
[21]韩磊,马爱国,张燕.维生素A干预对大鼠抗氧化能力及细胞膜流动性影响的研究[J].卫生研究,2004,33(4):450-452.
[22]KHOPDE S M,PRIYADSINI K I,MUKHERJEE T,et al.Does β-carotene protect memebrane lipids from nitrogen dioxide[J].Free Radical Biology & Medicine,1998,25(1):66-71.
[23]KLEINJANS J C,VAN HERWIJNEN M H,VAN MAANEN J M,et al.In vitro investigations into the interaction of beta-carotene with DNA:evidence for the role of carbon-centered free radicals[J].Carcinogenesis,2004,25(7):1249-1256.
[24]沈莉,王胜,谢芳,等.β-胡萝卜素对心肌细胞缺氧损伤的保护作用的研究[J].营养学报,2001,23(2):164-166.
[25]ZHANG P,OMAYE S T.DNA strand breakage and oxygen tension:effect of β-carotene,α-tocopherol and ascorbic acid[J].Food Chemical Toxicology,2001,39:239-346.
[26]任国峰,黄忆明,刘富强.维生素A对妊期大鼠脂质过氧化及抗氧化系统的影响[J].实用预防医学,2001,8(3):173-175.
[27]PALOZZA P,SERINI S,TORSELLO A,et al.Regulation of cell cycle progression and apoptosis by β-carotene in undifferentiated and differentiated HL-60 leukemia cells:possible involvement of a redox mechanism[J].International Journal of Cancer,2002,97:593-600.
[28]PALOZZA P,SERINI S,DI NICUOLO F,et al.Prooxidant effects of β-carotene in cultured cells[J].Molecular Aspects of Medicine,2003,24:353-362.
[29]MURATA M,KAWANISHI S.Oxidative DNA damage by vitamin A and its derivative via superoxide generation[J].Journal of Biological Chemistry,2000,275:2003-2008.
[30]BURTON G W,INGOLD K U.beta-Carotene:an unusual type of lipid antioxidant[J].Science,1984,224(4649):569-573.
[31]TRUSCOTT T G.β-carotene and disease:a suggested pro-oxidant and anti-oxidant mechanism and speculations concerning its role in cigarette smoking[J].Journal of Photochemistry and Photobiology B:Biology,1996,35:233-235.
[32]EDGE R,MCGARVEY D J,TRUSSCOTT T G.The carotenoids as antioxidants-a review[J].Journal of Photochemistry and Photobiology B:Biology,1997,41:189-200.
[33]宋雁.类胡萝卜素抗氧化和促氧化作用的影响因素[J].卫生研究,2003,32(4):417-419.
[34]JURCZUK M,BRZOSKA M M,MONIUSZKO-JAKOIUK J.Hepatic and renal concentrations of vitamins E and Cin lead-and ethanol-exposed rats.An assessment of their involvement in the mechanisms of peroxidative damage[J].Food and Chemical Toxicology,2007,45(8):1478-1486.
[35]WAGNER B A,BUETTNER G R,BURNS C P.Vitamin E slows the rate of free radical-mediated lipid peroxidation in cells[J].Archives of Biochemistry and Biophysics,1996,334(2):261-267.
[36]BRENNAN L A,MORRIS G M,WASSON G R,et al.The effects of vitamin C or vitamin E supplementation on basal and H2O2-induced DNA damage in human lymphocytes[J].British Journal of Nutrition,2000,84(2):195-202.
[37]汪求真,马爱国.维生素E对氧化应激及相关慢性病的影响[J].国外医学:卫生学分册,2008,35(6):364-370.
[38]WEINBERG R B,VANDERWERKEN B S,ANDERSON R A,et al.Pro-oxidant effect of vitamin E in cigarette smokers consuming a high polyunsaturated fat diet[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2001,21:1029-1033.
[39]EDER K K,FLAKER D,HIRCHE F,et al.Excess dietary vitamin E lowers the activation of antioxidative enzymes in erythrocytes of rats fed salmon oil[J].The Journal of Nutrition,2002,132(11):3400-3404.
[40]HAJIANI M,GOLESTANIO A,SHRIFTABRIZI A,et al.Dose-dependent modulation of systemic lipid peroxidation and activity of anti-oxidant enzymes by vitamin E in the rat[J].Redox Report,2008,13(2):60-66.
[41]ALBERTINI R,ABUJAP.Prooxidant and antioxidant properties of trolox C,analogue of vitamin E,in oxi-dation of low-density lipoprotein[J].Free Radical Research,1999,3:181-188.
[42]MILLER E R,PASTOR-BARRIUSO R,DALAL D,et al.Meta-analysis:high dosage vitamin E supplementation may increase all-cause mortality[J].Annals of Internal Medicine,2005,142:37-46.
[43]FUKUNAGA-TAKENAKA R,SHIRAI Y,YAGI K,et al.Importance of chroman ring and tyrosine phosphorylation in the subtype-specific translocation and activation of diacylglycerol kinase alpha by D-alphatocopherol[J].Genes Cells,2005,10:311-319.
[44]HUANG W C,CHEN P C,JOU S B,et al.Protein kinase C and changes in manganese suproxide dismutase gene expression in cultured glial cells[J].Clinical Experimental Pharmacology and Physiology,2001,28:822-825.
[45]PADAYATTY S J,KATZ A,WANG Y H,et al.Vitamin C as an antioxidant:evaluation of Its role in disease prevention[J].Journal of the American College of Nutrition,2003,22(1):18-35.
[46]马爱国,刘四朝.不同剂量维生素C对DNA氧化损伤影响的研究[J].营养学报,2001,23(1):12-14.
[47]KAPSOKEFALOU M,MILLER D D.Iron loading and large doses of intravenous ascorbic acid promote lipid peroxidation in whole serum in guinea pigs[J].British Journal of Nutrition,2001,85:681-687.
[48]LACHILI B,HININGER I,FAURE H,et al.Increased lipid peroxidation in pregnant women after iron and vitamin C supplementation[J].Biological Trace Element Research,2001,83:103-110.
[49]COOKE M S,MISTRY N,AHMAD J,et al.Deoxycytidine glyoxal:lesion induction and evidence of repair following vitamin C supplementation in vivo[J].Free Radical Biology & Medicine,2003,34:218-225.
[50]CHEN W T,LIN Y F,YU F C,et al.Effect of ascorbic acid administration in hemodialysis patients on in vitro oxidative stress parameters:influence of serum ferritin levels[J].American Journal of Kidney Disease,2003,42:158-166.
[51]BAILEY D M,RAMAN S,MCENERY J,et al.Vitamin C prophylaxis promotes oxidative lipid damage during surgical ischemia-reperfusion[J].Free Radical Biology and Medicine,2006,40:591-600.
[52]CHILDS A,JACOBS C,KAMINSKI T,et al.Supplementation with vitamin C and N-acetyl-cysteine increases oxidative stress in humans after an acute muscle injury induced by eccentric exercise[J].Free Radical Biology & Medicine,2001,31:745-753.
[53]HININGER I,WATERS R,OSMAN M,et al.Acute prooxidant effects of vitamin C in EDTA chelation therapy and long-term antioxidant benefits of therapy[J].Free Radical Biology & Medicine,2005,38:1565-1570.
[54]崔乃杰,崔乃强,付强,等.抗坏血酸、抗氧化及促氧化双向作用的ESR研究[C]//第七届全国中西医结合普通外科临床及基础研究学术会议论文汇编.北京:中国中西医结合学会,2001:383-386.
[55]BUETTNER G R,JURKIEWICZ B A.Catalytic metals,ascorbate and free radicals:combinations to avoid[J].Radiation Research,1996,145:532-541.
[56]SARDI B.High-dose vitamin C and iron overlaod[J].Annals of Internal Medicine,2004,140:846-847.
[57]BUSH A I.Metals and neuroscience[J].Current O-pinion in Chemical Biology,2000,4(2):184-191.
[58]RIMBACH G,BOESCH-SAADATMANDI C,FRANK J,et al.Deietary isoflavones in the prevention of cardiovascular disease-a molecular perspective[J].Food Chemical Toxicology,2008,46(4):1308-1319.
[59]PETRA A T,THOMAS W.Benzo[a]pyrene-induced cytochrome P450 1A and DNA binding in cultured trout hepatocytes-inhibition by plant polyphenols[J].Chemico-Biological Interactions,2007,169(1):25-31.
[60]林映才,蒋宗勇,刘建中,等.大豆黄素对生长肥育猪的生产性能和血液免疫指标的影响[J].饲料博览,2001(6):4-6.
[61]JIANG Z Y,JIANG S W,LIN Y C.,et al.Effects of soybean isoflavone on growth performance,meat quality and anti-oxidation in male broilers[J].Poultry Science,2007,86:1356-1362.
[62]KAMPKÖTTER A,TIMPEL C,RÖHRDANZE E,et al.Increased expression of catalase in human hepatoma cells by the soy isoflavone,Daidzein[J].Basic &Clinical Pharmacology Toxicology,2007,28:1176-1182.
[63]ARORA A,NAIR M G,STRASBURG G M.Antioxidant activities of isoflavones and their biological metabolites in a liposomal system[J].Archives of Biochemistry and Biophysics,1998,356:133-141.
[64]MIRA L,FERNANDEZ M T,SANTOS M,et al.Interactions of flavonoids with iron and copper ions:a mechanism for their antioxidant activity[J].Free Rad-ical Research,2002,36(11):1199-1208.
[65]AGNIESZKA R,ANETA B,GRZEGORZ B.Antoxidative and prooxidative effects of quercetin on A549 cells[J].Cell Biology International,2007,34:1245-1250.
[66]FANG M Z,CHEN D P,YANG C S.Dietary polyphenols may affect DNA methylation[J].The Journal of Nutrition,2007,137:223-228.
[67]CANADA A,GIANNELLA E,NGUYEN T,et al.The production of reactive oxygen species by dietary flaonols[J].Free Radical Biological Medicine,1990,9:441-449.
[68]许宗运.七种植物提取物对猪油的抗氧化性研究[J].塔里木农垦大学学报,2003,15(4):1-5.
[69]朱宇旌,李新华,张勇,等.苜蓿黄酮抗氧化性研究[J].沈阳农业大学学报,2006,37(4):615-618.
[70]程忠刚,林映才,余德谦,等.大豆异黄酮对肥育猪生产性能的影响极其作用机制探讨[J].动物营养学报,2005,17(1):30-34.
[71]LU J F,LI T,JIN D,et al.Preliminary study of dual characteristics of antioxidation and prooxidation of flavonoids[J].Journal of Chinical Pharmalogical Science,1999,8(1):15-20.
[72]GUO Q,RIMBACH G,MOINI H,et al.ESR and cell culture studies on free radical-scavenging and antioxidant activities of isoflavonoids[J].Toxicology,2002,179(1/2):171-180.
[73]GALATI G,SABZEVARI O,WILSON J X,et al.Prooxidant activity and cellular effects of the phenoxyl radicals of dietary flavonoids and others polyphenolics[J].Toxicology,2002,177:91-104.
[74]NORIYUKI K,POCAS E S,TOUZA N A,et al.Isoflavone decreases the free sulfydryl groups present in the enzyme and its inhibitory effect on enzyme activity[J].Bioorganic & Medicinal Chemistry,2008,16(19):8801-8805.
[75]CHOIA E J,CHEEA K M,LEEB B H.The prooxidant,rather than antioxidant,acts of daidzein in vivo and in vitro:daidzein suppresses glutathione metabolism[J].European Journal of Pharmacology,2006,542(3):162-169.
[76]SAHU S C,GRAY G C.Pro-oxidant activity of flavonoids:effects on glutathione and glutathione S-transferase in isolated rat liver nuclei[J].Cancer Letters,1996,104(2):196-196.
[77]ASLAN M,OZBEN T.Oxidants in receptor tyrosine kinase signal transduction pathways[J].Antioxidants& Redox Signaling,2003,5(6):781-788.
[78]田芳,仲伟鉴.α-硫辛酸的抗氧化和促氧化双向作用[J].环境与职业医学,2008,25(1):90-93.
[79]MORKUNAITE-HAIMI S,KRUGLOV A G,TEPLOVA V V,et al.Reactive oxygen species are involved in the stimulation of the mitochondrial permeability transition by dihydrolipoate[J].Biochemical Pharmacology,2003,65:43-49.
[80]SARIS N E,KARJALAINEN A,TEPLOVAE V V,et al.Stimulation of the mitochondrial permeability transition by α-lipoate and dihydrolipoate[J].Biochemistry & Molecular Biology International,1998,44:127-134.
[81]BHATTI F,MANKHEY R W,ASICO L,et al.Mechanisms of antioxidant and pro-oxidant effects of α-lipoic acid in the diabetic and nondiabetic kidney[J].Kidney International,2005,67:1371-1380.
[82]ÇAKATAY UFUK.Pro-oxidant actions of α-lipoic acid and dihydrolipoic acid[J].Medical Hypotheses,2006,66:110-117.
[83]LINNANE A W,EASTWOOD H.Cellular redox poise modulation;the role of coenzyme Q,gene and metabolic regulation[J].Mitochondrion,2004,4:779-789.
[84]TIAN B,HUA Y J.Concentration-dependece of prooxidant and antioxidant effects of aloin and aloe-emodin on DNA[J].Food Chemistry,2005,91:413-418.
[85]LAMBERT J D,ELIAS R J.The antioxidant and prooxidant activities of green tea polyphenols:a role in cancer prevention[J].Archives Biochemistry and Biophysics,2010,501(1):65-72.
[86]WALLACE D C.Mitochondrial bioenergetics and reactive oxygen species in degenerative diseases and aging[M]//GUARENTE L P,PARTRIDGE L,WALLACE D C.Molecular Biology of Aging.Copenhagen:Cold Spring Harbor Laboratory Press,1999:125-147.
[87]MILLER E R,PASTOR-BARRIUSO R,DALAL D,et al.Meta-analysis:high dosage vitamin E supplementation may increase all-cause mortality[J].Annals of Internal Medicine,2005,142:37-46.

