4-羟基-2(1H)-吡啶酮-3-甲酰胺类冬青生菌素类似物的合成与生物活性
辛伟翔, 潘 淼, 赵圣印
(东华大学 化学化工与生物工程学院,上海 201620)
4-羟基-2(1H)-吡啶酮-3-甲酰胺类冬青生菌素类似物的合成与生物活性
辛伟翔, 潘淼, 赵圣印*
(东华大学 化学化工与生物工程学院,上海 201620)
摘要:以反式-4-羟基肉桂酸为起始原料,经乙酰化、酰基叠氮、curtius重排、加成和环合等6步反应合成了4-羟基-2(1H)-吡啶酮-3-甲酰胺类冬青生菌素类似物,总收率17%.随后用滤纸片扩散法对该化合物的抑菌性能进行了初步研究.实验表明,该化合物对于白色念珠菌具有较好的抑制作用,对于酵母菌抑制作用较弱,对大肠杆菌和金黄色葡萄球菌基本无抑制作用.
关键词:4-羟基-2(1H)-吡啶酮-3-甲酰胺;冬青生菌素类似物;合成;抗真菌
真菌感染可导致各种人类疾病,因此很多药物被开发出来用于对抗真菌感染,例如唑类抗真菌药如氟康唑等、大环多烯类药物如两性霉素B等,但是这些药物大都存在副作用大以及耐药性的问题,所以研究开发新型的抗真菌药物具有重要意义.
1971年日本学者HAYAKAWA等[1]从山毛榉树枯萎的叶片中分离出来的柱枝双孢菌属冬青生菌MFC-870中提取分离得到冬青生菌素H (Ilicicolin H),实验表明该化合物具有抗炭疽杆菌的能力(6 mg/L).该化合物的结构在1976年通过化学降解的方法得到了阐明[2].1985年WILLIAM等人[3]采用全合成的方法进一步证实了其结构.Ilicicolin H是一种潜在的广谱抗真菌药物,其作用机理是通过选择性的抑制真菌线粒体中的氧化还原酶细胞色素bc1的活性来起到抗菌作用的[4].但是由于其结构复杂以及和血浆蛋白键合作用强等因素致使其应用受到限制.因此,对冬青生菌素H进行结构修饰及简化成为目前的研究热点.2012年,SINGH等人[5]通过构建模型的方法研究了Ilicicolin H的分子结构与药物活性的关系,实验数据表明,β-羰基的结构对于该化合物的抗菌活性有着重要的作用.2013年,SINGH等人[6]进一步对Ilicicolin H的4′位羟基、4位的羟基、2位的羰基、7位的羰基,12位的甲基以及双键进行了化学修饰,并对这些化合物进行了抗真菌活性的比较.实验结果表明,对Ilicicolin H的C-4′和C-19位的修饰可以减少其与血浆蛋白的键合作用,这为以后的修饰改造提供了宝贵的信息.本文作者以反式对羟基肉桂酸为原料通过乙酰化、取代、Curtius重排、加成、环化和去保护等6步反应,合成了一个新型冬青生菌素H类似物4-羟基-2(1H)-吡啶酮-3-甲酰胺化合物,随后又利用滤纸片扩散法进行了抗真菌和抗菌活性测试.
1实验部分
1.1 仪器与试剂
Thermo Scientific Nicolet iS5型傅立叶变换红外光谱仪,美国热电公司;Bruker AV-400型核磁共振仪,布鲁克公司;LCMS-8030型液质联用质谱仪,日本岛津公司;全自动高压蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;隔水式恒温培养箱,上海一恒科技有限公司;全自动菌落计数仪,杭州迅数科技有限公司;雷磁型数显pH计,上海精密科学仪器有限公司.
对羟基肉桂酸、叠氮磷酸二苯酯(DPPA)、一缩二乙二醇二甲醚、丙二酸二乙酯、葡萄糖、胰蛋白胨、琼脂粉、牛肉膏、氯化钠、甲苯、碳酸钾和氯化铵均为市售分析纯试剂.
1.2 实验用菌
白色念珠菌ATCC10231、金黄色葡萄球菌ATCC6538、大肠杆菌ATCC11229和黏质红酵母均从ATCC公司购得.
1.3 试验用培养基
1.3.1真菌培养基
葡萄糖40 g,胰蛋白胨10 g,琼脂粉20 g,蒸馏水(最终定容至1 000 mL),用稀HCl调整pH=5.6±0.2,于121 ℃灭菌20 min.
1.3.2细菌培养基
牛肉膏 3 g,蛋白胨 10 g,氯化钠 5 g,琼脂粉 20 g,蒸馏水(定容至1 000 mL),用稀NaOH溶液调整pH为7.4~7.6,于121 ℃灭菌20 min.
1.4 目标化合物的合成
本路线以反式对羟基肉桂酸为原料,经乙酰化、取代、Curtius重排、加成、环化和去保护等6步反应合成了目标产物,其合成路线见图1.
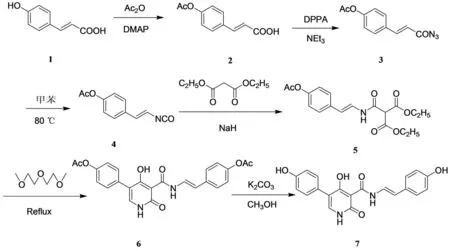
图1 化合物的合成路线Fig.1 The synthetic route of compound
1.4.1化合物2的合成
将5.0 g (30.5 mmol)对羟基肉桂酸(1)放入250 mL的梨形烧瓶中,加入0.2 g (1.6 mmol) 4-二甲氨基吡啶 (DMAP),用15 mL吡啶溶解,再加入醋酸酐10 mL (106.0 mmol),常温磁力搅拌,TLC监控反应,2 h后反应结束.用稀盐酸将溶液pH调至小于2,加入乙酸乙酯将析出固体溶解,萃取.有机层再用饱和食盐水洗一次.有机层用无水硫酸钠干燥,旋干.固体用无水乙醇重结晶,得到6.1 g白色晶体,产率97%.mp:204~205 ℃ (lit[8]:205~206 ℃);IR(cm-1,KBr):3 356,2 978,2 850,1 735,1 610,1 520,1 450.
1.4.2化合物3的合成
将3 g (14.6 mmol) 对乙酰氧基肉桂酸(2)用30 mL甲苯溶解,置于冰浴中,将4.8 g (17.5 mmol)叠氮磷酸二苯酯和1.8 g (17.5 mmol)三乙胺混合物滴入反应液中,室温搅拌,TLC监控反应,5 h后反应结束.加入30 mL乙酸乙酯,分别用饱和碳酸钠溶液、饱和氯化钠溶液各洗涤一次,有机层用无水硫酸钠干燥,蒸去溶剂得浅黄色固体3.1 g,产率92.0%.IR(cm-1,KBr):2 972,2 352,2 171,1 732,1 677,1 593,1 479,1 291,1 091.未经纯化直接用于下步反应.
1.4.3化合物4的合成
将3.0 g (12.9 mmol) 对乙酰氧基肉桂酰叠氮(3)用30 mL无水甲苯溶解,升温至80 ℃,TLC监控反应,7 h后原料点基本消失.由于产物对乙酰氧基肉桂异腈酸酯不稳定,所以未经提纯直接用于下步反应.
1.4.4化合物5的合成
取2.5 g (15.6 mmol) 丙二酸二乙酯和15 mL无水甲苯,冰浴冷却,缓慢加入0.73 g (18.2 mmol) NaH (60%),加毕搅拌10 min,将所得的反应液加入到置于冰浴中的含有对乙酰氧基肉桂异氰酸酯(4)的反应液里;常温反应过夜,TLC监控反应,完毕用饱和氯化铵溶液淬灭反应,加入30 mL乙酸乙酯萃取,随后用饱和碳酸钠溶液洗涤3次、饱和氯化钠溶液洗涤1次,有机层用无水硫酸钠干燥,将有机层旋干,得到棕褐色油状液体.柱层析分离,展开剂为乙酸乙酯与石油醚混合溶剂(V乙酸乙酯∶V石油醚= 1∶4),得到白色固体3.1 g,产率63.8%.mp:121~123 ℃;IR(cm-1,KBr):3 310,1 731,1 671,1 511,1 380,1 251,1 172,1 093;1H NMR (400 MHz,CDCl3)δ:1.34 (t,J= 7.1 Hz,6H,-CH3),2.31 (s,3H,COCH3),4.32 (q,J= 7.1 Hz,4H,-OCH2),4.43 (s,1H,CH),7.04 (d,J= 8.4 Hz,2H,Ar-H),7.28 (s,1H,=CH),7.35 (d,J= 8.4 Hz,2H,Ar-H),7.46 (dd,J= 14.6,10.7 Hz,1H,=CH-NH),9.25 (d,J= 10.5 Hz,1H,NH).
1.4.5化合物6的合成
将2.0 g (5.5 mmol) N-(4-乙酰氧基苯乙烯基)胺甲酰丙二酸二乙酯(5)和30 mL的一缩二乙二醇二甲醚混合,加热回流,TLC监控反应,2 h后原料点基本消失,停止反应.将溶剂减压蒸出,得到褐色油状液体.柱层析分离,展开剂为乙醇与二氯甲烷的混合溶剂(V乙醇∶V二氯甲烷= 1∶50),得到白色固体0.53 g,产率43.0%.mp:297~299 ℃.IR(cm-1,KBr):3 427,2 971,2 851,1 733,1 672,1 641,1 551,1 507,1 450,1 255,1 171,1 091;1H NMR (400 MHz,DMSO-d6)δ:2.27 (s,3H,COCH3),2.30 (s,3H,COCH3),6.55 (d,J= 14.7 Hz,1H,=CH),7.08 (d,J= 8.5 Hz,2H,Ar-H),7.18 (d,J= 8.5 Hz,2H,Ar-H),7.50 (d,J= 8.5 Hz,2H,Ar-H),7.55 (d,J= 8.6 Hz,2H,Ar-H),7.64 ~ 7.57 (m,1H,=CHNH),7.75 (s,1H,-NH),12.33 (s,1H,-NH),12.39 (d,J= 10.6 Hz,1H,-NH),15.98 (s,1H,-OH).13C NMR (101 MHz,DMSO-d6)δ:21.33,97.72,113.47,115.29,121.49,122.13,122.56,127.07,130.55,130.72,134.02,138.86,149.75,150.30,162.90,168.53,169.70,173.39.ESI-HRMS Calcd.For C24H20N2O7:448.127 1,Found:448.127 5.
1.4.6化合物7的合成
将0.5 g(1.1 mmol)化合物6、0.31 g(2.2mmol) K2CO3和20 mL甲醇混合,室温搅拌2 h,反应完毕减压旋出溶剂,加入15 mL水,用稀盐酸调pH至5~6,再加入30 mL乙酸乙酯萃取,旋出溶剂,得白色产物0.38 g,产率95%.mp:275~277 ℃;IR(cm-1,KBr):3 310,1 671,1 511,1 251,1 172,1 093.1H NMR (400 MHz,DMSO-d6)δ:6.41 (d,J= 14.7 Hz,1H,=CH),6.73 (d,J= 8.6 Hz,2H,Ar-H),6.80 (d,J= 8.4 Hz,2H,Ar-H),7.32 ~7.25 (m,4H,Ar-H),7.45 (dd,J= 14.7,4.6 Hz,1H,=CHNH),7.58 (d,J= 4.6 Hz,1H,-NH),9.55 (s,1H,Ar-OH),9.50 (s,1H,Ar-OH),12.18 (s,1H,-NH),12.34 (d,J= 10.5 Hz,1H,=CHNH),16.00 (s,1H,-OH).13C NMR (101 MHz,DMSO-d6)δ:97.69,114.45,115.46,115.49,116.06,116.35,118.68,123.73,127.08,127.45,130.58,157.34,162.94,168.15,173.48,173.78.ESI-MS (m/z):365(M+H)+.
1.5 抑菌测试
1.5.1梯度浓度的化合物溶液的配制
取目标化合物0.1 g溶于10 mL的1% DMSO(水溶液)中,得到10 g/L的化合物原液.从原液中取1 mL加入9 mL 1% DMSO制得1 g/L的溶液.同样操作制得0.1、0.05和0.01 g/L的溶液,备用.
1.5.2滤纸片扩散法抑菌测试[7-8]
用压片机压取一批直径6 mm的滤纸片,灭菌,备用.取4种活化菌株,用PBS缓冲溶液稀释菌液浓度至1×106~1×107CFU/mL.取0.1 mL菌液均匀涂布在对应的培养基上;将制备好的滤纸片泡在待测化合物溶液中1 min,取出贴在培养基上.另有1% DMSO空白对照.重复3组.将培养皿置于(37±0.2)℃恒温培养箱中,培养18~24 h.于自动菌落计数器下观察抑菌圈大小,抑菌圈>20 mm属于强抑菌作用,10~20 mm属于中等抑菌作用,<10 mm属于弱抑菌作用[9].
1.5.3最低抑制浓度的测定[10]
将滤纸片泡在不同浓度的检测溶液中1 min,取出贴在已经均匀涂布了白色念球菌的培养基上,1% DMSO做空白对照,设3组平行实验.将培养皿置于(37±0.2) ℃恒温培养箱中,培养18~24 h,并于自动菌落计数器下观察抑菌圈大小.没有抑菌作用的最低浓度即为最低抑菌溶度.
2结果与讨论
2.1 合成方法
本路线以廉价易得的对羟基肉桂酸为原料,各步反应操作简单,条件温和,产率高,具有较好的经济性和实用性.同时改进了环合溶剂,用沸点相对较低的二乙二醇缩二甲醚替代报道的高沸点溶剂二苯醚[11],使后处理变得相对简单.
2.2 目标化合物7对不同菌株的抑菌效果
取10 g/L化合物7待测液进行不同菌株抑菌效果实验,实验结束后测量对各个菌株的抑菌圈大小,实验结果如表1所示.

表1 不同菌种的抑菌活性Table 1 Antimicrobial acvitity of different strains
由表1可知,该化合物对于白色念珠菌具有较强的抑制作用,对酵母菌的抑制作用中等偏弱,对于大肠杆菌和金黄色葡萄球菌基本无抑制作用.说明该化合物对于真菌的抑制效果要好于对细菌的抑制效果.所以我们选取白色念珠菌进行最低抑制浓度(MIC)的测定.
2.3 最低抑制浓度的测定[12]
取10、1、0.1、0.05和0.01 g/L 5组浓度溶液测试该化合物对白色念珠菌的最低抑菌溶度,于自动菌落计数器下观察抑菌圈大小,结果如表2所示.

表2 浓度对抑菌性的影响Table 2 Effect of concentration on antimicrobial activity
“+”表示有抑菌效果,”-”表示无抑菌效果
由表2可知,当溶度降至0.05 g/L以下时,抑菌效果基本消失,所以该测试条件下,化合物对于白色念珠菌的最低抑制浓度为0.05 g/L.
3结论
以反式对羟基肉桂酸为原料,经6步反应,以17%的总产率合成了目标化合物7,该化合物具有与冬青生菌素类似结构特点.抑菌实验表明,该化合物对于白色念珠菌具有较好的抑制作用,最低抑制浓度为0.05 g/L;对于酵母菌也有一定的抑制效果;对大肠杆菌和金黄色葡萄球菌基本无抑制作用.
参考文献:
[1] HAYAKAWA S,MINATO H,KATAGIRI K.Ilicicolins,antibiotics from cylindrocladium ilicicola [J].J Antibiot,1971,24(9):653-654.
[2] MATSUMOTO M,MINATO H.Structure of ilicicolin H,anantifungalantibiotic [J].Tetrahedron Lett,1976,17(42):3827-3830.
[3] WILLIAMS D R,BREMMER M L,BROWN D L,et al.Total synthesis of (±)-ilicicolin H [J].J Org Chem,1985,50(15):2807-2809.
[4] GUTIERREZ-CIRLOS E B,MERBITZ-ZAHRADNIK T,TRUMPOWER B L.Inhibition of the yeast cytochrome bc1 complex by Ilicicolin H,a novel inhibitor that acts at the Qnsite of the bc1 complex [J].J Biol Chem,2004,(279):8708-8714.
[5] SINGH S B,LIU W,LI X,et al.Antifungal spectrum,in Vivo efficacy,and structure-activity relationship of IlicicolinH [J].ACS Med Chem Lett,2012,3(10):814-817.
[6] SINGH S B,LIU W G,LI X H,et al.Structure-activity relationship of cytochrome bc1 reductase inhibitor broad spectrum antifungal ilicicolin H [J].Bioorg Med Chem Lett,2013,23(10):3018-3022.
[7] OGAWA S.Application of the perkin reaction to phenolic aldehydes [J].Bull Chem Soc Jpn,1927,2:20-26.
[8] BAYDAR H,SAGDIC O,OZKAN G.,et al.Antibacterial activity and composition of essential oils fromOriganum,ThymbraandSaturejaspecies with commercial importance in Turkey [J].Food Control,2004,15:169-172.
[9] 唐煌,赵海涛,姚静婧,等.10-取代1-氮杂苯并蒽酮衍生物的抗肿瘤和抗菌活性研究[J].华西药学杂志,2014,29(5):522-524.
[10] XIA Q C,HE Q Z,XU D F, et al.Synthesis,characterization and antibacterial of five-membered heterocycles [J].Acta Chim Sinica,2010,23(68):2414-2420.
[11] ZHAO S Y,LIU B S,HUANG J,et al.Thermal-induced dimerization cyclization of ethyl N-(styrylcarbamoyl)acetates:formation of 4-hydroxy-2(1H)-pyridone-3-carboxamide derivatives [J].Synthetic Commun,2014,44(14):2066-2075.
[12] 赵磊,李思然,张鹤龑,等.糖酯酶促合成及抗菌活性的初步研究[J].食品与发酵工业,2014,40(10):32-36.
[责任编辑:任铁钢]
Synthesis and bioactivity of 4-hydroxy-2(1H)-pyridone-
3-carboxamide derivatives
XIN Weixiang,PAN Miao,ZHAO Shengyin*
(CollegeofChemistry,ChemicalEngineeringandBiotechnology,DonghuaUniversity,Shanghai201620,China)
Abstract:4-Hydroxy-2(1H)-pyridone-3-carboxamide,an ilicicolin H analogue,was synthesized with yield of 17% from trans-4-hydroxycinnamic acid through acetylation,substitution,curtius rearrangement,addition,cyclization and so on.Its antifungal and antimicrobial activities were screened by filter paper diffusion method.Results indicated that the compound show potential antifungal activity against Candida albicans and weak activity against Yeast.The compound shows no inhibition effect on E.coli and Staphylococcus aureus.
Keywords:4-hydroxy-2(1H)-pyridone-3-carboxamide; ilicicolin H analogue; synthesis; antifungal activity
作者简介:辛伟翔(1990-),男,硕士生,研究方向为有机合成与药物化学.*通讯联系人,E-mail:syzhao8@dhu.edu.cn.
基金项目:国家自然科学基金(21072029).
收稿日期:2014-12-12.
中图分类号:O625.6
文献标志码:A
文章编号:1008-1011(2015)02-0153-05
——致坚守奋斗的你

