Fe2+激活过硫酸氢钾法降解扑热息痛
Fe2+激活过硫酸氢钾法降解扑热息痛*
关小红辛晓岩高乃云†谈超群庄珍珍
(同济大学 污染控制与资源化研究国家重点实验室, 上海 200092)
摘要:研究了Fe2+激活过硫酸氢钾(PMS)降解扑热息痛(APAP)的反应.通过考察反应的影响因子、动力学、矿化率及自由基及OH·)确认情况,发现反应分为快速反应阶段和慢速反应阶段,降解反应中PMS与Fe2+浓度比值为1.5:1时APAP的降解速率最大,最适宜pH值为5.0,反应在较高的PMS及Fe2+投量下可获得55%以上的矿化率.通过电子自旋共振(ESR)检测直接证实:PMS-Fe2+系统降解APAP的反应过程中有及OH·的出现,并且对APAP降解起主要作用;反应开始3min左右及OH·均出现,随后OH·减少直至消失,是慢速反应阶段的主要自由基.
关键词:扑热息痛;降解;二价铁;过硫酸氢钾;自由基确认;动力学
中图分类号:X523
doi:10.3969/j.issn.1000-565X.2015.03.020
文章编号:1000-565X(2015)03-0143-08
收稿日期:2014-08-05
基金项目:* 国家自然科学基金资助项目(20977034,51478191)
作者简介:喻成龙(1988- ),男,博士生,主要从事空气污染物催化净化研究. E-mail: chenglongyu888@163.com
随着生活水平的提高,人们对药物及个人护理品的使用越来越多,使医药废水造成的污染也逐渐加重[1-2].药物及个人护理品(PPCPs)这类新型微量有机污染物在城市污水厂出水和水环境中频繁检出,其对环境和人类的潜在危害越来越引起世界的关注[3].
研究表明,高级氧化技术对药物及个人护理品具有良好的去除效能[4].传统高级氧化技术包括内容众多,如紫外/双氧水技术、臭氧/双氧水技术、芬顿试剂氧化法、二氧化钛光催化氧化技术等[5-6].但传统高级氧化技术存在种种问题:芬顿试剂及类芬顿试剂氧化法处理费用高,双氧水利用率低,过量的二价铁也会增大处理后污水的化学需氧量而产生二次污染;而臭氧氧化法存在设备复杂、产率低、有机物降解不彻底的问题[7];二氧化钛光催化氧化技术往往存在二氧化钛在反应后的不易分离、对高浓度和高浊度及含有悬浮物的原水处理效果难以保证的问题[8].所以本研究采用新型的基于产生自由基的高级氧化技术.激活自由基的方法有多种,如热活化、紫外光活化、过渡金属离子活化等[9-10].其中,热活化在实际应用中存在能耗过高、温度控制要求过高等问题;紫外光活化在反应产物及反应历程方面存在很多的不确定性,并且紫外光对人体有很大危害[11].
因此,本研究采用过渡金属铁(二价)激活过硫酸氢钾的方法对目标污染物进行去除,并针对涉及的反应条件及动力学进行研究.文中对二价铁激活过硫酸氢钾降解目标污染物的影响因素进行了对比,包括初始目标污染物浓度、氧化剂(过硫酸氢钾)投量、激活剂(二价铁)用量、溶液初始pH.另外本研究对降解矿化程度进行考察,并进行自由基确认.
扑热息痛(乙酰氨基酚,APAP)是最常用的非抗炎解热镇痛药,是乙酰苯胺类药物中最常用的品种,其摩尔质量为151.17g/mol,在20℃水中溶解度为14000g/mL,酸度系数(pKa)为9.38,.环境中的扑热息痛对生物造成遗传毒性、肝毒性、内分泌干扰等负效应[12],传统水处理工艺对扑热息痛几乎没有降解效果[13].
本研究采用扑热息痛(APAP)作为目标污染物,使用二价铁激活过硫酸氢钾(PMS)去除,在研究各影响因素的基础上进行动力学分析,完成自由基确认,并对反应机理进行初步探索.
1材料与方法1.1试剂与装置
本研究中如无特殊说明,试剂为分析纯.扑热息痛与甲醇(色谱纯)购自西格玛奥德里奇(上海)贸易有限公司,超纯水采用Milli-Q出水.甲基氰(色谱纯,≥99.9%)及二甲基吡啶-N-氧化物(DMPO)购自西格玛奥德里奇(上海)贸易有限公司.PMS(KHSO5·0.5KHSO4·0.5K2SO4,KHSO5含量≥47%)购自上海晶纯实业有限公司.乙醇(ETOH,≥99.7%)、叔丁醇(TBA,≥99.5%)、亚硫酸钠(Na2S2O3,≥99.5%)及硫酸亚铁(FeSO4·7H2O,≥99.5%)购自国药集团化学试验有限公司.检测仪器为高效液相色谱仪(HPLC)(美国Waters2010),配有SymmetryC18色谱柱(250mm×4.62mm×5μm,Waters)、紫外(UV)检测器(Waters2489)和低压汞灯(75W,天津新景有限公司).
1.2试验方法
实验室条件下,用去离子水配制溶液,在250mL棕色试剂瓶中加入含目标污染物(APAP)的溶液200mL,加入硫酸亚铁作催化剂,随后将试剂瓶置于浸没式温控水浴摇床中摇晃,控制反应温度,在加入PMS的同时开始计时,分别在时间点0、5、15、30、60min停床,取0.8mL样品于预先放置了0.2mL足量淬灭剂亚硫酸钠的1mL液相瓶中,以保证氧化反应在取样点停止.
1.3分析方法
使用高效液相色谱(C18色谱柱)测定APAP含量,检测器为紫外-可见光检测器(Waters2489),检测波长为243nm,流动相为甲醇和水(Milli-Q超纯水,体积比为25:75)混合液,流动速率为0.7mL/min;溶液pH值由MettlerToledopH计测定.数据的标准偏差通过误差棒体现.数据分析使用Origin8.0及Excel.
2结果与分析2.1APAP初始投量的影响
在初始温度为25℃,pH值为5.0,PMS初始浓度为0.1mmol/L,Fe2+初始浓度为0.1mmol/L的条件下,调节APAP初始质量浓度分别为2.5、5.0、7.5、10.0mg/L.图1中ρ/ρ0为污染物APAP在反应中与反应前的质量浓度比,t表示时间.可见Fe2+激活PMS降解APAP的反应进程分为快速反应阶段和慢速反应阶段.快速降解阶段的去除率与初始APAP投量有关,初始投量越大降解效率越低,快速降解阶段是反应速度的控制步骤,而慢速阶段的反应速度几乎没有差别,其他影响因素也是如此,所以考察反应速度通过快速阶段进行,相似的试验结果出现在Tan等[14]的研究中.

图1 初始APAP 投量对PMS-Fe 2+系统中降解APAP效果的影响 Fig.1 Effects of initial APAP dosage on APAP degradation in PMS-Fe 2+system
经考察不加Fe2+单独使用PMS时,APAP几乎没有降解效果(去除率≤5%).如图1所示,APAP去除率随其投量的增加逐渐降低,在10.0mg/L时达到最低,在2.5mg/L时最高(去除率为60%).这是由于初始投加PMS和Fe2+量一定的情况下,反应能够产生的羟基自由基及硫酸根自由基数量一定,可降解APAP的量有限,所以APAP投量持续增加会造成其去除率降低.
2.2Fe2+初始投量的影响
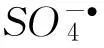
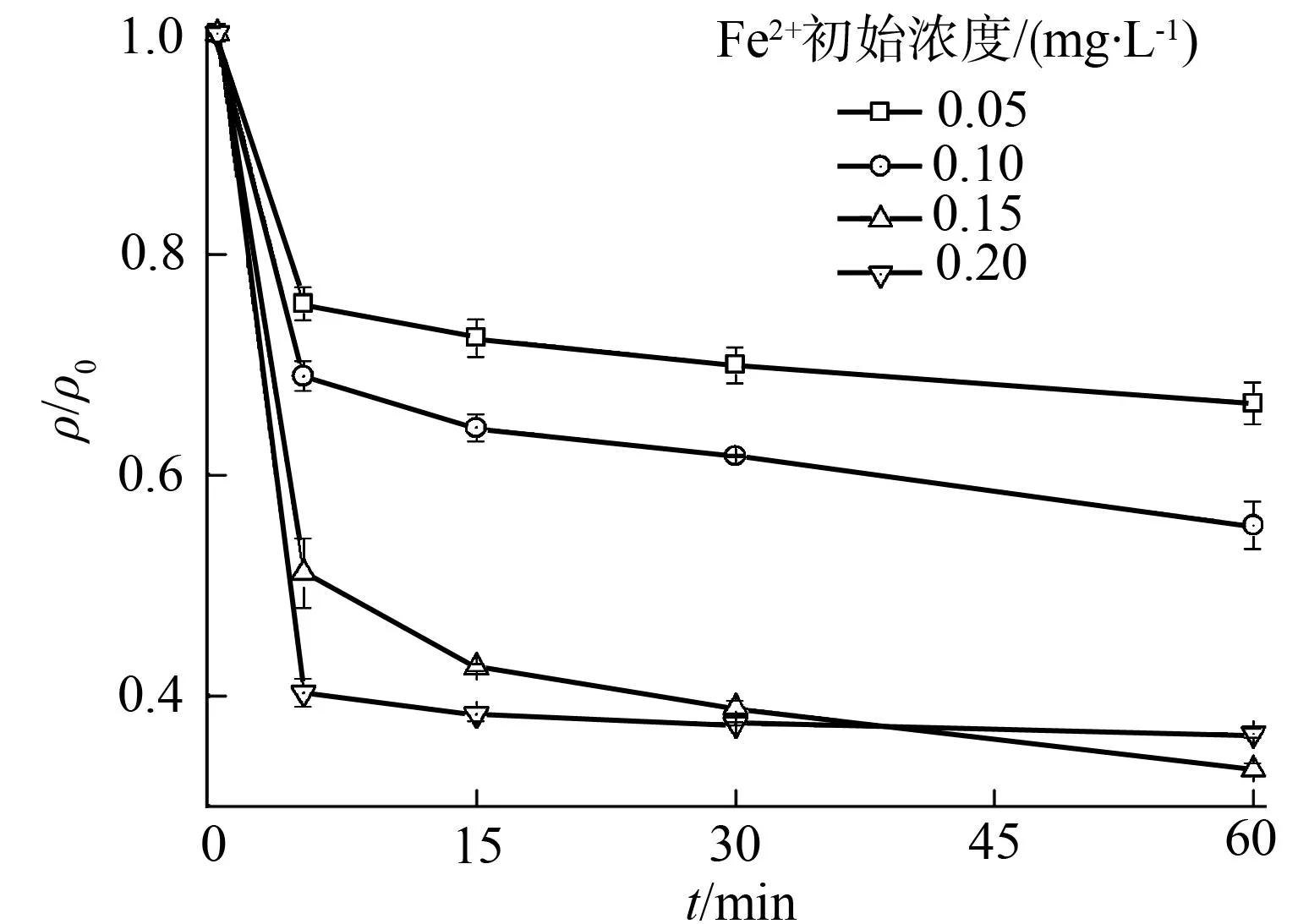
图2 初始Fe 2+投量对PMS-Fe 2+系统中降解APAP效果的影响 Fig.2 Effects of initial Fe 2+dosage on APAP degradation in PMS-Fe 2+ system
2.3PMS初始投量的影响
在初始温度为25℃,pH值为5.0,Fe2+初始浓度为0.1mmol/L,APAP初始质量浓度为10.0mg/L的条件下,调节PMS初始浓度分别为0.1、0.2、0.3、0.4mmol/L,结果如图3所示.PMS在Fe2+激活下降
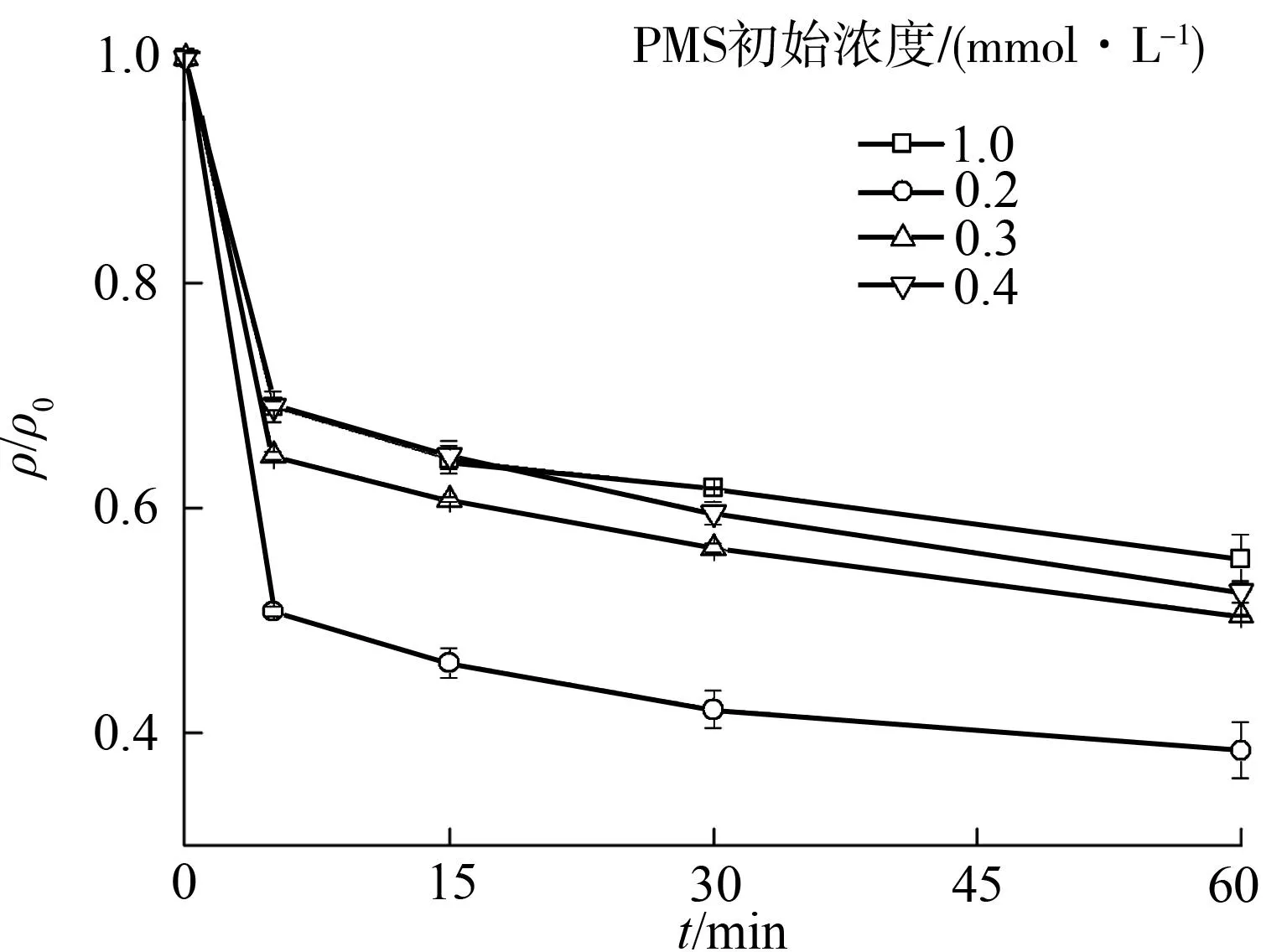
图3 初始PMS投量对PMS-Fe 2+系统中降解APAP效果的影响 Fig.3 Effects of initial PMS dosage on APAP degradation in PMS-Fe 2+ system
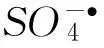


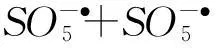

相似的抑制作用在文献[9]中出现.经计算最大降解速率在PMS投量为0.15mmol/L处.
2.4初始pH值的影响
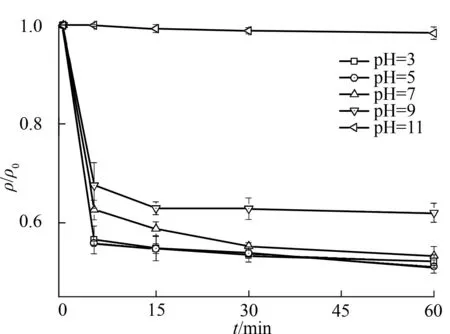
图4 初始pH值对PMS-Fe 2+系统中降解APAP效果的影响 Fig.4 Effects of initial pH value on APAP degeradation in PMS-Fe 2+system
由此可见,PMS-Fe2+系统降解APAP的反应在碱性条件下受抑制,弱酸性(pH=5.0左右)条件下反应效果最好,类似结果也出现在Pignatello等[6]对使用Fe2+做催化剂的系列Fenton反应的研究中.
2.5动力学分析
表1示出了PMS-Fe2+系统降解APAP反应4个影响因素对应的一级动力学分析数据,根据公式
-ln[APAP]/[APAP]0=kobst,
使用各影响因子快速反应阶段数据计算其反应速率,根据计算结果进行公式拟合.可见:APAP及Fe2+投量两因子符合线性公式.初始APAP投量增加,降解速率降低,线性良好(r2=0.95),说明APAP的增加抑制降解速率;初始Fe2+投量增加,降解速率增大,线性良好(r2=0.95),说明Fe2+对PMS有明显激活作用,Fe2+增加使PMS生成自由基量增长,使APAP降解速率增加;随初始PMS投量的增加,降解速率先增大再减小,最大值在0.15mmol/L处;随初始pH增加,降解速率先增加后减小,最大值出现在pH值为5.0处.表1示出的各影响因素与反应速率符合的变化公式,在实际中有一定应用价值.
2.6矿化效果
在正常投量下总有机碳(TOC)值为7.8mg/L,矿化率在5%左右,这是由于APAP矿化反应符合如下公式:
C8H9NO2+ 29HSO5-→ 8CO2+ 15H2O+
NH4++ 29SO42-
在初始温度为25℃,pH值为5.0,APAP初始质量浓度为10.0mg/L的条件下,PMS及Fe2+投量均为1mmol/L(10倍)时,TOC值为4.7mg/L,矿化率为40%,PMS及Fe2+投量均为2mmol/L(20倍)时,TOC值为3.5mg/L,矿化率为55%.
表1PMS-Fe2+系统降解APAP反应各个影响因素对应的动力学数据
Table1KineticsdatacorrespondingtodifferentaffectingfactorsinAPAPdegradationinPMS-Fe2+system

影响因子取值kobs/min-1拟合公式(y为kobs,x为影响因子量)APAP投量/(mg·L-1)2.55.07.510.00.0070±0.00010.0066±0.00010.0053±0.00010.0045±0.0003y=8.1-0.36192x,r2=0.95Fe2+投量/(mmol·L-1)0.050.100.150.200.0034±0.00020.0070±0.00020.0081±0.00011.0010±0.0002y=1.392+47.4684x,r2=0.95PMS投量/(mmol·L-1)0.100.200.300.400.0071±0.00030.0081±0.00030.0052±0.00080.0044±0.0003y=1004.3x3-799.11x2+179.85x-3.915,r2=0.99pH值3579110.0069±0.00030.0070±0.00030.0057±0.00080.0047±0.00030.0000±0.0001y=-0.1677x2+ 1.5485x+3.5714,r2=0.97
经考察发现,在PMS及Fe2+为0.1mmol/L的条件下,TOC去除率较低,APAP去除率为60%,说明在此投量下反应APAP可以有效降解并转化为其他有机物,未转化为CO2和H2O.提高氧化剂及激活物的投量可大大提高PMS-Fe2+系统反应矿化率,减少其他有机副产物的生成,提高有机物去除效率.
2.7自由基确认及反应路径分析
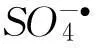
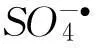

图5 0、3、5、10min PMS-Fe 2+系统自由基的确认 Fig.5 Radical-verifing condition in PMS-Fe 2+ system at 0,3,5,10min
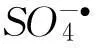
图5所示的10min时自由基减少可能是由于加合物DMPO-OH及DMPO-SO4的不稳定造成,随着时间延长加合物会逐渐消失,导致检测值很低,而不是反应中的自由基消失.由生成的自由基顺序可分析PMS-Fe2+系统降解APAP的反应路径,即方程(1)-(4)[17-18]:

(1)
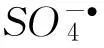
(2)
(3)
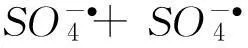
(4)
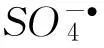
3结论

(1)PMS-Fe2+系统对APAP的去除率及反应速率随APAP投量的增加而降低,随Fe2+投量的增加而升高,过量增加Fe2+会对反应造成抑制,反应分为快速反应阶段和慢速反应阶段;
(2)PMS-Fe2+系统降解APAP的反应中,PMS与Fe2+浓度比值为1.5:1时降解APAP的反应速率最大;
(3)PMS-Fe2+系统降解APAP反应的最适宜pH值为弱酸性(5.0);
(4)PMS-Fe2+系统降解APAP的反应在较高的PMS及Fe2+投量下可获得55%的矿化率;
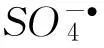
本研究所考察的影响因子不全面,使得在实际应用中会遇到条件的限制,希望在今后的研究中能够有所补充.
参考文献:
[1]YangX,FlowersRC,WeinbergHS,etal.Occurrenceandremovalofpharmaceuticalsandpersonalcarepro-ducts(PPCPs)inanadvancedwastewaterreclamationplant[J].WaterResearch,2011,45(16):5218-5228.
[2]WangY,ZhangH,ChenLu,etal.Ozonationcombinedwithultrasoundforthedegradationoftetracyclineinarectangularair-liftreactor[J].SeparationandPurificationTechnology,2012,84:138-146.
[3]鲁金凤,张勇,王静超,等.高级氧化技术降解水中药物及个人护理品的研究进展[J].工业水处理,2011,31(3):53-58.
LuJin-feng,ZhangYong,WangJing-chao,etal.Researchadvancesinthedegradationofpharmaceuticalsandpersonalcareproductsinaquaticenvironmentbyadvancedoxidationprocesses[J].IndustrialWaterTreatment,2011,31(3):53-58.
[4]AndreozziRoberto,CaprioVincenzo,MarottaRaffaele,etal.ParacetamoloxidationfromaqueoussolutionsbymeansofozonationandH2O2/UVsystem[J].WaterResearch,2003,37(5):993-1004.
[5]胡洪营,王超,郭美婷.药品和个人护理用品(PPCPs)对环境的污染现状与研究进展[J].生态环境,2005,14(6):947-952.
HuHong-ying,WangChao,GuoMei-ting.Thepresentstatusofenvironmentalpollutionbypharmaceuticalsandpersonalcareproducts(PPCPs)[J].EcologyandEnvironment,2005,14(6):947-952.
[6]PignatelloJJ,OliverosEsther,MacKayAllison.Advancedoxidationprocessesfororganiccontaminantdestructionbasedonthefentonreactionandrelatedchemistry[J].CriticalReviewsinEnvironmentalScienceandTechnology,2006,36(1):1-84.
[7]张艳霞,谢红光,郭文珂.高级氧化技术在水处理中的研究与应用[J].河南科技,2013,6(11):184.
ZhangYan-xia,XieHong-guang,GuoWen-ke.ResearchandapplicationofAOPsinwatertreatment[J].JournalofHenanScienceandTechnology,2013,6(11):184.
[8]孙云雪,魏娜,金鑫,等.TiO2光催化氧化处理废水存在的问题和改进方案[J].工业安全与环保,2010,36(1):14-16.
SunYun-xue,WeiNa,JinXin.ProblemsexistinginwastewatertreatmentbyTiO2photocatalyticoxidationandtheimprovementmeasures[J].IndustrialSafetyandEnvironmentalProtection,2010,36(1):14-16.
[9]ChenXY,ChenJW,QiaoXL.Performanceofnano-Co3O4/peroxymonosulfatesystem:kineticsandmechanismstudyusingacidorange7asamodelcompound[J].AppliedCatalysisB:Environmental2008;80(1/2):116-121.
[10]HouseDA.Kineticsandmechanismofoxidationsbyperoxydisulfate[J].ChemicalReviews,1962,62(3):185-203.
[11]王兵,李娟,莫正平,等.基于硫酸自由基的高级氧化技术研究及应用进展[J].环境工程,2012,30(4):87-92.
WangBing,LiJuan,MoZheng-ping.Progressinadvancedoxidationprocessesbasedonsulfateradical[J].EnvironmentEngineering,2012,30(4):87-92.
[12]王佳裕,戴启洲,鱼杰,等.活性炭催化臭氧氧化扑热息痛的机制研究[J].环境科学,2013,34(4):1402-1410.
WangJia-yu,DaiQi-zhou,YuJie,etal.Mechanismofcatalyticozonationforthedegradationofparacetamolbyactivatedcarbon[J].EnvironmentalScience,2013,34(4):1402-1410.
[13]CarballaM,OmilF,LemaJuanM.Behaviorofpharmaceuticals,cosmeticsandhormonesinasewagetreatmentplant[J].WaterResearch,2004,38(12):2918-2926.
[14]TanCQ,GaoNY,ChuWH.Degradationofdiuronbypersulfateactivatedwithferrousion[J].SeparationandPurificationTechnology,2012,95:44-48.
[15]KolthoffIM,MedaliaAI,RaaenHP.Thereactionbetweenferrousironandperoxides.IV.reactionwithPotassiumPersulfate[J].JournaloftheAmericanChemicalSociety,1951,73(4):1733-1739.
[16]LinH,WuJ,ZhangH.DegradationofclofibricacidinaqueoussolutionbyanEC/Fe3+/PMSprocess[J].ChemicalEngineeringJournal,2014,244:514-521.
[17]XuXR,LiXZ.DegradationofazodyeorangeGinaqueoussolutionsbypersulfatewithferrousion[J].SeparationandPurificationTechnology,2010,72(1):105-111.
[18]DeLaatJoseph,LeTruongGiang.KineticsandmodelingoftheFe(III)/H2O2systeminthepresenceofsulfateinacidicaqueoussolutions[J].EnvironmentalScience&Technology,2005,39(6):1811-1818.
DegradationofAcetaminophenbyFe2+-Activated
PeroxymonosulfateOxidation
Guan Xiao-hongXin Xiao-yanGao Nai-yunTan Chao-qunZhuang Zhen-zhen
(StateKeyLaboratoryofPollutionControlandResourceReuse,TongjiUniversity,Shanghai200092,China)
Abstract:This paper deals with the degradation of acetaminophen by Fe2+-activated peroxymonosulfate (PMS) in aqueous solution.or OH·) identification, two degradation stages, one is fast and the other is slow, are discovered, and an optimal concentration ratio of PMS to Fe2+, namely 1.5:1, is determined for achieving the highest degradation rate. Moreover, it is found that the optimal pH value is 5.0, and that relatively high PMS and Fe2+ dosages help achieve a mineralization rate more than 55%.and OH·appear after 3is the main radical for the slow degradation stage.
Keywords:acetaminophen;degradation;bivalentiron;peroxymonosulfate;radicalverification;kinetics
Foundationitems:SupportedbytheNationalNaturalScienceFoundationofChina(NSFC)(20977034,51478191)
†通信作者: 黄碧纯(1966-),女,教授,主要从事大气污染控制研究.E-mail:cebhuang@scut.edu.cn

