恩施鱼塘坝玉米硒富集及玉米肽抗氧化活性研究
王 驰 何 慧 张久亮 侯 焘 石 文 刘维维
恩施鱼塘坝玉米硒富集及玉米肽抗氧化活性研究
王 驰 何 慧 张久亮 侯 焘 石 文 刘维维
(华中农业大学食品科学技术学院环境食品学教育部重点实验室,武汉 430070)
为了探究恩施鱼塘坝地区硒资源的分布特点,土壤因素对玉米中硒含量的影响以及硒含量和玉米肽(CPs)抗氧化活性的关系,本文采用玉米良种(湘玉十号),在鱼塘坝附近选取16个不同地点种植,并分两季采收,利用原子荧光法对玉米中蛋白质、多糖中硒含量进行分析,同时对种植地土壤样本的硒含量和pH值进行了测定。通过HepG2人体肝癌细胞模型对高硒CPs以及低硒CPs的抗氧化活性进行研究。结果表明:所有玉米种植地土壤均达到富硒土壤标准(0.4 mg/kg),但其生长的玉米中硒含量存在较大差异,玉米对硒的富集受到土壤硒含量、种植时间以及pH值的共同影响;玉米中蛋白和多糖具有很高的硒含量。高硒玉米和低硒玉米制成的玉米肽均表现出较好的抗氧化能力,但前者显著高于后者(P<0.05),在HepG2细胞抗氧化模型中,500μg/mL浓度为玉米肽最佳抗氧化浓度;与较低硒玉米肽处理组相比,经高硒玉米肽预处理的细胞存活率增加了24.16%。综上所述,pH低于5的土壤对玉米吸收硒的能力有严重抑制作用,弱碱性土壤更适合玉米对于硒的利用,且种植时间较长的老玉米硒含量更高;富硒玉米肽的抗氧化能力显著高于低硒玉米肽。
鱼塘坝 富硒玉米 玉米肽 抗氧化活性 土壤
硒作为人体必需的微量元素之一,是人体内多种硒蛋白的必需成分,具有抗癌[1]、提高自身机体免疫力[2]、预防心脑血管疾病[3]、抗氧化[4-5]等多种生理功能。
土壤是植物硒的主要来源。世界卫生组织公布的资料表明,全世界有40多个国家和地区不同程度的缺硒,我国大约2/3的地区属于缺硒或低硒地区,其中30%左右的地区严重缺硒。湖北恩施享有世界硒都的美誉,鱼塘坝是恩施标志性的高硒地区之一[6]。有报道指出,玉米中硒含量与土壤硒含量之间表现出极显著正相关关系[7],本实验室此前对富硒玉米肽(CPs)结构、活性等展开过一系列研究[8-10],其原料也主要产自该地区,但不同批次玉米间硒含量仍然存在一定差异,故玉米中硒含量与土壤之间的关系还有待进一步研究。另一方面,有研究表明玉米肽具有良好的清除羟基自由基的能力、清除DPPH自由基的能力和还原能力[11-13],而硒本身作为一种具有抗氧化活性的物质在玉米肽中发挥的作用还有待研究。本研究采用玉米良种,在鱼塘坝附近选取不同地点种植并分两季采收,通过对玉米籽粒以及土壤中硒含量的分析,探究鱼塘坝地区硒资源的分布特点,土壤和季节因素对玉米中硒含量的影响,并通过细胞模型对高硒CPs以及低硒CPs的抗氧化活性进行比较,为富硒CPs的深入开发提供依据。
1 材料与方法
1.1 材料与仪器
玉米品种选取湘玉十号,于湖北恩施鱼塘坝附近地区定点种植,统一采收。
HepG2人肝癌细胞系:华中科技大学同济医学院药学院;碱性蛋白酶(Alcalase 3.0T):丹麦诺维信公司;培养基DMEM:美国Hyclone公司;胎牛血清:杭州四季青生物工程有限公司;胰蛋白酶:美国Amresco公司。
Multiskan Go全波长酶标仪:美国Thermo Fisher Scientific公司;超滤膜系统(截留相对分子质量为5 000):美国Millipore公司;细胞培养板/瓶:美国Cellstar Greiner Bio公司;AFS-8220型原子荧光光度计:北京吉天仪器有限公司。
1.2 试验方法
1.2.1 玉米和土壤样本获取
在湖北恩施鱼塘坝地区9平方公里范围内选取16处玉米种植地如表1所示(每处种植地之间至少间隔500 m),采用湘玉十号玉米品种于5月中旬播种,当年8月和10月分2次采收(嫩玉米、老玉米)。采收后的新鲜玉米晒干至恒重后剥下玉米粒,于-20℃保存备用。

表1 玉米样品产地和批次
各玉米种植区域采用多点取样法,随机均匀采集土壤样本,除去枯枝败叶、石砾等杂质,充分混匀,自然干燥至恒重后研磨、过筛,放入统一密封袋中,于-20℃保存备用。
1.2.2 玉米蛋白的提取
采用本实验室建立的碱醇提取、等电点沉淀的方法[10]制备玉米蛋白。
1.2.3 玉米多糖的提取
玉米籽粒→洗净→烘干→粉碎→过40目筛→取一定量玉米粉→按照料液比1∶20(m/V)加入蒸馏水→60℃下超声提取50 min→4 000 r/min离心10 min→取上清液,将沉淀再重复提取1次→合并上清液→旋蒸浓缩→将浓缩液与Sevag试剂(氯仿、正丁醇按4∶1混合)按4∶1混合→震荡混匀后装入分液漏斗静置→待溶液分层后取上层溶液,重复加入Sevag试剂混匀静置,直至分层后液面交界处无白色混悬→加入3倍体积95%乙醇沉淀多糖→4 000 r/min离心10 min,取沉淀→冷冻干燥48 h。
1.2.4 CPs的制备
采用本实验室建立的最佳碱性蛋白酶水解和超滤方法进行制备:富硒玉米蛋白粉→按料液比1∶35(m/V)加水→沸水浴处理30 min→调温、调pH至一定温度和蛋白酶的最适pH 8.00→按酶底比0.6%(E/S,m/m)加入Alcalase碱性蛋白酶→边搅拌边不断加入0.1 mol/L NaOH溶液,以维持pH 8.00不再变化→取出烧杯冷却至室温→选用截留相对分子质量为5 000的再生纤维素卷式超滤膜进行超滤分离,膜透过物冷冻干燥48 h,在此工艺条件下,肽回收率为73.32%[10]。
1.2.5 硒含量的测定
样品前处理:
玉米籽粒→洗净→烘干→粉碎→过40目筛;冻干后的蛋白、多糖样品→磨碎→过40目筛;土壤样品→冷冻干燥48 h→磨碎→过40目筛。
硒含量测定参照GB/T 21729—2008,氢化物发生-荧光光谱法(HG-AFS)定量测硒。
1.2.6 土壤样本pH值测定
土壤pH的测定参照NY/T 1121第2部分所述方法:将干燥的土壤样品研磨过筛后,精确称取10 g(精确到0.01 g)于烧杯中,加入超纯水25 mL,用搅拌器搅拌1 min,使其充分混匀,放置30 min后测定。
将pH计电机插入试样悬浮液中,轻轻转动烧杯以除去电极的水膜,促使其快速平衡,静置片刻后按下读数按钮,待读数稳定后记下pH值。
1.2.7 HepG2细胞培养
人肝癌HepG2细胞用含10%胎牛血清、100 U/mL青霉素、100 U/mL的链霉素的DMEM培养基培养,细胞存放在37℃和含5%CO2的培养箱中孵育,呈现出单层贴壁生长。试验用细胞均处于对数生长期,将对数生长期细胞用0.25%胰蛋白酶消化,加入适量含血清的培养基终止消化,取适量细胞悬液接种于培养板或培养瓶。
1.2.8 细胞氧化损伤模型的建立
取对数生长期的HepG2细胞,并调整至约为8×104个/mL,接种于96孔板内,每孔100 μL。在37℃、5%CO2的培养箱中培养12 h,待细胞贴壁后,吸弃上清液。试验组分别加入不同浓度的H2O2(100~800 μmol/L)100 μL,培养板于37 ℃、5%CO2培养箱中培养2 h,其中空白调零组只添加培养液,对照组为含细胞不加药组,每组设5复孔,培养结束后,吸弃上清液,每孔加无血清培养液200μL浓度为5 mg/mL的MTT 20μL,继续培养4 h后,尽可能的吸去上清液,每孔加入150μL二甲基亚砜(DMSO),室温下在摇床上震荡10 min,充分混匀并溶解蓝紫色的甲臜颗粒。在酶联免疫检测仪上选择490 nm波长,测定各孔吸光度值A490。试验重复3次,取平均值,按公式计算:
细胞存活率=(试验组A490-空白组A490)/(对照组A490-空白组A490)×100%
1.2.9 统计学处理
运用SPSS 19.0统计软件进行处理,所有的数据均以X±SD表示,通过组间LSD检验对试验结果进行显著性分析。
2 结果与讨论
2.1 玉米及其提取物样本中硒含量的测定结果
由表2可知,生长于不同地理条件下的玉米硒含量存在较大差异。其中编号为7、8的玉米样品均未检出硒。编号为6、8的嫩玉米样品硒含量在检测限以下,但老玉米样品检出微量硒。嫩玉米中硒含量最高的4号样品,硒含量为1.061 mg/kg;老玉米中硒含量最高的15号样品,硒含量为3.944 mg/kg。
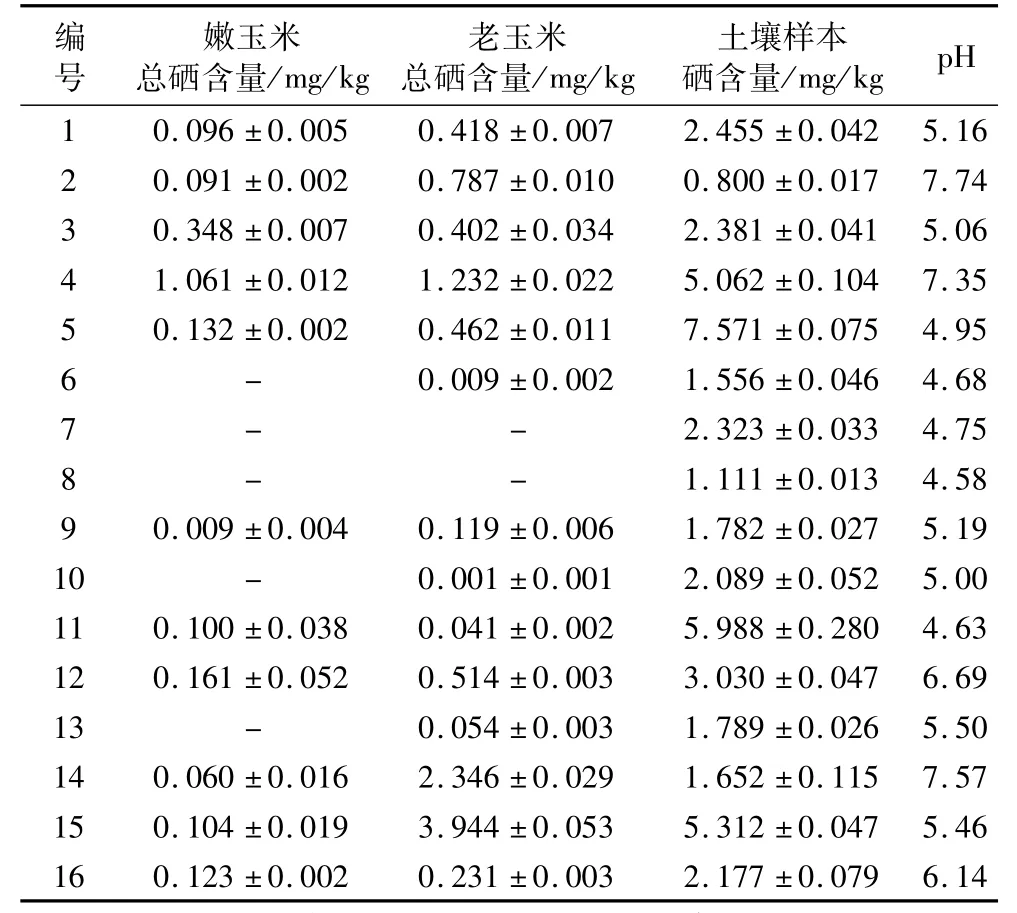
表2 不同产地玉米样本、土壤硒含量以及土壤pH
同时,生长于同一地区的嫩玉米与老玉米因收获时间不同硒含量存在一定差异,除11号玉米样品外,其他批次老玉米样品其硒含量均高于嫩玉米,说明延长种植时间可促进玉米对硒的吸收。但这种促进作用在不同批次玉米样品也中表现出了较大的差异性,如3号玉米样品老玉米硒含量相对于嫩玉米仅增加了15.5%,而15号玉米样品老玉米硒含量相对于嫩玉米增幅达3 692.31%,说明生长时间对不同种植地点玉米其硒含量增幅的影响存在较大差异。
由表3可知,蛋白是玉米中硒含量最高的组分,未检出硒的玉米样本其蛋白可检出少量硒。嫩玉米蛋白中硒含量最高的为4号样品,其含量硒为11.188 mg/kg;中位数为1号嫩玉米蛋白和16号嫩玉米蛋白样品,其硒含量分别为1.513 mg/kg和1.476 mg/kg。老玉米蛋白中硒含量最高的为14号样品,达17.009 mg/kg;中位数为1号老玉米蛋白和16号老玉米蛋白2.295 mg/kg 和1.754 mg/kg。

表3 不同产地玉米蛋白、多糖硒含量
玉米多糖中硒含量少于蛋白硒含量。其中嫩玉米多糖硒含量最高的为4号样品,其含硒量为4.434 mg/kg;中位数为9号嫩玉米多糖和10号嫩玉米多糖样品,其硒含量分别为0.158 mg/kg和0.160 mg/kg。老玉米多糖中硒含量最高的为14号样品,其硒含量为7.763 mg/kg;中位数为5号老玉米多糖和16号老玉米多糖样品,硒含量分别为0.987 mg/kg 和0.872 mg/kg。
总体而言,老玉米蛋白硒和多糖硒含量高于嫩玉米,且玉米中蛋白硒含量、多糖硒含量与总硒的变化趋势较为一致,蛋白硒和多糖硒较高的样品总硒含量也较高,反之亦然。说明在不同产品批次中硒在蛋白和多糖中的赋存比例较为一致。相对于玉米籽粒而言,玉米蛋白和多糖均具有很高的含硒量,且玉米蛋白相较于多糖硒含量更高,提取更容易,故硒蛋白及以其为原料制备的硒多肽将是玉米中最具开发潜力的含硒生物活性物质。
2.2 土壤样本中硒含量和pH值测定结果
由表2可知,不同玉米种植地区土壤样本硒含量也存在一定差异,但其波动性比玉米中硒含量波动性小,5号地区土壤硒含量最高,为7.571 mg/kg,2号地区土壤硒含量最低,为0.800 mg/kg。富硒土壤标准为含量大于0.4 mg/kg[14],据此可知本研究采集的全部土壤样本都达到了富硒土壤标准。
如表2所示,土壤样本pH大多偏酸性,仅2、4、14共3个土壤样本呈弱碱性。从表3可知,土壤pH与土壤硒含量之间并无明显关系,但pH可能影响土壤中硒的存在形式[15]、土壤肥力、微生物活动、有机质的分解与合成等,从而影响玉米对硒的吸收。为了进一步研究土壤因素对玉米中硒含量的影响,现计算与土壤样品一同采集的16批老玉米样品的硒富集系数并作图(图1)。


图1 玉米硒富集系数与土壤pH值
由图1可知,土壤pH与玉米硒富集系数有较强的相关性。其中在2、4、14号3个pH>7.00的弱碱性土壤样本上生长的玉米硒富集系数较高,这说明碱性土壤环境有利于玉米对硒的吸收。4号样品硒富集系数相对于2号和14号偏低可能是由于4号土壤样本含硒量达5.062 mg/kg,远高于2号和14号土壤样本的0.800 mg/kg和1.652 mg/kg的缘故;玉米作为一种非聚硒植物,其对硒的吸收能力有限,最终导致土壤中的硒呈过饱和状态,故硒富集系数有所下降。对于5、6、7、8、10、11 号土壤样品,其pH 值在4.58~5.00之间,为所有样品中土壤酸度最强的批次;而生长在这些土壤样本上的玉米对硒的富集系数也是所有样品中最低的;这表明玉米在酸性环境中富集硒的能力受到了严重限制。其他pH值在5.00~7.00之间的土壤样品对应的玉米硒富集系数处于中等水平。
土壤pH是影响玉米硒富集能力的一个重要因素。通常认为适宜玉米生长的土壤pH范围为5~8。本研究结果表明,可通过对富硒土壤进行适当碱化处理,使玉米中的硒含量大幅提升。不适宜的pH环境对K、Ca、Mg、S、P、N 等玉米生长所需的各种元素的生物有效性均有负面影响,同时还可能影响土壤性质、土壤微生物的活动、肥料的利用率以及作物对养分的吸收[16]。另一方面,硒在土壤中的存在形式也是影响植物吸收的一个重要因素,土壤中的硒是以无机化合物的形式被植物吸收利用的。其中Se6+和Se4+都是植物较易于吸收的形式,但Se6+因具有较高的可溶性,更易被植物利用。在酸性与中性条件下,硒主要以Se4+形式存在。有研究表明,Se4+在酸性至近中性的土壤中易与铁结合,形成难溶的复合物,这种复合作用会随着pH的升高而降低,从而释放出更多的Se4+[15]。同时,随着pH值的升高,更多的硒被氧化成Se6+形式,从而使硒的生物利用率大幅增加。因此,就提高玉米中硒的含量而言,必须选择土壤弱碱性且土壤中硒含量达到富硒标准的种植地。
2.3 CPs抗氧化活性
2.3.1 H2O2处理对HepG2细胞损伤的量效关系
如图2所示,用100~800 μmol/L H2O2处理HepG2细胞2 h后,细胞存活率分别为86.65%、66.96%、66.31%、63.60%、60.91%,且H2O2浓度在200~600μmol/L范围内细胞存活率变化趋于平缓,故本研究采用400μmol/L H2O2处理作为细胞氧化损伤模型。

图2 不同浓度H2 O2作用2 h对HepG2细胞存活率影响
2.3.2 CPs预处理对H2O2诱导HepG2细胞损伤的保护作用
为了研究高硒和低硒CPs预处理对于细胞氧化损伤的保护作用,本研究选用从恩施地区采集的样品中硒含量最高(17.009 mg/kg)和最低(0.002 mg/kg)的2组蛋白样品制成的CPs在H2O2损伤前先对HepG2细胞进行24 h预处理,结果如图3所示。
由图3可知,经不同浓度CPs预处理后的HepG2细胞存活率均有一定程度的上升,并表现出良好的量效关系。其中200、500、800μg/mL剂量的高硒CPs和500μg/mL剂量的低硒CPs均能极显著(P<0.01)提高细胞存活率,且高硒CPs和低硒CPs组最佳预处理浓度均为500μg/mL。在有效浓度范围内,相同剂量下的高硒CPs相对于低硒CPs细胞存活率有显著提升(P<0.05),其中500μg/mL高硒CPs组细胞存活率提升达24.16%,说明硒对玉米肽的活性有增效作用。
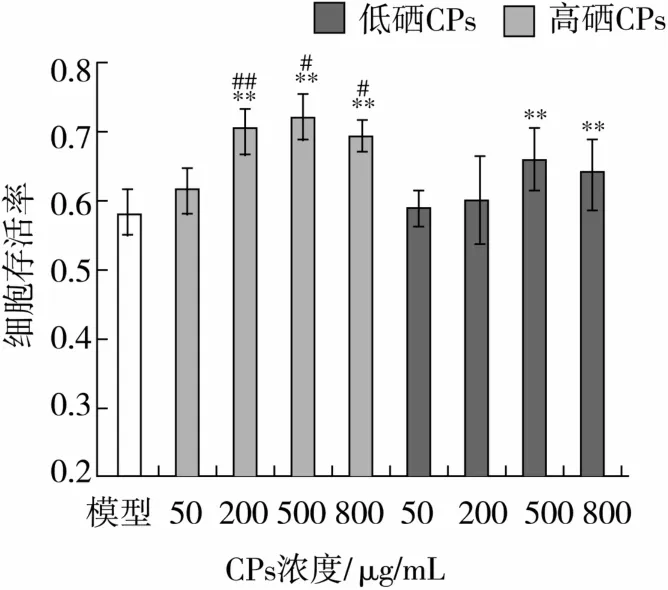
图3 不同浓度CPs预处理对H2 O2损伤HepG2细胞的影响
3 结论
生长在鱼塘坝附近不同区域的玉米硒含量存在较大差异,提前收获的嫩玉米硒含量少于老玉米。玉米蛋白和多糖中硒含量均很高,具有良好的开发利用潜力。本试验中16批玉米种植地土壤样本均达到富硒土壤标准(>0.4 mg/kg),但大部分土壤偏酸性,仅3批土壤样本呈弱碱性。土壤酸碱性影响玉米的硒富集能力有重大影响。酸性至近中性土壤不利于玉米对硒的吸收,玉米在弱碱性土壤中表现出对硒良好的吸收能力。高硒玉米和低硒玉米制成的玉米肽均表现出较好的抗氧化能力,在HepG2细胞抗氧化模型中500μg/mL浓度为玉米肽最佳抗氧化浓度,且高硒玉米肽抗氧化活性显著高于低硒玉米肽,在该浓度下,经过高硒玉米肽预处理的细胞存活率增加了24.16%。
[1]Amaral A F S,Cantor K P,Silverman D T,et al.Selenium and bladder cancer risk:a meta-analysis [J].Cancer Epidemiology Biomarker& Prevention,2010,19(9):2407-2415
[2]Laffon B,Valdiglesias V,Pásaro E,et al.The organic selenium compound seleomethionine modulates bleomycin-induced DNA damage and repair in human leukocytes [J].Biological Trace Element Research,2010,133(1):12-19
[3]Lubos E,Sinning C,Schnabel RB,et al.Serum selenium and prognosis in cardiovascular disease:results from the Athero gene study [J].Atherosclerosis,2010,209(1):271-277
[4]Liu K,Zhao Y,Chen F,et al.Purification,identification,and in vitro antioxidant activities of selenium-containing proteins from selenium-enriched brown rice [J].European Food Research and Technology,2012,234(1):61-68
[5]Trevisan R,Mello D F,Fisher A S,et al.Selenium in water enhances antioxidant defenses and protects against copperinduced DNA damage in the blue mussel Mytilus edulis [J].Aquatic Toxicology,2011,101(1):64-71
[6]Zhu J M,Zheng B S.Distribution of selenium in a minilandscape of Yutangba,Enshi,Hubei Province,China [J].Applied Geochemistry,2001,16(16):1333-1344
[7]杨德平.恩施主要栽培作物中富硒研究进展[J].恩施职业技术学院学报,2014,26(3):58-62
Yang D P.Progress in selenium_enriched research of mainly cultivated crops in Enshi[J].Journal of Enshi Technical College,2014,26(3):58-62
[8]张岩.富硒玉米肽的保肝活性及理化性质研究[D].武汉:华中农业大学,2014
Zhang Y.Hepatoprotective activities,physical and chemical properties of selenium-enriched corn peptides[D].Wuhan:Huazhong Agricultural University,2014
[9]王真真,张久亮,王驰,等.富硒玉米蛋白水解物中硒肽及含硒氨基酸的结构鉴定[J].食品科学,2013,34(9):1-4
Wang Z Z,Zhang J L,Wang C,et al.Structural identification of seleno-peptides and seleno-amino acids in Seriched corn protein hydrolysates[J].Food Science,2013,34(9):1-4
[10]王真真,何慧,王驰,等.富硒玉米醒酒肽的制备及活性研究[J]. 食品工业科技,2013,34(18):239-248
Wang Z Z,He H,Wang C,et al.Study on preparation and activity of the selenium-enriched corn peptides facilitating alcohol metabolism[J].Science and Technology of Food Industry,2013,34(18):239-248
[11]唐宁.玉米抗氧化肽的制备、分离纯化及结构鉴定[D].长春:吉林大学,2014
Tang N.Preparation,purification and identification of antioxidant peptides from corn gluten meal[D].Changchun:Jilin University,2014
[12]吴欣欣.玉米蛋白酶解物抗氧化活性研究[D].郑州:河南工业大学,2013
Wu X X.Study on the antioxidantive activity of enzymatic hydrolysates of corn proteins[D].Zhengzhou:Henan University of Technology,2013
[13]代衍峰.抗氧化玉米肽的制备及其功能与结构关系的研究[D].无锡:江南大学,2008
Dai Y F.The preparation of antioxidative peptides from zein and its relationship between structure and functionality[D].Wuxi:Jiangnan University,2008
[14]郭宇,鲍征宇,马真真,等.湖北恩施地区土壤-植物系统中Se元素的地球化学特征[J].地质通报,2012,31(1):151-155
Guo Y,Bao Z Y,Ma Z Z,et al.Geochemical characteristics of selenium in the soil-plants system of Enshi area,Hubei Province[J].Geological Bulletin of China,2012,31(1):151-155
[15]徐文.硒的生物有效性及植物对硒的吸收[J].安徽农学通报,2009,15(23):46-47,67
Xu W.Bio-availability of selenium and its absorption for plants[J].Anhui Agricultural Science Bulletin,2009,15(23):46-47,67.
Study on Selenium Enrichment of Corn in Yutangba,Enshi and the Antioxidant Activity of the Corn Peptides
Wang Chi He Hui Zhang Jiuliang Hou Tao Shi Wen Liu Weiwei
(College of Food Science and Technology,Huazhong Agricultural University,Key Laboratory of Environment Correlative Dietology Ministry of Education,Wuhan 430070)
In order to study the distributional characteristic of selenium in Yutangba,Enshi,the effects of soil on the selenium content of corn and the relationship between the selenium content and the antioxidant activity of corn peptides,the fine maize variety Xiangyu No.10 was chosen to be planted in 16 places near Yutangba and be collected in 2 seasons.Then,the selenium content of the corn,protein and polysaccharide in these corns was analyzed by the atomic fluorescent spectrometry.The selenium content and pH value of the soil samples collected from the cultivated fields were measured at the same time.The antioxidant capacities of high selenium CPs and low selenium CPs were researched according to the HepG2 body hepatoma cell model.The results showed that all the soil samples were up to the standard of selenium-enriched soil(0.4 mg/kg),however,the selenium content of the corns planted on these soils were quite different between each other,the selenium content,growing time and the pH value of the soil had combined impacts on the selenium enrichment of corn,and protein and polysaccharide in the corn had high selenium content.The corn peptides made by high selenium corn and low selenium corn showed a good antioxidant ability.While the former was significantly stronger(P <0.05),in the HepG2 cell model,the optimum antioxidant concentration of corn peptide was500 μg/mL;compared to processing group of lower selenium corn peptide,the cell viability preprocessed by high selenium corn peptide increased by 24.16%.In conclusion,the soil whose pH was below 5 had severe inhibiting effect on ability of corn absorbing selenium,the slightly alkaline soil was more suitable for the corn using selenium.The corns harvested later had a higher content of selenium;the antioxidant ability of corn peptides with high selenium level was significantly stronger than the ones with lower selenium level.
Yutangba,selenium-enriched corn,corn peptides,antioxidant activity,soil
Q514
A
1003-0174(2016)09-0075-06
国家自然科学基金(30972043),中央高校基本科研业务费专项(2013PY095)
2015-01-15
王驰,男,1990年出生,硕士,食品化学
张久亮,男,1982年出生,副教授,天然活性成分研究与开发

