收获时期及储藏温度对黑小麦籽粒酚酸及组分的影响
李耀光 秦海霞 丁会纳 马冬云,2 孙德祥 王晨阳,2 郭天财,2
收获时期及储藏温度对黑小麦籽粒酚酸及组分的影响
李耀光1秦海霞1丁会纳1马冬云1,2孙德祥1王晨阳1,2郭天财1,2
(河南农业大学农学院1,郑州 450002)
(河南粮食作物协同创新中心2,郑州 450002)
为了阐明收获时期和储藏温度对黑小麦籽粒酚酸含量及抗氧化活性的影响,为提高小麦营养品质提供参考依据。对不同收获时期(蜡熟末期和完熟期)及储藏温度(4、25和45℃)下黑小麦籽粒中总酚、总类黄酮含量、酚酸组分及抗氧化活性进行了分析。结果表明,蜡熟末期收获籽粒中总类黄酮含量、抗氧化活性(FRAP值)显著高于完熟期样品。对于酚酸组分而言,不管是不溶性束缚型还是可溶性共价态,阿魏酸和对香豆酸均表现为蜡熟期收获籽粒显著高于完熟期籽粒。在45℃条件下储藏小麦籽粒中总酚、总类黄酮含量及抗氧化活性(FRAP值、TEAC值)较高;不溶性束缚型丁香酸、阿魏酸及酚酸总和也表现在45℃储藏时显著高于其他温度。总体而言,小麦在蜡熟末期收获可以最大程度保持籽粒中酚酸含量;而在收获后45℃储藏则有助于提高籽粒中酚酸含量,有利于小麦营养品质的改善。
黑小麦 收获时期 储藏温度 抗氧化 酚酸
研究表明人体的衰老,慢性病的发生多半与自由基相关,而食物中的酚酸、黄酮、VC、VE等抗氧化物质能够有效清除自由基,保卫人体健康[1]。已有研究发现相比果蔬中的抗氧化物质,谷物中的抗氧化物质具有货架期长,容易保存,具有特殊活性成分等特点,且作为日常食用的主食更容易为人们长期大量食用[2]。小麦作为人类的主粮之一,不仅能提供淀粉、蛋白质等能量物质,而且还含有多种生物活性成分,例如酚酸、黄酮等。小麦中酚酸含量丰富,约为0.5 mg/g小麦[3]。酚酸约占植物源食品中酚类化合物的1/3,植物源酚酸主要以游离型和束缚型的形式存在,束缚型酚酸通常以酯键、醚键与果皮、糊粉层中的阿拉伯木聚糖和阿拉伯半乳糖结合[4]。小麦中常见酚酸主要有羟化肉桂酸和羟化苯甲酸两种,其中羟化肉桂酸衍生物有阿魏酸、对香豆酸、咖啡酸等;而羟化的苯甲酸衍生物常见的有对羟基苯甲酸、香草酸、丁香酸和原儿茶酸[5]。
黑小麦作为一类重要的黑色食品资源,以其较高营养价值和特殊加工用途而备受人们青睐,成为食品工业研究的新热点,目前已有黑小麦馒头、黑麦面包等黑小麦食品得以研究与开发[6]。黑小麦不仅具有普通小麦的一般特征,还具有独特的营养和保健功能,黑小麦品种含有较普通白粒小麦高的酚酸、类黄酮和花青素等抗氧化物质[7]。因此,开展黑小麦抗氧化能力的研究有助于黑小麦品质的进一步开发利用。
收获是小麦种植的最后一道工序,不同收获时期对小麦千粒重及品质均有影响[8]。一般在蜡熟末期收获的小麦籽粒千粒重较高,而在完熟期收获的小麦籽粒千粒重会有所下降。小麦收获后的不同储藏时间及温度也会对小麦品质产生影响,研究表明不同储藏时间影响小麦水分、蛋白质含量、淀粉糊化特性及脂肪酸值等[9-10]。但关于黑小麦籽粒在不同储藏条件下籽粒抗氧化物质含量及活性的研究鲜有报道。因此,研究不同收获时期及不同储藏温度下黑小麦籽粒抗氧化物质含量及抗氧化活性的变化,以期探明黑小麦最佳收获时期和最适储藏温度,以便最大限度地保留黑小麦的抗氧化活性,为生产和储藏优质营养抗氧化性高的小麦产品提供依据。
1 材料与方法
1.1 主要试剂与仪器设备
浓盐酸、氢氧化钠、碳酸钠。
DHG-9030A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限公司;BCD-241TMBA冰箱:海尔集团;TTL-DC II型氮吹仪:北京同泰联科技发展有限公司;Waters 515型高效液相色谱:Waters公司。
1.2 试验方法
1.2.1 材料与方法
小麦品种采用新周黑1号,于2013年10月种植于河南农业大学试验农场,2014年6月收获。不同收获时期分为2个处理:蜡熟末期收获;完熟期收获。
采用完熟期收获的小麦籽粒进行储藏温度试验。储藏温度处理分为3个温度:4、25、45℃,籽粒从完熟期收获后即开始不同温度储藏,储藏时间为60 d,然后对小麦籽粒进行磨粉。
1.2.2 全麦粉制备
采用旋风磨(CyclotecTM1093 FOSS,瑞士)研磨粉碎小麦籽粒,获得的全麦粉过80目筛网后用于后续分析。
1.2.3 总酚含量的测定
母液的制备:准确称取1 g样品,加入10 mL含1%盐酸的甲醇,24℃提取24 h,离心4 000 g,10 min,取上清液,重复2次,合并上清液,避光冷藏。
采用Folin-Ciocalteau法[11]有所修改。准确称取0.500 g全麦粉,加入8 mL甲醇(含1% 盐酸),
24℃下振荡提取24 h;3 500 g离心10 min,取上清液,重复2次,合并上清液,避光冷藏。取1 mL上述提取液,置10 mL容量瓶中,加1 mol/L福林酚试剂(Folin-Ciocalteau)2.5 mL,用10%碳酸钠溶液定容,35℃温育2 h,测定765 nm处吸光值,以没食子酸为标品做绘制标准曲线。
1.2.4 总类黄酮含量的测定
参照Benzie等[12]描述的方法加以修改,取提取液0.5 mL于试管中,加入2 mL双蒸水5%亚硝酸钠溶液0.15 mL,混匀静置5 min;加10%六水氯化铝溶液0.15 mL,混匀静置5 min;再加1 mol/L氢氧化钠溶液1 mL,静置15 min;测定415 nm处的吸光值,试剂空白为对照,以芦丁为标品绘制标准曲线。
1.2.5 抗氧化活性的测定
TEAC法:首先配制ABTS+试剂。取140 mmol/L过硫酸钾88μL与7 mmol/L ABTS溶液5 mL混合,避光反应16 h,然后用乙醇稀释该溶液至吸光度为0.700±0.002。按照Miller等[11]的方法,将提取液适当稀释后取0.1 mL,加ABTS+试剂3.9 mL,混合均匀,室温放置6 min,立即测定734 nm下的吸光值。以Trolox(维生素E水溶性类似物)为标品绘制标准曲线。
FRAP法:首先配制TPTZ工作液。取0.3 mol/L醋酸盐缓冲溶液25 mL,10 mmol/L TPTZ溶液2.5 mL,20 mmol/L FeCl3溶液2.5 mL 混合均匀,避光放置。参考Benzie等[12]的方法修改,量取0.1 mL的全麦粉提取液,加入3 mL FRAP工作液,再加入0.3 mL超纯水,混匀后反应5 min,于593 nm处测定吸光度。以FeSO4为标品绘制标准曲线。
1.2.6 酚酸组分的测定
可溶性共价态酚酸的提取:全麦粉经丙酮/甲醇/水(7∶7∶6)混合液提取后得到上清液,取1.5 mL 2 mol/L NaOH溶液,置于50℃水浴锅中水解4 h,冷却后滴入1.65 mL 6 mol/L HCl,以5 mL 乙醚/乙酸乙酯混合液(1∶1,V/V)萃取,重复3 次,将分液得到的有机相合并,以氮气吹干有机相,得到的残留物为结合态酚酸,将其溶于1 mL甲醇中待测。
不溶性束缚型酚酸的提取:全麦粉经丙酮/甲醇/水(7∶7∶6)混合液提取后得到残渣,加入10 mL 2 mol/L NaOH溶液水解12 h,离心后取上清液。准确移取1 mL 上清液,加入300 μL 6 mol/L HCl,以5 mL乙醚/乙酸乙酯混合液(1∶1,V/V)萃取,重复3次,将分液得到的有机相合并,以氮气吹干有机相,得到的残留物为结合态酚酸,将其溶于1 mL甲醇中待测。
参考吕俊丽[13]的方法,提取分离得到可溶性共价态酚酸和不溶性束缚型酚酸的样品溶于甲醇后,用0.2μm的微孔滤膜过滤后,用waters 515液相色谱仪进行分析。
2 结果分析
2.1 不同收获时期对黑小麦籽粒总酚、总类黄酮含量及酚酸组分的影响
从图1可以看出,蜡熟末期收获的黑小麦籽粒和完熟期收获籽粒中总酚含量没有显著差异,分别为1 283.41 μg/g和为1 245.15 μg/g。而蜡熟末期收获的籽粒中的总类黄酮含量(684.44μg/g)显著高于完熟期收获籽粒的总类黄酮含量(524.01 μg/g)。
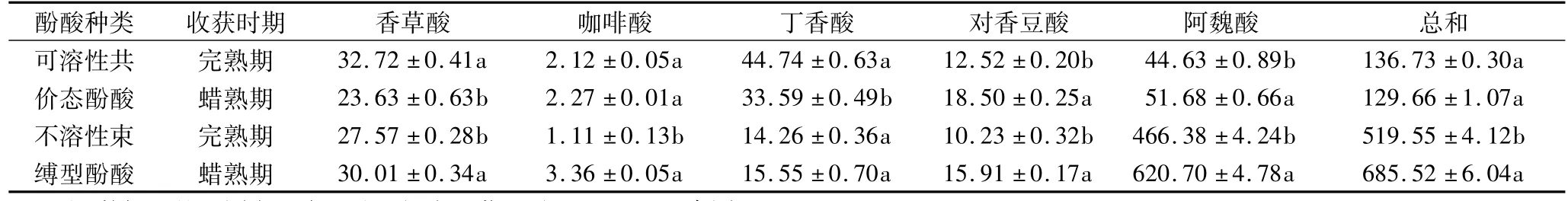
表1 不同收获时期黑小麦籽粒可溶性共价结合酚与不溶性束缚酚含量/μg/g

图1 不同收获时期黑小麦籽粒总酚与总黄酮含量图
由表1可见,不同酚酸种类中各酚酸组分的含量并不相同,同一收获时期籽粒中不溶性束缚型酚酸含量约为可溶性共价结合态酚酸含量的4~5倍。在可溶性共价态酚酸中,阿魏酸和丁香酸为主要酚酸,其中阿魏酸占32.64%~39.86%,丁香酸占25.90%~32.72%;而不溶性束缚型酚酸中,阿魏酸占89.77%~90.54%。对于不同种类的酚酸组分而言,2个收获时期间的表现也并不完全相同。可溶性共价态酚酸总和在2种收获时期之间没有显著差异,但不溶性束缚型酚酸总和则表现为蜡熟期收获的籽粒显著高于晚熟期收获的籽粒。对于酚酸组分而言,不同收获时期的影响也存在差异。对于不溶性束缚型酚酸中的香草酸、咖啡酸、丁香酸、对香豆酸和阿魏酸而言,均表现为蜡熟期收获籽粒显著高于完熟期收获籽粒。但可溶性共价态酚酸中的香草酸和丁香酸则表现为完熟期收获籽粒显著高于蜡熟期收获籽粒;阿魏酸和对香豆酸则为蜡熟期籽粒显著高于完熟期收获的籽粒。
2.2 不同收获时期对黑小麦籽粒抗氧化活性的影响
分别采用2种不同抗氧化活性测定方法测定小麦籽粒中抗氧化活性(图2、图3)。由图2可见,蜡熟期收获小麦籽粒中抗氧化活性(FRAP值)显著高于完熟期收获的小麦籽粒,FRAP值分别为15.48 μmol FeSO4/g和14.27 μmol FeSO4/g。而采用TEAC法测定,则2种收获方式下小麦籽粒的抗氧化活性没有显著差异。

图2 不同收获时期黑小麦籽粒抗氧化活性(FRAP值)
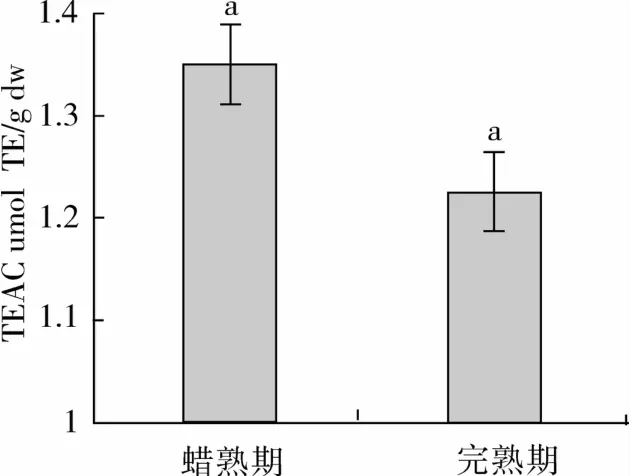
图3 不同收获时期黑小麦籽粒抗氧化活性(TEAC值)
2.3 不同储藏温度对黑小麦籽粒总酚、总类黄酮含量及酚酸组分的影响
从图4可见,不同储藏温度对籽粒总酚和总类黄酮的影响不完全相同。总酚含量表现为45℃下显著高于4℃储藏条件下的含量;而储藏温度对黑小麦总类黄酮含量的影响表现为4℃(623.73μg/g)和45℃(630.24μg/g)储存条件下显著高于常温储藏籽粒中的含量。

图4 不同储藏温度下黑小麦籽粒总酚和总类黄酮含量

表2 不同储藏温度下黑小麦籽粒可溶性共价结合酚与不溶性束缚酚含量
表2中数据表明,不同酚酸种类、酚酸组分在不同储藏温度下的变化不完全相同,其中可溶性共价态酚酸总和表现为25℃和45℃条件下较高,而4℃下较低,差异达显著水平;而不溶性束缚型酚酸总和表现为45℃条件下显著高于25℃和4℃条件下储藏的籽粒,表明较高的储藏温度可能有利于总酚酸的积累。对于酚酸组分而言,2种类型的对香豆酸均在45℃条件下最高,而不溶性束缚型阿魏酸、咖啡酸、丁香酸也表现为45℃条件下含量最高。对于可溶性共价态咖啡酸、丁香酸、阿魏酸则表现为25℃条件下含量显著高于其他储藏温度下的籽粒。表明适宜增加温度有利于咖啡酸、丁香酸、阿魏酸的积累,尤其是不溶性束缚型酚酸类型。
2.4 同储藏温度对黑小麦籽粒抗氧化活性的影响
图5和图6分别是FRAP法和TEAC法测定籽粒中抗氧化活性的变化。从图5、图6可见,2种测定方法下,抗氧化活性在不同储藏温度下的变化并不完全相同,但均表现为45℃储藏条件下籽粒抗氧化性显著高于其他2个温度条件下的值。

图5 不同储藏温度黑小麦籽粒FRAP值

图6 不同储藏温度黑小麦籽粒TEAC值
3 讨论
不同储藏温度对谷物的脂肪酸含量、蛋白质含量、氨基酸含量、发芽率等品质的变化均有比较大影响。不同加热程度,对不同植物的抗氧化物含量及抗氧化活性也有较大影响[14-16]。有研究表明较高温度处理可能加速氧化反应,或者其他降解反应从而使食品的抗氧化活性下降,但是适度的热处理和储藏则有可能使植物中的抗氧化物质得到释放,从而增加其抗氧化活性[17]。本研究表明45℃储藏温度条件下小麦籽粒中的抗氧化活性最高,这与Cheng等[18]的研究结果一致,这可能是由于在较温和的加热条件下,小麦麸皮中的抗氧化物质比较容易从戊聚糖中释放出来,从而增加其抗氧化活性。同时,本研究发现可溶性共价态酚酸总和及其多种酚酸组分在25℃储藏时含量最高,表明可溶性共价态酚酸与不溶性束缚型酚酸对储藏温度的反应存在差异,这可能是由于较高温度储藏时,小麦籽粒中的一些氧化反应、品质劣变反应加剧,利用可溶性酚酸进行抗氧化反应,从而降低了其含量。
小麦籽粒收获一般在蜡熟末期进行人工收获,而完熟期由于籽粒水分含量低,茎秆干枯适宜机械收获。研究表明蜡熟期收获小麦籽粒较乳熟期小麦籽粒具有高的蛋白质含量和面筋含量[8];而完熟期收获的小麦籽粒千粒重较蜡熟期籽粒有所降低。本研究结果表明蜡熟期小麦籽粒总类黄酮含量、总酚酸含量以及抗氧化活性(FRAP值)显著高于完熟期收获小麦籽粒。这可能是由于籽粒在蜡熟末期已达到生理成熟期,籽粒中的营养物质积累到最高峰,品质最好。到了完熟期后,小麦的根、茎、叶先后干枯,不能再制造养分,但它仍然进行呼吸,需要消耗养分,籽粒中部分养分会水解倒流,影响籽粒粒重及品质。籽粒中抗氧化物质也极有可能参与籽粒本身的抗衰老过程,含量减少。这与冬小麦不同收获期间千粒重的差异表现一致,蜡熟末期到完熟期小麦籽粒千粒重下降,籽粒品质降低,因此蜡熟末期收获能够得到较高产量与品质的小麦[19]。同时,本研究发现蜡熟期收获籽粒中抗氧化活性(FRAP值)显著高于完熟期籽粒,但TEAC值在2种收获方式之间没有显著差异,这可能与2种测试方法有关;FRAP值主要与电荷有关的抗氧化物相关,而TEAC值主要与样品中抗氧化成分相关,但一些对抗氧化不起作用的羟基会干扰试验结果。
无论是不同的储藏温度,还是收获时期,黑小麦籽粒中酚酸均表现为不溶性束缚型酚酸含量较可溶性共价态酚酸高。这主要是由于不溶型束缚型酚酸是小麦中酚酸的主要存在形式,结合于小麦麸皮中。但是不同种类的酚酸含量差异显著,这与吕俊丽的研究结果一致[13]。本试验中黑小麦籽粒中的含量最高的酚酸是不溶性束缚型阿魏酸,含量在620~466 μg/g 之间,高于Okarter等[20]的研究结果,这可能是由于本试验采取的提取方法与之不同。研究表明采用不同的溶剂进行萃取,所得酚类化合物的含量会明显不同[21]。且本试验中采取的小麦品种为新周黑1号,为黑色小麦,而Okarter等试验中所用6种小麦为白粒小麦或红粒小麦,因此品种间的差异也可能是造成阿魏酸含量差异的另一个原因。
4 结论
黑小麦在蜡熟末期收获较完熟期收获可以最大程度保持籽粒中酚酸含量,提高抗氧化性;黑小麦籽粒收获后45℃储藏(60 d)有助于提高籽粒中酚酸含量,有利于小麦营养品质的改善。
[1]Hertog M G,Feskens E J,Hollman P C et al.Dietary antioxidant flavonoids and risk of coronary heart disease:the Zutphen Elderly Study[J].The Lancet,1993,342:1007-1011
[2]龚二生,罗舜菁,刘成梅.全谷物抗氧化活性研究进展[J]. 食品工业科技,2013,34(2):364-369
Gong E S,Luo SQ,Liu CM.Research progress in antioxidant activity of whole grain[J].Science and Technology of Food Industry,2013,34(2):364-369
[3]Liu R H.Whole grain phytochemicals and health[J].Journal of Cereal Science,2007,46(3):207-219
[4]Xu G H,Ye X Q,Chen J C,et a1.Effect of heat treatment on the phenolic compounds and antioxidant capacity of citrus peel extract[J].Journal of Agricultural and Food Chemistry,2007,55:330-335
[5]Hernández L,Afonso D,Rodríguez M E,et al.Phenolic compounds in wheat grain cultivars[J].Plant Foods Human Nutrition,2011,66:408-415
[6]陈志成,秦秋萍.黑小麦系列食品的研究与开发[J].粮食加工,2005(3):33-48
Chen Z C,Qin Q P.Study and develop on series of food of rye[J].Grain Processing,2005(3):33-48
[7]Hosseinian F S,Li W D,Beta T.Measurement of anthocyanins and other phytochemicals in purple wheat[J].Food Chemistry,2008,109:916-924
[8]王东,于振文,张永丽,等.收获时期对优质强筋冬小麦籽粒产量和品质的影响[J].山东农业科学,2003,5:8-9
Wang D,Yu Z W,Zhang Y L et al.Effects of harvest stage on kernel yield and quality of winter wheat with high quality and strong gluten[J].Shandong Agricultural Science,2003,5:8-9
[9]张玉荣,刘月婷,张德伟,等.小麦中淀粉在不同储藏温湿度下糊化特性的变化[J].河南工业大学学报(自然科学版),2014,35(2):10-15
Zhang Y R,Liu Y T,Zhang DW,et al.Changes on pasting properties of wheat starch under different storage temperature and humidity[J].Journal of Henan University of Technology(Natural Science Edition),2014,35(2):10-15
[10]钟建军,吕建华,谢更祥,等.不同储藏方式对小麦粉水分、脂肪酸值和白度的影响[J].粮食与饲料工业,2013,2:13-15
Zhong JJ,Lü JH,Xie G X,et al.Effect of different storage methods on moisture,fatty acid values and whiteness of wheat flour[J].Cereal and Food Industry,2013,2:13-15
[11]Miller N J,Rice E C,Diplock A T,et al.A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J].Clinical Science,1993,84:407-412
[12]Benzie I F,Strain J J.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:the FRAPassay [J].Analytical Biochemistry,1996,239(1):70-76
[13]吕俊丽.美国马里兰不同品种小麦抗氧化成分分析与功能性评价[D].杨凌:西北农林科技大学,2013
Lv JL.Antioxidant component analysis and functional evaluation of different genotype wheat in Maryland[D].Yang ling:Northwest A&F University,2013
[14]王明洁,蒋甜燕,袁建,等.不同储藏温、湿度条件下小麦粉脂肪酸值的变化[J].中国粮油学报,2010,25(9):71-75
Wang M J,Jiang T Y,Yuan J,et al.Change of fatty acid value of wheat flour during storage at different temperature and relative humidity[J].Journal of the Chinese Cereals and Oils Association,2010,25(9):71-75
[15]Larrauri J A ,Ruperez P ,Saura-Calixto F.Effect of drying temperature on the stability of polyphenols and antioxidant activity of red grape pomace peels [J].Journal of Agricultural and Food Chemistry,1997,45:1390-1393
[16]Van der Sluis A A ,Dekker M ,Van Boekel M A JS.Activity and concentration of polyphenolic antioxidant in apple juice.3.Stability during storage[J].Journal of Agricultural and Food Chemistry,2005,53:1073-1080
[17]陈中伟,廉文蕾,吴保承,等.小麦麸皮结构层中抗氧化物质的研究[J].食品工业科技,2012,23:66-68
Chen Z W,Lian W L,Wu B C,et al.Research on antioxidant substance extracted from different wheat bran structure layers [J].Science and Technology of Food Industry,2012,23:66-68
[18]Cheng Z H,Su L,Jeffery M et al.Effects of postharvest treatment and heat stress on availability of wheat antioxidants[J].Journal of Agricultural and Food Chemistry,2006,54:5623-5629
[19]薛长录,康勤学,张长生.冬小麦不同收获期千粒质量的变化规律研究[J].山西农业科学,2014,42(7):667-668
Xue CL,Kang Q X,Zhang CS,et al.Variation law of different harvesting time on thousand-kernel weight in wheat[J].Journal of Shanxi Agricultural Sciences,2014,42(7):667-668
[20]Okarter N,Liu C S,Sorrells E M,et al.Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J].Food Chemistry,2010,119:249-257
[21]Zhou K,Yu L.Effects of extraction solvent on wheat bran antioxidant activity estimation[J].Food Science and Technology,2004,37(7):717-721.
Effect of Harvest Time and Storage Temperature on Phenolics Acid Content and Its Components of Black Grain Wheat
Li Yaoguang1Qin Haixia1Ding Huina1Ma Dongyun1,2Sun Dexiang1Wang Chenyang1,3Guo Tiancai1,2
(Agronomy College of Henan Agricultural University1,Zhengzhou 450002)
(Crop Coordination Innovation Center in Henan Province2,Zhengzhou 450002)
In order to provide useful information for wheat nutrient quality improvement,the effects of harvest time (dough stage and ripe stage)and storage temperature (4,25,45 ℃)on the content of total flavonoids,total phenolics,antioxidant activity and phenolic acid component of black grain wheat were studied in order to investigate the influence of harvest time and storage temperature on the phenolics acid content and antioxidant activity.The results showed that total flavonoids content and antioxidant activity(FRAP)in wheat grain harvested at dough stage were significantly higher than that of harvested at ripen stage.Ferulic acid and p-coumaric acid both in insoluble bound type and soluble covalent type all showed high value in wheat grain ripened at dough stage.Total phenols,total flavonoids content and antioxidant activity in grains under the temperature of 45℃storage conditions showed the highest value.Correspondingly,the same trend was also showed in insoluble bound phenolic acids,such as syringic acid,ferulic acid.Totally,ripening wheat grains at dough stage would maintain the maximum phenolic acid content,and the grains were stored under 45℃condition would benefit its phenolic acid component and antioxidant activity.
black grain wheat,harvest time,storage temperature,antioxidant activity,phenolic acid
S-3
A
1003-0174(2016)09-0013-06
“十二五”国家科技支撑计划(2012BAD04B07),现代农业产业体系项目(CARS-03)
2015-01-06
李耀光,女,1990年出生,硕士,小麦品质生理
马冬云,女,1972年出生,副研究员,小麦品质生理
郭天财,男,1953年出生,教授,小麦栽培

