副干酪乳杆菌海藻酸钠微胶囊包埋工艺
邹 盈 魏 敏 谢 琪 柳华贵 孟祥河
(1.温州科技职业学院,浙江温州 325105;2.威海市产品质量监督检验所,山东 威海 264200;3.浙江工业大学海洋学院,浙江杭州 310018)
乳酸杆菌是人体中极为重要的益生菌,具有改善胃肠道功能、提高免疫能力、改善机体营养状况等良好机能[1]。但是,由于乳酸杆菌对外部环境比较敏感,使含活菌的产品在生产、贮存和运输过程中,活菌量会迅速减少。此外,当乳酸杆菌活菌制剂进入动物消化道后,因受到胆汁和胃酸等作用,导致到达肠道的活菌数量大为下降,限制了乳酸杆菌益生作用的发挥[2]。因此,利用微胶囊技术保护益生菌可使益生菌保持稳定的状态,使其达到肠道时仍保持活性,从而有效发挥益生功效。
副干酪乳杆菌(Lactobacillus paracasei)属于乳杆菌属中的干酪乳杆菌(Lactobacillus casei)群,是一种新资源食品添加剂,在一定程度上可以起到预防食物过敏、急性腹泻和肿瘤发生等疾病,具有促进身体发育、增强体质、延缓衰老和延长寿命的作用,被广泛应用于L-乳酸的生产、乳制品等食品的发酵、食品的生物保鲜、疫苗的研制、海产品加工废料的再利用等领域[3]。本研究拟以副干酪乳杆菌为对象,采用挤压法比较了不同内层壁材、海藻酸钠和氯化钙的浓度以及不同保护剂对副干酪乳杆菌微胶囊包埋效果的影响,以期为经济、高效的副干酪乳杆菌微胶囊工业化生产提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种与培养基
副干酪乳杆菌(Lactobacillus paracasei):浙江工业大学生物与环境工程学院实验室保藏菌种;
MRS琼脂培养基:MRS液体培养基加入1.8% ~2.0%的琼脂;
增殖培养基:酵母膏 3%、乳糖 2.48%、NH4H2PO40.8%、低聚异麦芽糖 0.5%、马铃薯汁 11.97%,Na2CO3调节pH 6.2 ~6.6,121 ℃灭菌20 min。
1.1.2 仪器与设备
恒温培养箱:SPX-150B-Z型,上海博讯实业有限公司;
超净工作台:SW-CJ-1FD型,上海博讯实业有限公司;
立式压力蒸汽灭菌器:YXQ-LS-50S11型,上海博讯实业有限公司;
紫外可见分光光度计:752型,上海光谱仪器有限公司;
数字酸度计:PHs-3C型,杭州东星仪器设备厂;
高速冷冻离心机:SCR20BC型,日本日立公司;
冷冻干燥机:ALPHA 2-4 LD plus型,德国Christ公司。
1.2 试验方法
1.2.1 菌悬液的制备 将副干酪乳杆菌以1.5%的接种量接种于MRS增殖培养基中37℃静置培养21 h,离心去上清液,收集菌泥用无菌生理盐水洗涤后再次离心,重复两次,用适量无菌生理盐水悬浮菌泥,即为菌悬液。
1.2.2 挤压法制备副干酪乳杆菌微胶囊 将菌悬液与蛋白质壁材、海藻酸钠按菌胶比为1︰1均匀混合—挤压滴入氯化钙溶液—固定30 min—无菌生理盐水洗涤,过滤—收集囊珠。
通过单因素试验分析蛋白分离物(PI)的种类及不同处理方法(PI与无菌水直接混合2 h;PI与无菌水混合2 h后90℃水浴加热30 min;PI与蒸馏水混合4 h后于121℃加热20 min),内层壁材种类(乳清蛋白分离物WPI、大豆蛋白分离物SPI、大米蛋白分离物RPI、明胶、多孔淀粉、糊精),海藻酸钠的质量分数(1%,2%,3%,4%)、氯化钙浓度(0.1,0 .2,0.3,0.4 moL/L),包埋壁材(葡萄糖,乳糖,麦芽糖,蔗糖,大豆低聚糖,低聚异麦芽糖,低聚果糖,海藻糖),其他类保护剂(5%甘露醇,5%山梨醇,2%甘氨酸,2%谷氨酸,5%甘油,1%VC,1%VB)对挤压法制备的副干酪乳杆菌微胶囊效果的影响。
1.3 分析方法
1.3.1 副干酪乳杆菌活菌数计数 采用菌落总数平板计数法[4]。
1.3.2 副干酪乳杆菌微胶囊的破壁 取适量制备的微胶囊置于0.06 moL/L的柠檬酸钠解囊液中,37℃、180 r/min振荡40 min至其完全崩解,以供计数。
1.3.3 微胶囊包埋产率与包埋效率的测定 微胶囊包埋产率与包埋效率分别按式(1)和式(2)计算。

微胶囊中活菌数:取微胶囊0.5 g于50 mL 0.06 moL/L的柠檬酸钠解囊液中,37℃、180 r/min条件下振荡40 min至其完全崩解,取1 mL适当稀释后测活菌数。
微胶囊表面活菌数:取微胶囊0.5 g于50 mL生理盐水中,37℃、180 r/min条件下振荡40 min,取1 mL适当稀释后测活菌数。
1.3.4 副干酪乳杆菌微胶囊在人工胃肠液中的溶出度测定
(1)副干酪乳杆菌微胶囊人工胃肠液耐受性的测定[5]:人工胃液:取稀盐酸16.4 mL(取盐酸234 mL,加水稀释至 1 000 mL),加蒸馏水约800 mL,再加入胃蛋白酶 10 g,搅拌均匀后定容至1 000 mL,pH 1.35。取制备的副干酪乳杆菌微胶囊样品0.1 g置于50 mL人工胃液中,37℃、180 r/min条件下分别震荡处理1,2,3 h后取样测活菌数。
(2)人工肠液中耐受性的测定[6]:人工肠液:取KH2PO46.8 g加水500 mL溶解,用0.l moL/L的NaOH溶液调节 pH至6.8;另取胰蛋白酶10 g加水适量溶解,将两液混合后,定容至1 000 mL。取制备的副干酪乳杆菌微胶囊样品0.1 g置于50 mL人工肠液中,37℃、180 r/min条件下分别震荡处理 15,30,45,60 min 后取样测活菌数。
1.3.5 冻干存活率的测定 冻干存活率按式(3)计算。

干燥后微胶囊的活菌数:取微胶囊0.05 g于50 mL 0.06 moL/L的柠檬酸钠解囊液中,37℃、180 r/min条件下振荡30 min使其完全崩解,取1 mL适当稀释后测活菌数。
2 结果与分析
2.1 副干酪乳杆菌微胶囊内层壁材的选择
2.1.1 分离蛋白壁材及其预处理方法的选择 试验分别研究了以WPI、SPI、RPI为壁材对副干酪乳杆菌包埋效果的影响。热处理会诱导蛋白结构展开并影响蛋白聚集程度从而改善其乳化稳定性。试验探讨了3种预处理方式:a.采用PI与无菌水直接混合搅拌2 h;b.PI与无菌水混合搅拌2 h后90℃水浴加热30 min;c.PI与蒸馏水混合搅拌4 h后于121℃加热20 min。试验中海藻酸钠质量分数为2%,CaCl2浓度溶液浓度为0.1 moL/L。不同PI及处理方式获得的副干酪乳杆菌微胶囊活菌数见图1,包埋产率及包埋效率见表1。由图1和表1可知,PI种类和PI 3种处理方式对挤压法制备副干酪乳杆菌微胶囊的包埋产率及包埋效率影响不大,说明3种分离蛋白与乳酸菌的相容性均较好,而3种处理方式均可实现分离蛋白充分水合并形成稳定的乳化液。对于SPI,c处理包埋效果略优于a、b处理组,说明适当的热处理对经剪切变性的蛋溶胶后期凝胶具有积极意义,此外灭菌处理对于防止乳酸菌污染也是必要的,因此采用PI与蒸馏水混合4 h后121℃加热20 min为后续试验PI的预处理方式。

图1 PI处理方式对副干酪乳杆菌微胶囊包埋活菌数的影响Figure 1 Effect of PI processing on viability of microencapsulated Lactobacillus paracasei
表1 PI处理方式对副干酪乳杆菌微胶囊包埋产率及包埋效率的影响Table 1 Effect of PI processing on yield and efficiency of microencapsules %

表1 PI处理方式对副干酪乳杆菌微胶囊包埋产率及包埋效率的影响Table 1 Effect of PI processing on yield and efficiency of microencapsules %
WPI、SPI、RPI分别为乳清、大豆、大米蛋白分离物。
PI 及处理方式 包埋产率 包埋效率WPI-a 82.14 91.26 WPI-b 78.79 90.32 WPI-c 81.66 90.73 SPI-a 80.52 90.50 SPI-b 79.72 90.67 SPI-c 84.93 91.56 RPI-a 80.21 90.40 RPI-b 78.90 90.79 RPI-c 80.90 90.58
2.1.2 不同内层壁材对副干酪乳杆菌微胶囊包埋效果的影响 分别以3%质量分数的WPI、SPI、RPI、明胶、多孔淀粉、糊精作为内层壁材,在外层壁材海藻酸钠质量分数为2%,CaCl2浓度为0.1 moL/L的条件下采用挤压法制备副干酪乳杆菌微胶囊。由表2可知,明胶的包埋产率最高且明显优于其他壁材,这可能是因为明胶自身的凝胶性可以增强海藻酸钠与氯化钙所形成凝胶珠的稳定性;分离蛋白的效果优于多孔淀粉、糊精以及对照组,这是因为热处理过的蛋白与氯化钙交联生成的凝胶对挤压法制备微胶囊的包埋有一定促进作用,但PI壁材种类对副干酪乳杆菌微胶囊的包埋产率及包埋效率的影响差别不大。
2.1.3 模拟人工胃肠液环境下不同内层壁材对副干酪乳杆菌微胶囊保护效果的影响 副干酪乳杆菌对消化系统中低pH的胃酸等耐受性极差,难以有足够数量到达肠道从而发挥益生作用,而微胶囊的包埋技术能够对副干酪乳酸菌顺利到达肠道起一定保护作用[7]。海藻酸钙凝胶对副干酪乳杆菌虽有较好的包埋效果但对胃酸耐受程度不佳,不能较好地保护副干酪乳杆菌顺利到达肠道。有一定的耐酸性的WPI等蛋白质、多孔淀粉、糊精等物质作为内层壁材在模拟人工胃液环境下对副干酪乳杆菌微胶囊的保护效果见表3。由表3可知,副干酪乳杆菌的存活率随着微胶囊在人工胃液处理时间的延长而降低,人工胃液对微胶囊中的副干酪乳杆菌有一定的损害作用;添加内层壁材微胶囊中的副干酪乳杆菌存活率比未添加的高,说明内层壁材的添加对副干酪乳杆菌微胶囊的耐胃酸程度有促进作用;6种内层壁材中,SPI为内层壁材制备的微胶囊在人工胃液环境中副干酪乳杆菌的存活率最高,WPI和RPI次之,说明分离蛋白对副干酪乳杆菌耐胃酸保护性较好;在明胶、多孔淀粉、糊精为内层壁材制备的微胶囊中,多孔淀粉为内层壁材制备的微胶囊在人工胃液环境中副干酪乳杆菌的存活率较高,这与多孔淀粉的吸附性能一定程度上保护副干酪乳杆菌免受胃酸损害有关。
表2 不同内层壁材对副干酪乳杆菌微胶囊包埋产率及包埋效率的影响Table 2 Effect of inner wall materials on yield and efficiency of microencapsules %

表2 不同内层壁材对副干酪乳杆菌微胶囊包埋产率及包埋效率的影响Table 2 Effect of inner wall materials on yield and efficiency of microencapsules %
WPI、SPI、RPI分别为乳清、大豆、大米蛋白分离物。
内层壁材 包埋产率 包埋效率WPI 78.67 91.01 SPI 82.14 90.79 RPI 76.71 91.27明胶 98.02 92.56多孔淀粉 74.76 91.28糊精 72.41 90.78空白72.74 90.92
由图2可知,制备的所有微胶囊在人工肠液处理45 min时副干酪乳杆菌都能得到基本释放,释放的菌数间没有显著区别(P>0.05),说明内层壁材的添加对副干酪乳杆菌微胶囊的肠溶性没有较大影响,不会对副干酪乳杆菌微胶囊在肠道中释放活菌起限制作用。
2.1.4 冷冻干燥对不同内层壁材副干酪乳杆菌微胶囊的活菌数的影响 冷冻干燥对副干酪乳杆菌的损害性较大,适当的内层壁材对冷冻干燥微胶囊中的副干酪乳杆菌有一定的保护作用。由图3可知,不同内层壁材制备的副干酪乳杆菌微胶囊经冷冻干燥后,副干酪乳杆菌的活菌数下降明显,约为1.5至2个数量级,但存活率明显优对照组。其中SPI作为内层壁材冻干保护效果最好,其次为WPI、RPI、多孔淀粉、糊精、明胶。
由图4可知,内层壁材对改善冷藏过程中冻干微胶囊的活菌存活率有明显改善。其中SPI效果最好,4℃储存28 d存活率为34.67%,其次为 WPI(31.55%)、RPI(26.88%);PI作为内层壁材对副干酪乳杆菌的保护效果明显优于糊精(24.57%)、多孔淀粉(23.21%)和明胶(20.16%),对照组的存活率仅为21.04%。此外,冷冻干燥后处理的微胶囊冷藏存活率要优于未经冷冻干燥的样品,因此采用冷冻干燥工艺处理对于提高微胶囊中副干酪乳杆菌的存活率,延长微胶囊的储存期是必要的。

表3 不同内层壁材微胶囊中的副干酪乳杆菌在人工胃液中的存活率Table 3 Effect of inner wall materials on survival rate of microcapsule in artificial gastric juice

图2 不同内层壁材微胶囊中的副干酪乳杆菌在人工肠液中的释放情况Figure 2 Effect of inner wall materials on releasing rate of microcapsule in artifical intestinal juice

图3 冷冻干燥对不同内层壁材副干酪乳杆菌微胶囊的活菌数的影响Figure 3 Effect of freeze drying on the viability of microencapsulated Lactobacillus paracasei by different inner wall materials
2.2 副干酪乳杆菌微胶囊外层壁材质量分数的确定
2.2.1 海藻酸钠质量分数对副干酪乳杆菌微胶囊的影响
在内层壁材SPI质量分数3%、CaCl2浓度0.1 moL/L的条件下,海藻酸钠质量分数对副干酪乳杆菌微胶囊包埋产率及包埋效率的影响见表4。由表4可知,挤压法制备微胶囊的包埋产率和包埋效率随着海藻酸钠质量分数的增加(1% ~3%)而增大。但当海藻酸钠为4%时,包埋产率和包埋效率略有降低,这可能因为海藻酸钠浓度过大导致体系黏度过大,不利于菌体分散且不易被挤出从而造成部分菌体损失[8]。此外,随海藻酸钠质量分数增加,副干酪乳杆菌微胶囊的粒径逐渐增大,而且导致微胶囊挤出困难伴随拖尾现象,因此外形变得不规则。综合考虑海藻酸钠浓度以2%为宜。
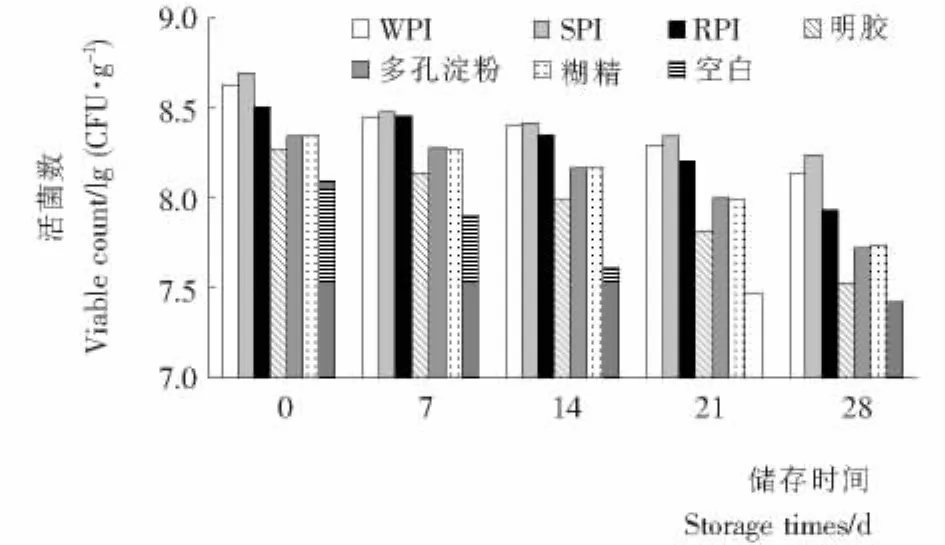
图4 不同壁材副干酪乳杆菌微胶囊冷冻干燥后4℃储存活菌数与储存时间的关系Figure 4 Viability of Lactobacillus paracasei in freeze drying microencapsulation with various inner wall materials after 28 days storage under 4℃
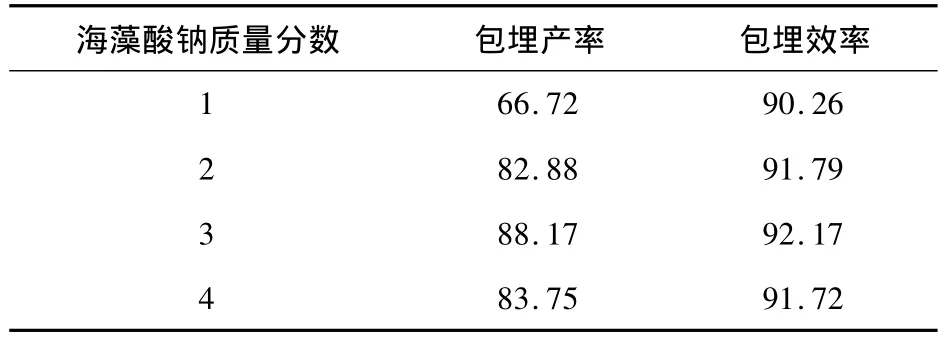
表4 海藻酸钠质量分数对副干酪乳杆菌微胶囊包埋产率及包埋效率的影响Table 4 Effect of sodium alginate concentrations on yield and efficiency of microencapsules %
2.2.2 氯化钙浓度对副干酪乳杆菌微胶囊的影响 在内层壁材SPI质量分数3%、海藻酸钠质量分数2%、CaCl2浓度分别为 0.1,0.2,0.3,0.4 mol/L 的条件下挤压法制备副干酪乳杆菌微胶囊,CaCl2浓度对副干酪乳杆菌微胶囊包埋产率及包埋效率的影响见表5。由表5可知,微胶囊的包埋产率和包埋效率随着CaCl2浓度的增大随之增大,原因是体系中Ca2+含量增加可与海藻酸钠结合形成了更紧密的凝胶结构。CaCl2浓度为0.2 mol/L时,对应微胶囊的包埋效率最高,CaCl2浓度为0.3 mol/L时,包埋产率最高。这应是因为海藻酸结合位点达到饱和,已没有多余空间与过多的Ca2+结合。而且过量的CaCl2不但不会进一步增加微胶囊产率,反而会增加溶液表面张力和密度,使挤压出的液滴浮于表面不易成珠[9]。另外,CaCl2浓度为0.2 mol/L制备的副干酪乳杆菌微胶囊经冷冻干燥后存活率最高,最终确定适宜的CaCl2浓度为 0.2 mol/L。

表5 CaCl2浓度对副干酪乳杆菌微胶囊包埋产率及包埋效率的影响Table 5 Effect of CaCl2concentrations on yield and efficiency of microencapsules
2.3 糖类保护剂对副干酪乳杆菌微胶囊冻干后储存存活率的影响
副干酪乳杆菌微胶囊冻干过程中有近2个数量级的活菌损失,其最主要原因是干燥前的冻结处理产生冰晶造成细胞机械损伤[10],干燥处理时引起的溶质损伤和细胞膜的结构、功能及成分的变化等[11,12]是冷冻干燥导致大量副干酪乳杆菌死亡的重要原因。通过在冷冻干燥前添加多羟基化合物等保护剂可有效减少冷冻干燥对乳酸菌的损害从而提高存活率。综合糖类成本低廉、经济易得及部分低聚糖对特定乳酸菌具有选择性增殖作用等因素,试验探讨了不同糖类保护剂对冷冻干燥微胶囊中副干酪乳杆菌的保护效果。5%质量分数的保护剂(海藻糖、蔗糖、乳糖、葡萄糖、麦芽糖、低聚异麦芽糖、低聚果糖或大豆低聚糖)与菌悬液1︰1(V︰V)比例混合,在内层壁材SPI质量分数为3%,海藻酸钠质量分数为2%,CaCl2浓度为0.2 moL/L的条件下制备的副干酪乳杆菌微胶囊经冷冻干燥后在4℃储存28 d,活菌数的变化见图5。由图5可知,效果最好的是低聚异麦芽糖,副干酪乳杆菌4℃、28 d存储存活率为58.97%。其次为海藻糖(48.86%),乳糖(46.18%)、大豆低聚糖(34.28%)、低聚果糖(33.53%)次之,葡萄糖、麦芽糖、蔗糖等虽有一定效果但不十分明显。低聚异麦芽糖的超强保护效果原因还不清楚,可能与其对副干酪乳杆菌较强的增殖作用有关。
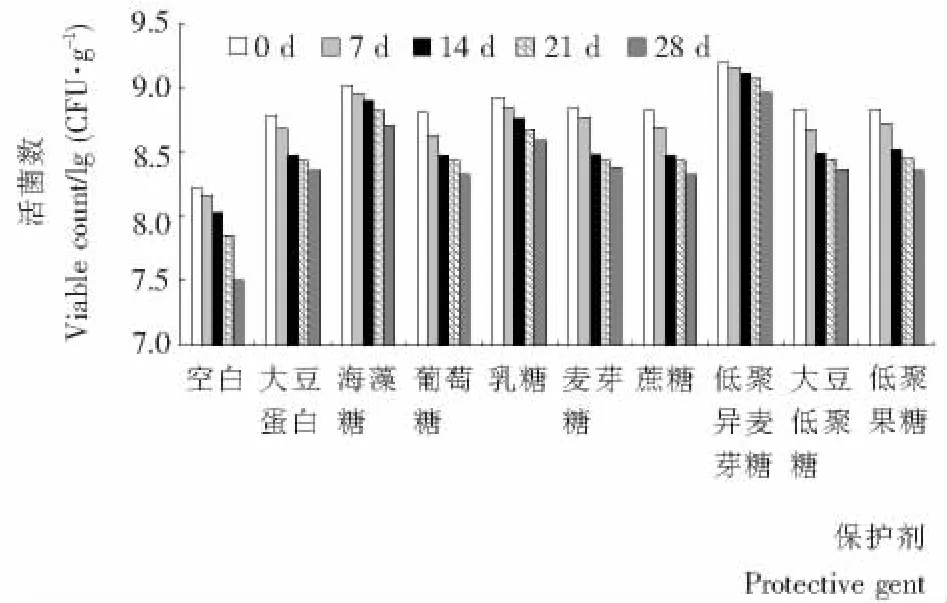
图5 不同糖类保护剂对副干酪乳杆菌微胶囊冷冻干燥后4℃储存活菌数与储存时间的关系Figure 5 Effect of saccharides protectants on the viability of microencapsulated Lactobacillus paracasei for 28 days storage under 4℃
3 结论
挤压法制备副干酪乳杆菌微胶囊是可行的,SPI作为适宜的内层壁材对于提高微胶囊效率、产率及改善副干酪乳杆菌冷冻存活率和胃肠环境耐受性是有益的。低聚异麦芽糖的保护下可以进一步改善微胶囊产品的稳定性。通过适当的包埋工艺优化,挤压法有希望成为副干酪乳杆菌工业化微胶囊生产方法。
1 雷欣宇,曾凡坤,康建平,等.乳酸菌的生理功能及其食用制剂制备技术进展[J].食品与发酵科技,2012,48(2):5 ~8.
2 Dave R I,Shah N P.Viability of yoghurt and probiotic bacteria in yoghurts made from commercial starter cultures[J].International Dairy Journal,1997,7(1):31 ~41.
3 庄海霁,雷虹,张铁丹,等.副干酪乳杆菌的应用研究进展[J].生物技术通讯,2006,17(6):989~991.
4 Paulraj Kanmani R,Satish Kumar N,Yuvaraj KA,et al.Effect of cryopreservation and microencapsulation of lactic acid bacterium Enterococcus faecium MC13 for long-term storage[J].Biochemical Engineering Journal,2011,58 ~59:140~147.
5 Monteagudo-Mera A,Rodríguez-Aparicio L,Rúa J,et al.In vitro evaluation of physiolog ical probiotic properties of different lactic acid bacteria strains of dairy and human origin[J].Journal of Functional Foods,2012,4(2):531 ~541.
6 Guimaraes,RR,Vendramini ALD,dos Santos AC,et al.Development of probiotic beads similar to fish eggs[J].Journal of Functional Foods,2013,5(2):968 ~973.
7 Adhikari K,Mustapha A,Grün I,et al.Viability of microencapsulated bifidobacteria in set yogurt during refrigerated storage[J].Journal of Dairy Science,2000,83(9):1 946~1 951.
8 熊涛,冯超,谢明勇,等.植物乳杆菌NCU116微胶囊制备工艺的优化设计[J].食品科学,2012,33(1):152 ~156.
9 Chandramouli V,Kailasapathy K,Peiris P,et al.An improved method of microencapsulation and its evaluation to protect Lactobacillus spp in simulated gastric conditions[J].Journal of Microbiological Methods,2004,56(1):27 ~35.
10 Han B,Bischof J C.Direct cell injury associated with eutectic crystallization during freezing[J].Cryobiology,2004,48(1):8 ~21.
11 van de Guchte M,Serror P,Chervaux C,et al.Stress responses in lactic acid bacteria[J].Antonie Van Leeuwenhoek,2002,82(1 ~4):187~216.
12 朱琳,刘宁,张英华,等.乳酸菌细胞膜的冻干损伤[J].食品科学,2006,27(2):266 ~269.

