芡实谷蛋白提取工艺优化及其亚基组成分析
黎 卫 毛 健 陈 婷 齐 斌
(1.江南大学食品学院,江苏无锡 214122;2.常熟理工学院生物与食品工程学院,江苏常熟 215500)
芡实(Euryale ferox),又名鸡头米、鸡头莲,属于睡莲科芡属,是传统的中药材和珍贵的天然补品,具有药食同源性。素有“水中人参”和“水中桂圆”美誉的芡实主要分布在东亚、南亚及东南亚等温带及亚热带区[1]。
芡实中含有丰富的蛋白质、碳水化合物、维生素等营养成分,其中蛋白质的含量与金针菜、银耳、木耳等相当[2]。芡实不仅营养丰富,而且还有养血安神、止泻止带、益肾固精等食疗功效[3],在食品保健与医药领域具有广阔的应用前景。
到目前为止,国内外关于芡实蛋白的研究主要集中在芡实蛋白的超声提取[4]、营养价值[5-7]、凝胶性及流变特性[8]等方面,而对于芡实蛋白组分提取分离的研究报道较少。根据蛋白质的溶解性不同,按照Osborne分级法[9]植物蛋白可分为:溶于水的清蛋白(albumin);不溶于水,但溶于盐的球蛋白(globulin);不溶于水,但溶于70% ~80%乙醇的醇溶蛋白(prolamine);不溶于水、醇,但溶于稀酸或稀碱的谷蛋白(glutelin)。本实验室通过前期研究发现芡实蛋白的这4种组分中谷蛋白含量最高。国内外关于谷蛋白的研究主要集中在大米[10-13]、小麦[14,15]、玉米[16,17]等农作物蛋白源,对其进行了大量的基础研究及应用,市场前景十分可观,而关于芡实谷蛋白的提取工艺研究鲜有报道。因此利用响应面法对芡实蛋白中主要组分谷蛋白的提取工艺进行优化,并通过SDS—PAGE凝胶电泳对芡实谷蛋白亚基组成进行分析,为进一步开发利用芡实谷蛋白提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
芡实:苏州创德兴芡实有限公司;
考马斯亮蓝G-250:国药集团化学试剂有限公司;牛血清白蛋白:生物试剂,上海信然实业有限公司;SDS-PAGE凝胶快速配制试剂盒:碧云天生物技术研究所;
其他试剂:均为分析纯,国药集团化学试剂有限公司;
试验用水为蒸馏水。
1.1.2 主要仪器设备
水浴恒温振荡器:SHZ-28A型,太仓市华美生化仪器厂;
高速冷冻离心机:CR22GⅡ型,日本Hitachi公司;
紫外可见分光光度计:UVmini-1240型,日本Shimadzu公司;
冷冻干燥机:Alpha 1-2 LD plus型,德国Christ公司;
pH计:Seven Easy S20K型,瑞士Mettler Toledo公司;
分析天平:XS105 DualRange型,瑞士 Mettler Toledo公司;
电泳仪:Mini-PROTEAN Tetra型,美国 Bio-Rad伯乐公司。
1.2 方法
1.2.1 原料基本成分测定 将芡实粉碎后过100目筛,对其基本成分进行测定。测定方法:
(1)水分的测定:按GB 5009.3—2010《食品中水分的测定》中的直接干燥法执行;
(2)蛋白的测定:按GB 5009.5—2010《食品中蛋白质的测定》中的凯氏定氮法执行,N取6.25;
(3)脂肪的测定:按GB/T 5009.6—2003《食品中脂肪的测定》中的索式抽提法执行;
(4)灰分的测定:按GB 5009.4—2010《食品中灰分的测定》中的质量法执行;
(5)总糖的测定:采用苯酚—硫酸法[18]。
1.2.2 芡实谷蛋白的提取 根据文献[10],修改如下:称取10.0 g芡实粉,依次用 10 倍体积的水、0.1 mol/L NaCl溶液和70%乙醇溶液提取芡实清蛋白、球蛋白和醇溶蛋白组分,重复提取两次,12 000 r/min,4℃离心20 min去除上清液后,收集沉淀,洗涤2次,加入NaOH溶液搅拌,提取谷蛋白。
单因素试验:设定液料比10(V/m)、温度45℃、搅拌时间2 h、碱浓度(NaOH)4.0 g/L,固定其他条件,分别考察不同液料比、温度、时间、碱浓度对芡实谷蛋白提取率的影响。提取后溶液离心(12 000 r/min、20 min、4℃)得上清液,重复提取两次,将上清液混合,用1 mol/L的HCl调至其等电点,离心(12 000 r/min、20 min、4 ℃),沉淀用 1︰2(m ︰ V)水洗涤两次。沉淀加水溶解,用1 mol/L NaOH调pH至7.0,4℃透析48 h脱盐。脱盐后的蛋白溶液冷冻干燥。冷冻干燥后的样品即为芡实谷蛋白。每组试验重复3次,取平均值。采用凯氏定氮法测定芡实谷蛋白的蛋白含量。
芡实谷蛋白提取率的计算:

式中:
R1——芡实谷蛋白的提取率,%;
m1——芡实谷蛋白的蛋白总质量,g;
m2——原料中蛋白的总质量,g。
1.2.3 响应面法优化试验 根据Box-Behnken设计原理,在单因素试验的基础上,以芡实谷蛋白的提取率作为响应值,通过四因素三水平进行响应面优化试验,试验重复3次,取平均值,建立回归方程模型。
1.2.4 芡实谷蛋白等电点的测定 将提取的芡实谷蛋白溶液,分装到21支离心管中,每管100 mL,用1 mol/L HCl调至不同的 pH(3.0,3.5,4.0,4.5,5.0,5.5,6.0),每组3 个平行,静置2 h后在4℃、12 000 r/min离心20 min,测定上清液中蛋白质的含量,计算蛋白质的沉淀率。

式中:
R2——芡实谷蛋白沉淀率,%;
m1——酸沉前上清液中蛋白质的质量,g;
m2——酸沉后上清液中蛋白质的质量,g。
液体样品蛋白质含量的测定采用考马斯亮蓝法[19]。以牛血清白蛋白(1 mg/mL)作标准曲线,595 nm吸光度为横坐标,牛血清蛋白浓度为纵坐标,绘制标准曲线,得线性回归方程为:Y=1.157 1X+0.002 7(其中,X为吸光值;Y为蛋白浓度,单位为 mg/mL),R2=0.993。
绘制沉淀率与pH值的曲线图,沉淀率最大时的pH值即为芡实谷蛋白的等电点。
1.2.5 芡实谷蛋白的SDS—PAGE电泳 取最佳条件下提取的芡实谷蛋白粉,加入上样Buffer,100℃煮沸5 min后,取15 μL上样,采用5%浓缩胶及12%分离胶进行不连续垂直电泳,浓缩胶和分离胶电压分别为70 V和100 V。待溴酚蓝条带移动到距离分离胶下边缘1 cm左右时关闭电源,结束电泳。采用考马斯亮蓝G-250染液对凝胶进行染色,用脱色液脱色后拍照保存。
2 结果与分析
2.1 芡实的基本成分分析
将芡实粉碎后,过100目筛,采用1.2.1的方法测定芡实的基本成分,结果见表1。由表1可知,芡实中糖含量最高(83.23±0.83)%,其次是蛋白质(9.52 ±0.13)%,印度学者[7]发现,芡实蛋白含量虽不高,但其必需氨基酸指数(EAAI)较高,优于大部分的动植物蛋白。在本实验室的前期研究中,谷蛋白为芡实蛋白中的主要组分,因此以碱溶酸沉法制备芡实谷蛋白,优化其提取工艺,对提高其应用范围和经济价值具有重要意义。

表1 芡实的基本成分(干基)Table 1 The composition of Euryale ferox seed(10 -2g·g-1)
2.2 芡实谷蛋白的等电点
不同pH条件下,芡实谷蛋白的沉淀效果见图1。由图1可知,当pH为4.5~5.5时,芡实谷蛋白的沉淀效果较好,沉淀率在80%以上;当pH为5.0时,沉淀率达到最大值,为88.2%。因此芡实谷蛋白的等电点为5.0左右,确定此pH为芡实谷蛋白的最佳沉淀条件。
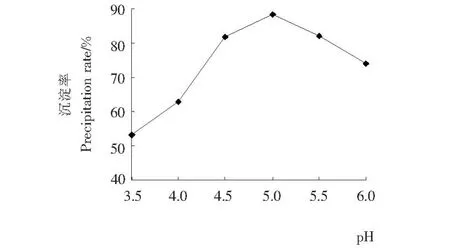
图1 pH对芡实谷蛋白沉淀效果的影响Figure 1 Effect of different pH on the precipitation of Euryale ferox glutelin
2.3 单因素试验结果
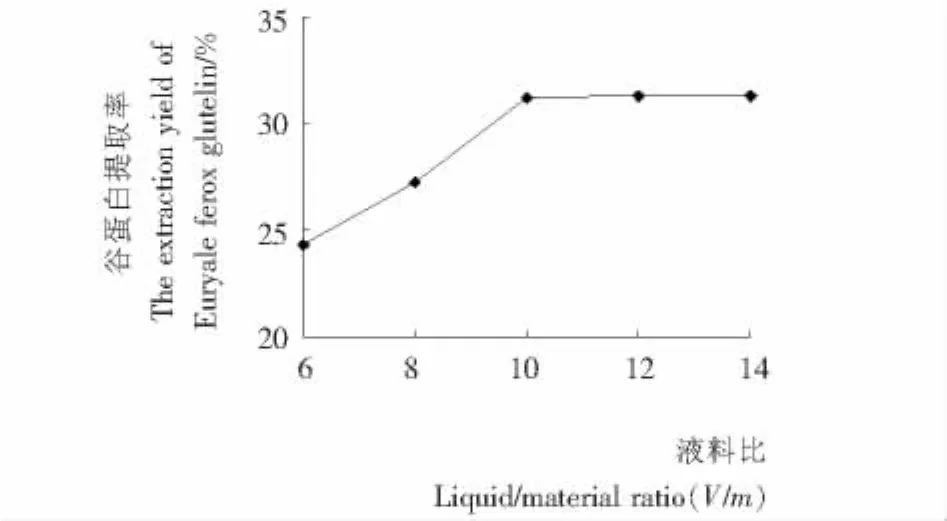
图2 液料比对芡实谷蛋白提取率的影响Figure 2 Effect of liquid/material ratio on extraction yield of Euryale ferox glutelin
2.3.1 液料比对芡实谷蛋白提取率的影响 由图2可知,随着液料比的增加,芡实谷蛋白的提取率不断增加,当液料比为10.0(V/m)时,芡实谷蛋白提取率达31.17%,此后,随着液料比的增大,蛋白质的提取率几乎不变。当液料比较小时,溶液的黏度过大,不利于蛋白溶出;当液料比过大时,不利于蛋白质提取后的浓缩沉淀。综合考虑,单因素试验确定的最佳液料比为10.0(V/m)。
2.3.2 温度对芡实谷蛋白提取率的影响 由图3可知,随着提取温度的升高,芡实谷蛋白的提取率呈现先增后减的趋势,在50℃达到最大值。较高的温度有利于蛋白质的溶出,但是温度过高时,易导致蛋白变性,因此,单因素试验确定的最佳提取温度为50℃。
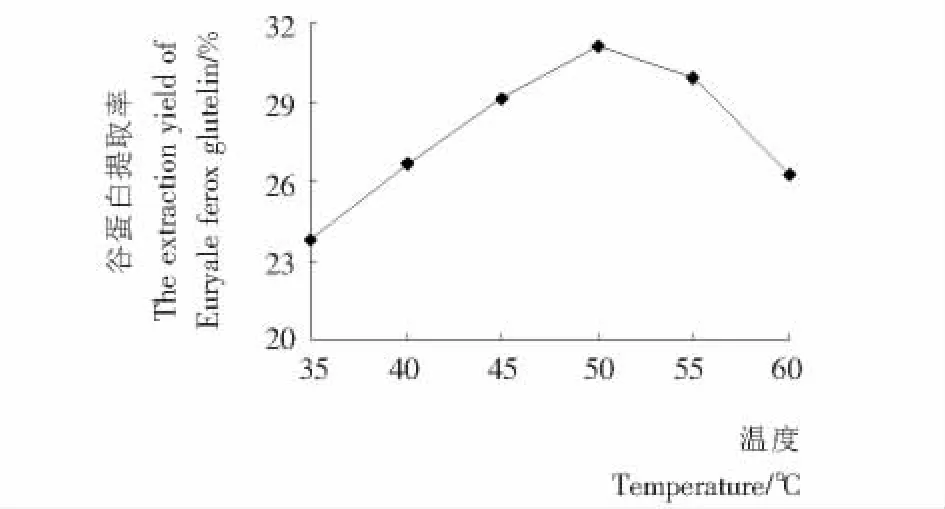
图3 温度对芡实谷蛋白提取率的影响Figure 3 Effect of temperature on extraction yield of Euryale ferox glutelin
2.3.3 时间对芡实谷蛋白提取率的影响 由图4可知,提取时间在0.5~2.0 h时,芡实谷蛋白的提取率随着时间的延长而显著增加,超过2.0 h后芡实谷蛋白的提取率增加缓慢,并且有降低的趋势。原因可能是随着时间的延长,蛋白充分的溶解,在其达到饱和后,蛋白浓度就不再升高。在较高温度下,提取时间过长也可能导致蛋白质变性,从而提取率降低。考虑到在高温下蛋白质的品质以及能源耗用问题,确定最佳提取时间为2.0 h。

图4 时间对谷蛋白提取率的影响Figure 4 Effect of time on extraction yield of Euryale ferox glutelin
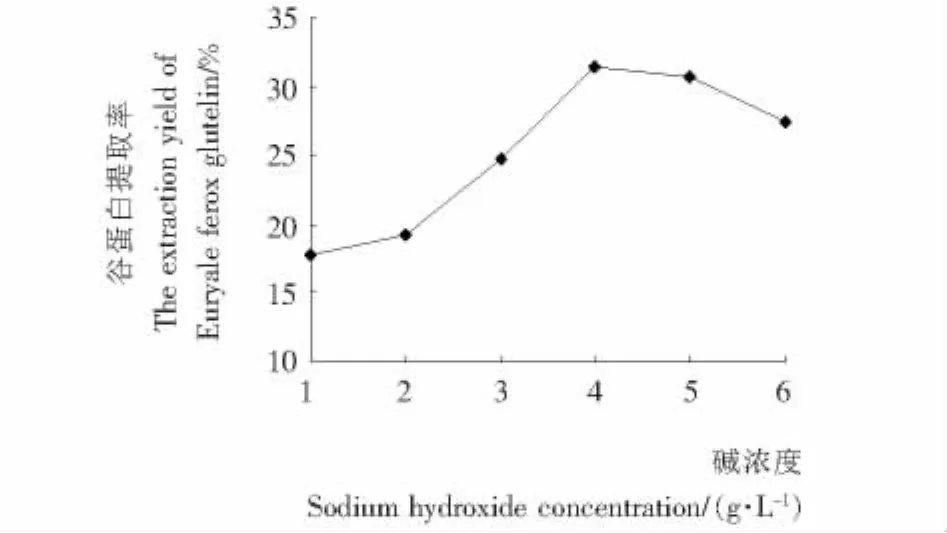
图5 碱浓度对谷蛋白提取率的影响Figure 5 Effect of sodium hydroxide concentration on extraction yield of Euryale ferox glutelin
2.3.4 碱浓度对芡实谷蛋白提取率的影响 由图5可知,当NaOH浓度在1.0~4.0 g/L时,随着碱浓度的升高,芡实谷蛋白的提取率显著增加。此后随着NaOH浓度的升高,芡实谷蛋白的提取率反而降低。原因可能是,稀碱有利于蛋白质的提取,当碱浓度达到4.0 g/L时,溶液蛋白质浓度达到最大,当超过这一浓度,蛋白质的提取率降低,过高的碱浓度会使蛋白变性,使得溶解度下降,改变其营养学特性,生成有毒物质[20]。综合考虑,确定最佳提取碱浓度为4.0 g/L。
2.4 响应面试验设计及结果
2.4.1 响应面法因素与水平的选择 根据单因素试验结果,采用四因素三水平的响应面法,因素编码及水平见表2。

表2 Box-Behnken试验因素水平表Table 2 Coded values and corresponding actual values of the variables used in Box-Behnken design
2.4.2 回归模型的建立与检验 响应面试验设计及结果见表3。按照Design Expert 8.05b软件中的Box-Behnken Design方法,4个因素经过拟合得到的芡实谷蛋白提取率(Y)的回归方程为:
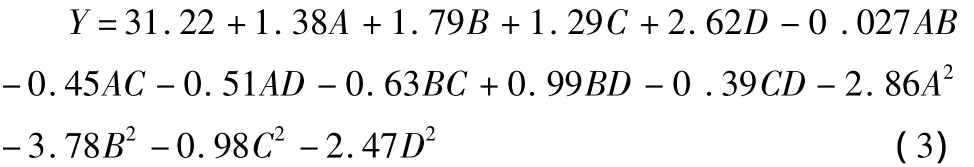
对该回归方程进行方差分析,结果见表4。由表4可知,该模型达到极显著水平(P<0.01),失拟项不显著(P>0.05),该模型的R2值为0.964 3,说明该模型与试验拟合良好,故可用于设计范围内的预测。
由表4回归模拟系数显著性检验结果可知,一次项中,B、D极显著,A、C显著;平方项中,除C2显著外,其余平方项均为极显著,二次项中,BD的回归系数达到显著水平,其他交互项均不显著。影响芡实谷蛋白提取率因素的主次顺序依次为D>B>A>C,即碱浓度>温度>液料比>时间。
2.4.3 两因素间交互效应分析 根据芡实谷蛋白模型的回归方程,固定两个因素在编码值0的水平,分析另外两个因素对芡实谷蛋白的影响,软件生成的三维响应面图,可直观地反映各因素的交互作用对响应值的影响,从而确定最佳工艺参数。

表3 试验设计及结果Table 3 Box-Behnken design and results
由表4可知,温度和碱浓度的交互作用对芡实谷蛋白的提取率有显著影响,而其他因素间的交互作用对芡实谷蛋白的提取率影响不大。固定液料比和提取时间在0水平,作出温度和碱浓度的交互效应的响应面,见图6。根据响应面的陡峭程度可知,温度对芡实谷蛋白提取率的影响较碱浓度小,这与方差分析的结果相一致。该结果与赵洁昌[21]在优化酸枣仁蛋白的提取工艺中的研究结果一致。随着温度和碱浓度的升高,蛋白提取率表现出显著的先增后减的趋势。若想获得较高的提取率,温度应在50℃左右、碱浓度在4.5 g/L左右。

表4 回归模拟方差分析Table 4 Analysis of variance for the fitted regression model
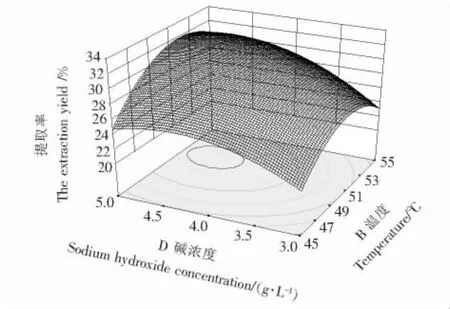
图6 温度和碱浓度的交互作用对芡实谷蛋白提取率的影响Figure 6 Response surface plot showing the effect of sodium hydroxide concentration and temperature on extraction yield of Euryale ferox glutelin
2.4.4 最佳条件优化及验证结果 通过响应面回归方程,经Design Expert 8.05b软件对芡实谷蛋白提取进行优化,确定最佳的提取工艺条件为:液料比10.3(V/m),温度51℃,时间2.2 h,碱浓度4.5 g/L,理论预测值为32.55%。根据最佳工艺条件,做3组验证性实验,得到芡实谷蛋白提取率分别为 32.43%,32.52%,32.39%,平均值为 32.45%,与该模型理论预测值32.55%无显著差异(P>0.05),表明该响应面模型是可行的。
2.5 芡实谷蛋白的亚基组成
通过前期提取工作,在最佳条件下提取的芡实谷蛋白通过SDS—PAGE凝胶电泳分析,取得了较好的分离效果,结果见图7。由图7可知,芡实谷蛋白主要有5个亚基,相对分子量分别为74,58,49,33,15 kD。其中15 kD 亚基含量最高,为52.4%;其次为 74 kD(占15.5%)和 33 kD(占 15 .4%);最后为58 kD(占9.6%)和49 kD(占7.1%)。经多次重复试验,芡实谷蛋白电泳谱带重现性、稳定性良好,这为构建芡实谷蛋白指纹图谱提供一定的依据。
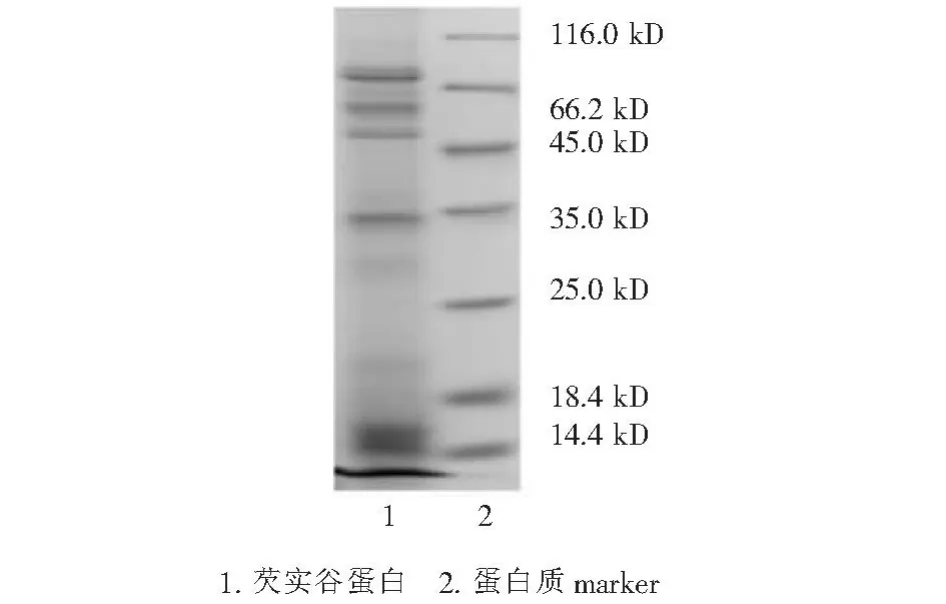
图7 芡实谷蛋白的SDS—PAGE分析Figure 7 SDS—PAGE profile of Euryale ferox glutelin
3 结论
本试验通过碱提酸沉法提取制备芡实谷蛋白,采用响应面法建立了芡实谷蛋白提取工艺参数的二次多项式数学模型,经检验该模型是合理可靠的,能较好地预测芡实谷蛋白的提取率。由该模型分析可知,影响芡实谷蛋白提取率因素的主次顺序为:碱浓度>温度>液料比>时间;最佳提取工艺条件为:液料比10.3(V/m),温度51 ℃,时间2.2 h,碱浓度4.5 g/L。在此条件下,芡实谷蛋白提取率可达32.45%。通过对芡实谷蛋白SDS—PAGE凝胶电泳分析,发现芡实谷蛋白中主要由5种亚基组成,其中15 kD亚基含量最高,占52.4%,经多次重复试验,芡实谷蛋白电泳谱带重现性、稳定性良好,这为构建芡实谷蛋白指纹图谱提供一定的依据。
通过本次试验可以为碱溶酸沉法提取芡实谷蛋白及芡实谷蛋白在食品行业中的应用提供指导性参考,今后可进一步研究芡实谷蛋白的结构特征及其功能特性,为其更好的应用于食品行业提供理论基础。
1 Jha V,Barat G K,Jha U N.Nutritional evaluation of Euryale ferox salisb.(Makhana)[J].Journal of Food Science and Technology,1991,28(5):326~328.
2 夏红,曹卫华.芡实的营养价值及保鲜加工[J].中国食物与营养,2004(10):28~29.
3 谭胜兵,金婷.芡实的营养保健功能及其开发利用[J].食品工程,2008(3):8~10.
4 张晓云,谢玲燕,季明敏,等.超声波辅助碱法提取芡实蛋白工艺[J].食品研究与开发,2013,33(11):96 ~99.
5 张汆,张国权,郑建梅,等.安徽芡实营养特性分析[J].中国食品添加剂,2010(2):206~209.
6 Alfasane M A,Khondker M,Begum Z T,et al.Fruit production and biochemical aspects of seeds of Euryale ferox Salisb.under ex-situ conditions[J].Bangladesh Journal of Botany,2008,37(2):179 ~181.
7 Jha V,Kargupta A N,Dutta R N,et al.Utilization and conservation of Euryale ferox Salisbury in Mathila(North Bihar),India[J].Aquatic Botany,1991,39(3):295 ~314.
8 周香云,程琦,李春云,等.芡实分离蛋白的凝胶特性及流变特性[J].食品科学,2011,32(15):144~147.
9 吕飞,许宙,程云辉.米糠蛋白提取及其应用研究进展[J].食品与机械,2014,30(3):234~238.
10 王长远,许凤.米糠谷蛋白提取工艺的优化及其亚基组成分析[J].中国生物制品学杂志,2014,27(7):940 ~944.
11 Adebiyi A P,Adebiyi A O,Hasegawa Y,et al.Isolation and characterization of protein fractions from deoiled rice bran[J].European Food Research and Technology.A,2009,228(3):391 ~401.
12 Fabian C,Ju Yi-hsu.A review on rice bran protein:its properties and extraction methods[J].Critical Reviews in Food Science and Nutrition,2011,51(9):816 ~827.
13 史苏华,邓波,熊华,等.米渣谷蛋白的纯化及功能性质研究[J].食品工业科技,2011,32(9):90 ~93.
14 赵源,刘爱国,吴子健,等.谷朊粉中麦谷蛋白的碱法提取工艺优化[J].食品与机械,2014,30(1):220 ~223.
15 赵清宇,李利民,张杰,等.小麦谷蛋白溶胀指数与面团特性及面条品质相关性分析[J].食品与机械,2011,27(6):43~46.
16 Zheng Xi-qun,Wang Jun-tong,Liu Xiao-lan,et al.Effect of hydrolysis time on the physicochemical and functional properties of corn glutelin by Protamex hydrolysis[J].Food Chemistry,2015,172(1):407~415.
17 徐素玲,卢帮贵,李镁娟.木瓜蛋白酶改性玉米谷蛋白水溶性的工艺优化[J].食品与机械,2013,29(4):190 ~193.
18 张维杰.复合多糖生化研究技术[M].杭州:浙江大学出版社,1999:11~12.
19(美)威利.精编蛋白质科学实验指南[M].李慎涛,译.北京:科学出版社,2007:60~61.
20 Hourigan J A,Chesterman C F.Application of carbohydrases in extracting protein from rice bran[J].Journal of the Science of Food and Agriculture,1997,74(2):141 ~146.
21 赵节昌.响应面法优化酸枣仁蛋白提取工艺[J].食品科学,2013,34(16):134~138.

