随机ssDNA文库不对称PCR扩增条件的优化及回收效率比较
周晏丞,曹立亭,陈 露,马 跃
(西南大学荣昌校区动物医学系,重庆 荣昌 402460)
20世纪90年代诞生了一种新兴的科学技术,它利用人工合成的大容量随机寡核苷酸文库与靶分子在体外的相互作用,筛选出一种与传统抗体相比特异性更强、亲和力更大、性质更稳定以及制备更容易,无免疫原抗性,无批间差异的适配子[1],该技术称之为指数富集的配基系统进化技术(SELEX)。SELEX技术打破了传统的核苷酸配对的思想,称得上是核酸研究与应用领域的里程碑式进步。其原理是利用大容量的随机单链寡核苷酸文库进行体外多轮筛选、扩增,并最终获得与非核酸靶分子高亲和力、高特异性结合的寡核苷酸序列[2]。SELEX技术筛选出的适配子不仅分子量小、配体广泛、体外筛选不依赖于实验动物,甚至可以进行多种修饰,比如最为普遍的糖环修饰、碱基修饰和磷酸修饰等[3],这些优势使得SELEX技术有望成为实验室和临床诊断、治疗的主要技术之一。
随机寡核苷酸是SELEX筛选技术的基础,而随机寡核苷酸链中间存在一段随机序列,由于该随机区的存在使文库中的核酸序列极为丰富,给筛选过程中文库的PCR扩增带来了一系列问题,导致非特异性扩增[4]得不到理想的随机ssDNA,而常规的试剂盒回收方法对小片段分子回收效率极低,影响整个筛选过程。针对上述问题,本试验在对称PCR最佳优化条件的基础上对随机ssDNA文库的不对称PCR反应体系进行了优化,并且比较了PCR产物不同纯化方法的回收效率,以期为SELEX技术中构建亚文库以及筛选特异性更强的适配子奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 随机ssDNA文库:构建长度为80nt的随机ssDNA文库,ssDNA文库序列:5′-CTGGAGCG TCCTGGGGCGTCN(40)GTGCCCTCGCTCCGACCAGC-3′,两端为固定序列,中间 N(40)为随机序列。
PCR扩增引物:上游引物5′-CTGGAGCGTCCTG GGGCGTC-3′,下游引物 5′-GCTGGTCGGAGCGAGG GCAC-3′。随机文库及引物均由上海英骏生物技术有限公司合成。
1.1.2 试验试剂 MgCl2、Taq DNA Polymerase、dNTP、10×PCR Buffer,均购自大连宝生物工程有限公司。其他试剂:异丙醇、4mol/L醋酸铵、70%乙醇、酚/氯仿(1∶1)、3mol/L 醋酸钠、无水乙醇。
1.2 方法
1.2.1 随机ssDNA文库与合成引物的质量鉴定 将设计好的引物和ssDNA文库交给上海英骏生物技术有限公司合成。合成的引物序列和随机ssDNA文库采用4%琼脂糖凝胶电泳进行质量鉴定。
1.2.2 不对称PCR条件优化 在前期随机ssDNA文库对称PCR反应体系[5]优化结果的基础上,参照文献[6]报道的方法对随机ssDNA文库的不对称PCR扩增体系进行优化,拟定的反应体系及循环条件如下:
(1)反应体系:10×PCR Buffer 2.0 μL,25 mM MgCl22.5mmol/L,dNTP Mixture 0.25mmol/L,上游引物12μmol/L,下游引物 0.6μmol/L,Taq DNA Polymerase 1.5U,ssDNA模板2.5ng,无菌水补至20μL。
(2)循环条件:94℃预变性 30 s,94℃变性 30 s,68℃退火30s,共20个循环,最后72℃延伸15s,72℃温育7min。
其他反应组分与反应条件相同,固定下游引物投入量(0.6 μmol/L),以不同上、下游引物比例(1∶1、20∶1、40∶1、60∶1、80∶1、100∶1) 分别扩增 20、30 个热循环次数,进行3次平行试验以验证其稳定性。
(3)产物鉴定:PCR产物采用4%琼脂糖凝胶电泳检测。
1.2.3 PCR产物回收 以1.2.2中确立的最佳循环次数和上下游引物比例进行不对称PCR扩增,PCR扩增产物分别采用下列3种方法进行回收纯化试验,比较其回收效率。
(1)商品化试剂盒提取法:4%琼脂糖凝胶电泳分离DNA片段,待片段完全分离后,在紫外光下切取所需条带,DNA在紫外灯下曝光时间不超过30s,准确称取凝胶块的重量,按照1g/mL Binding Buffer对应量,加入适量体积的Binding Buffer,55~60℃水浴溶解(约 7~10min),每隔 2~3min振荡一次。溶解完成后,将DNA/凝胶混合液转移到套有收集管的HiBind DNA 柱子上,10000×g离心1min,倒去滤液,把柱子装回收集管;加入300μL Bind Buffer,按上述条件离心,弃去滤液,再把柱子重新装回收集管;加入700μL SPW Wash Buffer,也按上述条件离心,弃去滤液,13000×g离心空柱2min,以甩干柱子基质。将柱子装在干净的EP管中,加入30~50μL经65℃预热的Elution Buffer到柱子基质上,室温静置2min后,≥13000×g离心2min洗脱出DNA。回收产物加20μL DEPC水重悬,置4℃冰箱中备用。
(2)乙醇沉淀法[6]:吸取 100μL PCR 产物,12000×g离心4min,吸取上清液于1.5mL EP管中,向其中加入等体积的酚/氯仿(1∶1),混匀,置离心机中 12000×g离心5min,吸取上清液于另一干净的1.5mL EP管中,加入0.1倍体积的3mol/L醋酸钠,混匀后加入2倍体积的无水乙醇,再次混匀,-26℃下放置过夜。取出后12000×g离心30min,弃去上清液,加入1mL 70%乙醇于室温洗涤沉淀样品,5 000×g离心5~10 min后弃去上清液,敞开管盖,置于室温,直至乙醇完全挥发。沉淀的DNA样品加入DEPC水20μL重悬,置4℃冰箱备用。
(3)不完全沉淀法[7]:吸取100μL PCR产物于干净的EP管中,加入等体积4mol/L醋酸铵溶液,振荡混匀,再加入等体积的异丙醇,振荡混匀,室温静置10min,然后以 12000×g离心 10min,去上清,加 1mL 70%乙醇漂洗,振荡,5 000×g离心 5~10 min,弃去上清液,再加1mL 70%乙醇振荡混匀,4℃下12 000×g离心5 min,弃上清,室温下干燥,加20μL DEPC水重悬,置4℃冰箱备用。
1.2.4 琼脂糖凝胶电泳检测回收效率及DNA浓度测定 分别吸取以上3种不同纯化方法的纯化产物各5μL进行4%琼脂糖凝胶电泳,检测回收效率,并测定回收前后DNA的浓度和OD260/OD280比值。
2 试验结果
2.1 随机ssDNA文库及引物合成产物的质量鉴定通过4%琼脂糖凝胶电泳得到如图1所示的条带,PCR扩增结果与预期相符,条带单一,纯度好,符合要求。

图1 随机ssDNA文库及引物合成产物扩增结果
2.2不对称PCR扩增条件优化通过4%琼脂糖凝胶电泳鉴定分析,以既有较高的扩增效率又有较单一目的条带的扩增条件为最优上下游引物比例和循环次数。结果显示:随机ssDNA不对称PCR扩增的最佳循环次数为30,最佳上下游引物比例为60∶1。
2.3 待回收产物鉴定取3组PCR样品各8 μL、Marker 3μL进行4%琼脂糖凝胶电泳,结果显示:3组样品的条带亮度一致,符合要求(图2)。
2.4 回收产物检测通过4%琼脂糖凝胶电泳检测商品化试剂盒、乙醇沉淀法、不完全沉淀法回收所得产物,以随机ssDNA文库PCR产物出现清晰的单一条带、回收效率最高的纯化方法为最佳回收方法。结果显示:对短片段ssDNA回收效率最佳的是乙醇沉淀法,其次是不完全沉淀法,最后为商品化试剂盒提取法。
用核酸蛋白测定仪测定回收前后ssDNA的浓度,结果见表1。比较3种方法的回收效率,可见乙醇沉淀法与不完全沉淀法差异显著,乙醇沉淀法与商品化试剂盒法差异极显著,不完全沉淀法和商品化试剂盒法差异极显著。
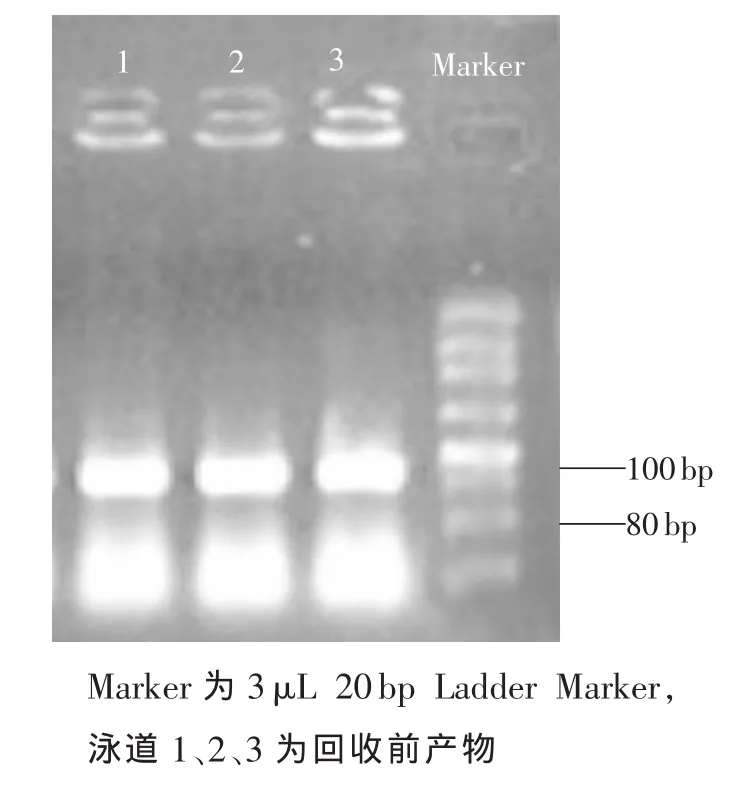
图2 待回收产物的扩增结果

表1 3种纯化方法的比较
用紫外分光光度计测定3种方法回收产物的OD260/0D280值,结果见表1。当0D260/OD280=1.6~1.8时,可以认为该ssDNA纯度较好。从表1可知,这3种纯化方法所得纯化产物的质量均在标准范围以内,其中乙醇沉淀法的纯化效率最高。
4 分析与讨论
理论上,SELEX技术结合PCR扩增技术以指数富集与靶分子特异性结合的寡核苷酸,经过几轮甚至十几轮的筛选,可以获得亲和力高、特异性好的靶分子,但是在实际操作中还是存在筛选效率低的问题。PCR技术始终贯穿着适配子筛选的全过程,PCR扩增效率的高低也会直接影响适配子的特异性和高效性,制备下一轮筛选文库的方法一般有不对称PCR法和生物素-链亲和素磁珠分离法[8],虽然应用磁珠法获得的ssDNA纯度好,但是磁珠法耗材较为昂贵,不为实验室所广泛采用,因而成本较低、方法简单的不对称PCR法应用得更为广泛。同时,随机ssDNA文库随机区的存在也使得文库具有多样性,当以ssDNA为模板进行PCR扩增时,随着循环次数的增加,非特异性扩增产物也会增加[9]。为保证亚文库的纯度和数量,对不对称PCR扩增条件的优化就显得尤为重要,尤其是对循环次数和上下游引物比例的优化。本试验中,以30个循环为最佳热循环次数,既可以获得高质量的ssDNA文库,又能较好地避免非特异性产物的扩增,且结果稳定。在一般的不对称PCR扩增中,合适的上下游引物比例一般在50∶1~100∶1之间,过低的引物比例容易引起非特异性扩增,而过高的引物比例则会使扩增效率下降[10]。本试验得出的最佳上下游引物比例为60∶1。
PCR扩增产物中一般都含有过量的酶和引物等,会影响后续的连接、筛选等操作过程[11],因而扩增产物的纯化是非常有必要的。常规的回收纯化方法一般为商品化试剂盒提取法,但是试剂盒对<500bp的目的片段的回收效率非常低,而且商品化试剂盒价格昂贵。本研究结果表明,乙醇沉淀法对小片段DNA分子的回收效率及纯化效果均比较好,但是不能完全分离产物中的单双链,导致回收产物中仍含有dsDNA;试剂盒提取法所得产物中,含有dsDNA较少,却存在回收效率低的问题。
5 结论
本研究得出20μL体系ssDNA文库不对称PCR的最佳扩增条件为30个热循环,上下游引物比例为60∶1,在此条件下可以得到单纯、无特异性扩增的ssDNA目的条带。乙醇沉淀法对小片段(80nt)目的DNA的纯化效果较好,对后续构建亚文库有重要的作用。
[1] 罗正良,严鹏科.SELEX技术及其应用的研究进展[J].中国现代医生,2008,46(33):55-57.
[2] 张选矜,部宁生,范明.SELEX技术的应用及前景[J].生理科学进展,2001,32(4):365-367.
[3] 谢海燕,陈薛钗,邓玉林.核酸适配子及其在化学领域的相关应用[J].化学进展,2007,19(6):1026-1032.
[4] 董俊红,谢立苹,王振明.SELEX技术原理及应用进展[J].潍坊医学院学报,2005,27(5):358-360.
[5] 曹立亭,许李丽,万向.SELEX技术中ssDNA文库PCR扩增条件的优化[J].安徽农业科学,2012,40(6):3241-3242.
[6] 方念.AFP-L3核酸适配子的筛选鉴定及其对肝细胞癌诊断价值的初步研究[D].南昌:南昌大学,2008.
[7] 胡学俊,罗忠训.乙醇沉淀法回收微量DNA效率的研究[J].湖北大学学报,1991,13(3):284-287.
[8] Jayasena D S.Aptamers: an emerging classof molecules thatrivalantibodies in diagnostics[J].Clinical Chemistry,1999,45(9):1628-1650.
[9]邬芳玉.SELEX筛选AFP-L3核酸适配子方法的建立[D].南昌:南昌大学,2006.
[10]侯祺,姚朗.SELEX技术检测小分子化学物研究进展[J].中华检验医学杂志,2009,32(4):472-474.
[11]侯义龙.PCR特异产物回收纯化方法的比较[J].生物技术,2005,15(4):36-37.

