CD4 +T 淋巴细胞水平对HCV/HIV 合并感染自然进程的影响
孙洪清,肖 宏,杨 菲,李菊花,林 文,陈 良
上海市公共卫生临床中心感染科,上海200083
相同的传播途径在人类免疫缺陷病毒(HIV)感染者中25% ~33%合并感染丙型肝炎病毒(HCV)[1-2],HCV/HIV 合并感染在世界范围内迅速传播已经成为全球严重的公共卫生问题。Matas 和Bambha 均报道HCV/HIV 合并感染是增加其发病率和病死率的主要因素[3-4]。本研究通过比较CD4+T 淋巴细胞水平对HIV/HCV 合并感染自然进程的影响以及相关性分析,进一步明确影响HIV/HCV 合并感染自然进程的危险因素。
1 资料与方法
1.1 一般资料 收集门诊初次就诊符合入组条件的150 例患者,HCV/HIV 组50 例、HCV 组50 例、HIV 组50 例为研究病例。
1.2 诊断标准 HIV 诊断符合美国DHHS 颁布的《艾滋病诊疗指南》标准[5];HCV 诊断符合EASL 颁布的《丙型肝炎治疗指南》标准[6]。本研究获医院伦理委员会同意,排除妊娠期和哺乳期妇女,所有患者均签署知情同意书。
1.3 方法 (1)CD4+T 淋巴细胞采用单克隆抗体标记,仪器为BD 公司FAS Calibur 型流式细胞仪,试剂购自BD 公司;(2)HIV RNA 采用bDNA 法,仪器为德国Bayer 公司System 340 bDNA Analyzer 检测仪,试剂购自德国Bayer 公司;(3)HCV RNA 采用实时荧光定量PCR 法,仪器为ABI 公司的ABI7500 仪器,试剂购自深圳市凯捷杰公司;(4)ALT、TBIL 检测采用全自动生化分析法,仪器为Roche 公司的Modular P800 型全自动生化分析仪,试剂购自罗氏公司;(5)HA、CG、PCⅢ、LN、CⅣ检测采用化学发光法,仪器为深圳市新产业生物医学工程公司的SNIBE(MAGLUMI 2000),试剂购自深圳市新产业生物医学工程公司。
1.4 统计学分析 采用SPSS 11.5 软件进行统计分析。计量资料采用±s 表示。相关性分析采用Pearson 系数分析。P <0.05 为差异有统计学意义。
2 结果
2.1 人口学特征 HCV/HIV 组和HCV 组的HCV 基因以1b 型为主,HCV/HIV 组1b 型26 例、2a 型16 例、2a/2c 型8 例。HCV 组1b 型22 例、6a 型14 例、2a 型3 例、3a 型5 例、3b 型6 例。传播途径HCV/HIV 组和HCV 组以血液传播为主,HIV 组以性传播为主。HCV/HIV 组的发病年龄明显低于HCV 组,两组比较差异有统计学意义(P <0.01,见表1)。
2.2 CD4+T 淋巴细胞水平对HIV 疾病进程的影响 HCV/HIV组CD4+T 淋巴细胞明显低于HIV 组;HIV RNA 高于HIV 组,两组比较差异有显著统计学意义(P <0.01,见表2)。
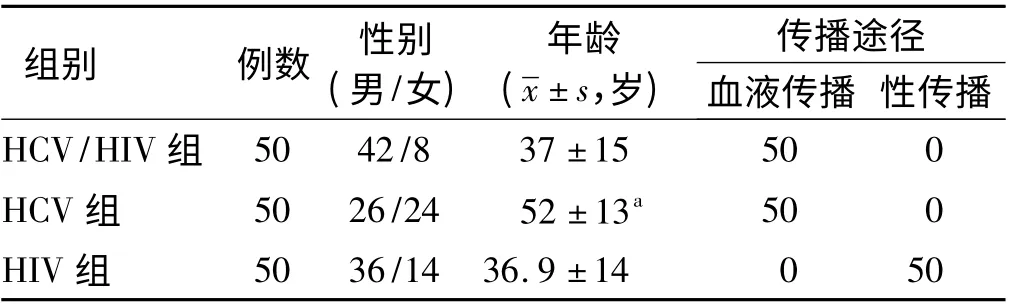
表1 人口学特征Tab 1 Demographic characteristics
2.3 CD4+T 淋巴细胞水平对HCV 疾病进程影响的分析 HCV/HIV 组的CD4+T 淋巴细胞明显低于HCV 组,差异有显著统计学意义(P <0. 01)。HCV RNA、C Ⅳ高于HCV 组,差异有统计学意义(P <0.05)。CG、PCⅢ、ALT 明显高于HCV 组,差异有统计学意义(P <0.01)。HA 明显高于HIV 组,差异有显著统计学意义(P <0.01)。LN 高于HCV 组,但差异无统计学意义(P >0.05)。TBIL 低于HCV 组,差异无统计学意义(P >0.05,见表2)。
表2 比较CD4 +T 淋巴细胞水平对HCV、HIV 疾病进程的影响(±s)Tab 2 The effect of CD4 +T lymphocyte level in the process of HCV and HIV (±s)
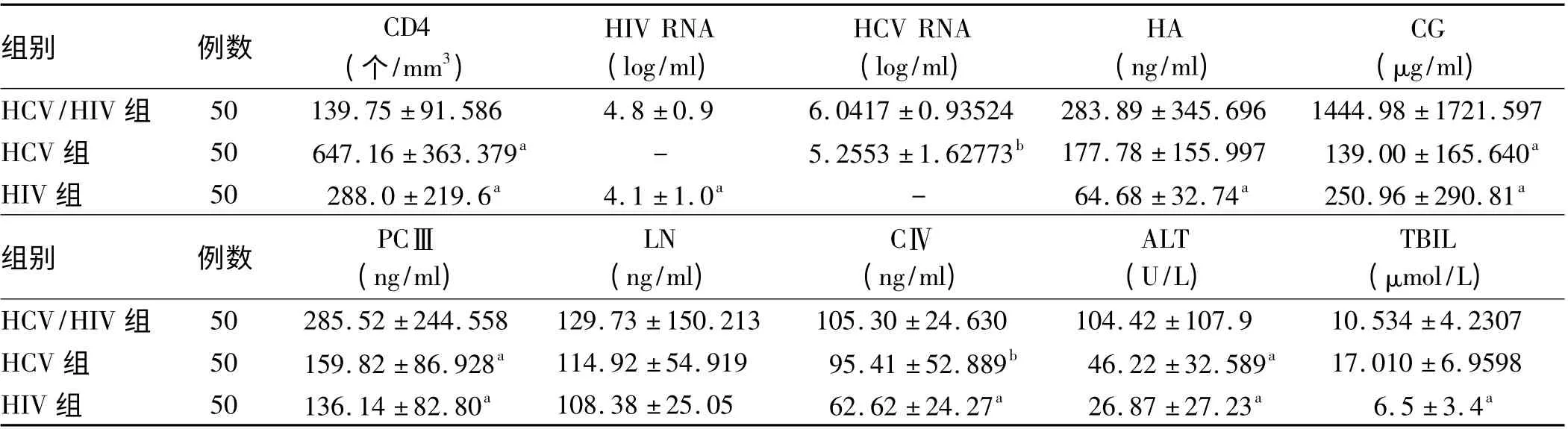
表2 比较CD4 +T 淋巴细胞水平对HCV、HIV 疾病进程的影响(±s)Tab 2 The effect of CD4 +T lymphocyte level in the process of HCV and HIV (±s)
注:与HCV/HIV 组比较,aP <0.01,bP <0.05。
组别 例数 CD4(个/mm3)HIV RNA(log/ml)HCV RNA(log/ml)HA(ng/ml)CG(μg/ml).89 ±345.696 1444.98 ±1721.597 HCV 组 50 647.16 ±363.379a - 5.2553 ±1.62773b 177.78 ±155.997 139.00 ±165.640a HIV 组 50 288.0 ±219.6a 4.1 ±1.0a - 64.68 ±32.74a 250.96 ±290.81a组别 例数 PCⅢ(ng/ml)HCV/HIV 组 50 139.75 ±91.586 4.8 ±0.9 6.0417 ±0.93524 283 LN(ng/ml)CⅣ(ng/ml)ALT(U/L)TBIL(μmol/L).630 104.42 ±107.9 10.534 ±4.2307 HCV 组 50 159.82 ±86.928a 114.92 ±54.919 95.41 ±52.889b 46.22 ±32.589a 17.010 ±6.9598 HIV 组 50 136.14 ±82.80a 108.38 ±25.05 62.62 ±24.27a 26.87 ±27.23a 6.5 ±3.4 HCV/HIV 组 50 285.52 ±244.558 129.73 ±150.213 105.30 ±24 a
2.4 相关性分析 采用Pearson 系数方法进行相关性分析,HCV/HIV 组CD4+T 淋巴细胞与ALT 呈正相关(r=0.301,P <0.05);与CG 呈负相关(r = -0.504,P <0.05);与PCⅢ呈负相关(r = -0.232,P <0.05)。HCV/HIV 组和HCV 组的HCV RNA 水平与CD4+T 淋巴细胞水平呈正相关(r = 0. 149,r = 0. 059,P <0.05)。HCV/HIV 组HIV RNA 水平与HCV RNA 水平呈负相关(r= -0.169,P >0.05)。
3 讨论
CD4+T 淋巴细胞是国际公认的监测HIV 疾病进展的实验室指标,也是众多学者认为导致肝细胞损伤的主要原因之一。Beld 等[7]报道HCV/HIV 合并感染,HIV 通过直接或间接方式作用于HCV,使HCV RNA 复制增加,并导致CD4+T 淋巴细胞计数下降,加速HIV 疾病的进程。但也有不同的研究结果。Perskalski 等[8]用Meta 方法分析了>30 个研究>100 000例患者,未发现HCV/HIV 合并感染患者高效联合抗反转录病毒治疗前增加病死率。Dorrucci 等[9]研究则未发现合并感染对HIV 疾病进程有直接影响。Shen等[10]认为HCV/HIV 合并感染血清HCV RNA 水平与HCV 核心抗原水平高度相关,但与CD4+T 淋巴细胞无相关性。
HA、CG、PCⅢ、LN 和CⅣ水平升高与肝纤维化密切相关,同时也反映了肝脏疾病的慢性化。本研究发现:HCV/HIV 组CG、PCⅢ、ALT 明显高于HCV 组;CⅣ高于HCV 组。HCV/HIV 组CD4+T 淋巴细胞与CG和PCⅢ呈负相关,即CD4+T 淋巴细胞越低,CG 和PCⅢ越高。提示高水平的CG 和PCⅢ是HCV/HIV 合并感染加重疾病自然进程的主要危险因素并且高度相关。Resino 等[11]报道HA 血清水平与肝纤维化组织学分级对HCV 患者具有很好的诊断准确性,可以预测合并感染患者肝硬化的诊断。Rockstroh 等[12]报道在18 295例HIV(+)的队列中有4 044 例(31. 0%)HCVAb(+)。经观察,HCVAb(+)比HCVAb(-)增加了9 倍与肝脏相关病死率。Tovo 等[13]报道HIV 可以改变HCV 感染的自然史,导致肝纤维化的进展较快。Limketkai 等[14]报道HIV/HCV 合并感染加快进展到肝纤维化、终末期肝病、肝癌、甚至死亡。Durante-Mangoni 等[15]报道HCV 核心抗原水平与HCV RNA相关,与ALT 水平相关,与肝脏炎症活动相关。Elalfy等[16]研究发现,在51 例定期输血的β 地中海贫血患者中82%HCVAg 阳性,21 例(49%)HCV RNA 阳性的患者与肝纤维化和纤维化血清学检查相关(P <0.001)。Villacres 等[17]研究发现只有IL-10 与CD4+T淋巴细胞水平有相关性。
Ananthakrishnan 等[18]用多因素Logistic 回归分析比较了474 843 例HCV 单纯感染;206 758 例HIV 单纯感染和56 304 例HCV/HIV 合并感染患者的住院率和病死率。结果显示合并感染较HCV、HIV 单纯感染有较高的住院率,合并感染较HCV 单纯感染有较高的住院病死率。Merriman 等[19]研究比较265 例HCV/HIV 合并感染,251 例HCV 单纯感染和227 例HIV 单纯感染的肝病恶化率和病死率。结果显示,HCV/HIV合并感染伴有肝功能异常及病死率高。特别是在合并感染患者中白人比黑人病死率更高,提示存在一定的人种差异。
HCV 患者合并HIV 感染时,病情易慢性化,预后更差。提示在临床上对HCV/HIV 合并感染患者应加强对CD4+T 淋巴细胞水平、CG 和PCⅢ水平的检测,有助于临床早期识别高危人群,早期采取干预措施,可以改善患者的预后。此外,本研究因为样本量较小,可能导致分析结果存在一定的偏倚和局限性。尚需大规模的前瞻性临床试验进一步证实。
[1] Ionescu B,Mih escu G. Hepatitis B,C and D coinfection in HIV-infected patients:prevalence and progress[J]. Roum Arch Microbiol Immunol,2011,70(3):129-133.
[2] De Nardo P,Viscione M,Corpolongo A,et al. Treatment of recurrent hepatocellular carcinoma with Sorafenib in a HIV/HCV co-infected patient in HAART:a case report[J]. Infect Agent Cancer,2012,7(1):15.
[3] Matas M,Picornell A,Cifuentes C,et al. Generalized Linear Model(GLM)framework for the association of host variables and viral strains with liver fibrosis in HCV/HIV coinfected patients[J]. Infect Genet Evol,2013,13:284-291.
[4] Bambha K,Pierce C,Cox C,et al. Assessing mortality in women with hepatitis C virus and HIV using indirect markers of fibrosis [J].AIDS,2012,26(5):599-607.
[5] Developed by the HHS Panel on Antiretroviral Guidelines for Adults and Adolescents A Working Group of the Office of AIDS Research Advisory Council (OARAC). Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents[C]. 2011:34-114.
[6] European Association for the Study of the Liver. EASL clinical practice guidelines:management of hepatitis C virus infection[J]. J Hepatol,2011,55:245-264.
[7] Beld M,Penning M,Lukashov V,et al. Evidence that both HIV and HIV-induced immunodeficiency enhance HCV replication among HCV seroconverters[J]. Virology,1998,244(2):504-512.
[8] Operskalski EA,Kovacs A. HIV/HCV co-infection:pathogenesis,clinical complications,treatment,and new therapeutic technologies [J].Curr HIV/AIDS,2011,8(1):12-22.
[9] Dorrucci M,Pezzotti P,Phillips AN,et al. Coinfection of hepatitis C virus with human immunodeficiency virus and progression to AIDS. Italian Seroconversion Study [J]. J Infect Dis,1995,172 (6):1503-1508.
[10] Shen T,Chen X,Zhang W,et al. A higher correlation of HCV core antigen with CD4 + T cell counts compared with HCV RNA in HCV/HIV-1 coinfected patients[J]. PLoS One,2011,6(8):e23550.
[11] Resino S,Bellón JM,Asensio C,et al. Can serum hyaluronic acid replace simple non-invasive indexes to predict liver fibrosis in HIV/Hepatitis C coinfected patients [J]. BMC Infect Dis,2010,10:244.
[12] Rockstroh JK,Peters L,Grint D,et al. Does hepatitis C viremia or genotype predict the risk of mortality in individuals co-infected with HIV[J]. J Hepatol,2013,59(2):213-220.
[13] Tovo CV,Becker SC,de Almeida PR,et al. Progression of liver fibrosis in monoinfected patients by hepatitis C virus and coinfected by HCV and human immunodeficiency virus [J]. Arq Gastroenterol,2013,50(1):19-22.
[14] Limketkai BN,Mehta SH,Sutcliffe CG,et al. Relationship of liver disease stage and antiviral therapy with liver-related events and death in adults coinfected with HIV/HCV[J]. JAMA,2012,308(4):370-378.
[15] Durante-Mangoni E,Vallefuoco L,Sorrentino R,et al. Clinico-pathological significance of hepatitis C virus core antigen levels in chronic infection[J]. J Med Virol,2013,85(11):1913-1918.
[16] Elalfy MS,Esmat G,Matter RM,et al. Liver fibrosis in young Egyptian beta-thalassemia major patients:relation to hepatitis C virus and compliance with chelation[J]. Ann Hepatol,2013,12(1):54-61.
[17] Villacres MC,Kono N,Mack WJ,et al. Interleukin 10 responses are associated with sustained CD4 T-cell counts in treated HIV infection[J]. J Infect Dis,2012,206(5):780-789.
[18] Ananthakrishnan AN,McGinley EL,Fangman J,et al. Hepatitis C/HIV co-infection is associated with higher mortality in hospitalized patients with hepatitis C or HIV[J]. J Viral Hepat,2010,17(10):720-729.
[19] Merriman NA,Porter SB,Brensinger CM,et al. Racial difference in mortality among U.S. veterans with HCV/HIV coinfection[J]. Am J Gastroenterol,2006,101(4):760-767.

