黄连素抑制JNK激酶活性缓解Aβ1~42诱导的细胞凋亡
黄连素抑制JNK激酶活性缓解Aβ1~42诱导的细胞凋亡
孙钿
(三峡大学仁和医院神经内科,湖北宜昌443001)
摘要〔〕目的探讨黄连素(BR)能否缓解Aβ1~42诱导的细胞凋亡及其可能机制。方法在人胚肾细胞-293(HEK293)稳定转染转Aβ前体蛋白(APP)的细胞系(HEK293/APP)中给予不同浓度聚集状Aβ1~42处理,研究Aβ1~42的细胞毒性。HEK293/APP细胞预先给予20 μg/ml的黄连素24 h处理后给予Aβ1~42处理12 h。通过CCK8检测细胞活性,流式细胞仪检测细胞凋亡,Western印迹检测蛋白变化。结果BR能够显著改善HEK293/APP细胞由Aβ1~42所诱导的细胞毒性和凋亡(P<0.05),抑制JNK和Caspase-3的激活(P<0.05)。结论BR能够缓解Aβ1~42诱导的凋亡,其可能机制是通过抑制JNK激活进而抑制Caspase-3的活化来对抗凋亡。
关键词〔〕黄连素;阿尔茨海默病;Aβ1~42;凋亡
中图分类号〔〕R733.71〔文献标识码〕A〔
第一作者:孙钿(1974-),男,主治医师,主要从事阿尔茨海默病相关研究。
阿尔茨海默病(AD)主要表现为渐进性记忆减退和认知功能障碍〔1〕。AD的主要病理特征是细胞外老年斑沉积,细胞内Tau蛋白形成的神经纤维缠结,神经元丢失和突触功能障碍。AD的发病原因目前尚不明确,主要有Aβ学说,Tau蛋白过度磷酸化学说和氧化应激等学说〔2〕。Aβ是由39~43个氨基酸组成的短肽,是老年斑的重要成分,在AD的病理过程中发挥重要的作用。体外实验以及AD转基因鼠模型都证实Aβ能够诱导海马神经元出现凋亡,导致神经元丢失。Aβ能够激活凋亡通路中的Caspases激酶来诱发凋亡〔3〕。黄连素(BR),主要存在于中草药黄连、黄柏、三颗针等植物中。BR能对抗多种病原微生物,例如结核杆菌、痢疾杆菌、伤寒杆菌、肺炎球菌、白喉杆菌以及伤寒杆菌等都有抑制作用,临床上常用来治疗细菌性痢疾、痢疾、细菌性胃肠炎等消化道疾病〔4〕。BR能够改善AD模型大鼠的氧化应激损伤。BR也能够改变Aβ前体蛋白加工,从而减少Aβ生成〔5〕。BR可以抑制乙酰胆碱酯酶活性。BR能够逆转Tau蛋白过度磷酸化〔6〕。本研究探讨BR对Aβ诱导凋亡的保护作用及其作用机制。
1材料和方法
1.1试剂和抗体BR购买自四川鸿运生物公司。Western印迹所用特异性一抗购买自美国Protein Tech 公司,ECL显示二抗购买自美国CST公司。细胞培养试剂购买自美国Invitrogen公司。
1.2Aβ1~42聚集体的制备Aβ1~42从上海强耀生物科技有限公司买回,溶解于氨水中,用磷酸盐缓冲液(PBS)中稀释到0.1 mg/ml,37℃中孵育24 h形成聚集体。
1.3细胞培养和给药HEK293细胞培养在含10%FBS的1640培养基中,置于37℃,5%CO2环境中。细胞分成三组:空白对照组,给予DMSO处理;模型组,给予20 μmol/L的Aβ1~42处理12 h;治疗组,预先给予20 μg/ml的BR24 h后再用20 μmol/L的Aβ1~42处理12 h。
1.4细胞活性检测采用Dojindo Laboratories公司的CCK8试剂盒来检测细胞活性。96孔板中每孔加入100 μl含103细胞的培养基。经不同时间培养后,每孔加入10 μl黄色的CCK8溶液孵育2 h,然后在酶标仪中检测450 nm处吸光度值。
1.5凋亡检测采用BD公司流式细胞仪检测凋亡情况。细胞收集后用PBS冲洗两次后,再加5 μl Annexin V、200 μl Annexin V-FITC结合液、5 μl PI避光孵育15 min后上机进行流式检测。
1.6Western印迹收集细胞后用碧云天公司的细胞裂解液裂解,超声处理后用BCA法检测样品蛋白浓度。等量蛋白样品在10%的SDS胶中电泳,然后转移到NC膜上,用含有3%BSA封闭液封闭40 min,4℃孵育一抗过夜。继续二抗室温孵育1 h,采用ECL显色并分析灰度值。
1.7统计学分析采用SPSS16.0软件行ANOVA分析。
2结果
2.1BR缓解Aβ1~42诱导的HEK293细胞毒性分别给予HEK293细胞0、5、10、20、50 μmol/L Aβ寡聚体处理12 h,CCK-8试剂盒检测细胞活性,分别(100±3.2)%、(97±2.4)%,(73±3.1)%、(61±4.4)%、(42±5.2)%,显示10 μmol/L时,HEK293的细胞活性已经显著下降(P<0.01),后续试验采用20 μmol/L浓度。预先外源性给予10 μmol/L BR处理后能够显著缓解20 μmol/L 的Aβ1~42引起的细胞毒性(P<0.01),对照组、模型组及治疗组细胞活性分别是为(100±2.1)%、(64±5.2)%、(96±2.7)%,表明BR能够缓解Aβ1~42诱导的HEK293细胞毒性。
2.2BR缓解Aβ1~42诱导的HEK293细胞凋亡预先外源性给予10 μmol/L BR处理后能够显著缓解20 μmol/L的Aβ1~42引起的凋亡(P<0.05),对照组、模型组及治疗组细胞凋亡率分别为(2.9±0.12)%、(8.9±0.21)%、(3.2±0.16)%。
2.3BR缓解Aβ1~42引起的Caspase-3活化Western印迹显示Aβ1~42处理后c-Caspase-3显著升高,但是预先给予10 μmol/L黄连素处理后,c-Caspase-3水平显著下降(P<0.05,图1),各组c-Caspase-3 相对灰度值为1.0 ± 0.12,1.65 ± 0.22,1.12 ± 0.13,表明BR可以缓解Aβ1~42引起的细胞凋亡。
2.4BR缓解Aβ1~42诱导的JNK激活20 μmol/L的Aβ1~42能够显著促进JNK激活,而10 μmol/L BR预处理24 h后能够抑制Aβ1~42诱导的JNK的激活(P<0.05,图2)。各组p-JNK的相对灰度值依次为1.0±0.14,1.43±0.11,1.02±0.15。表明BR可能通过抑制JNK的激活进而发挥其抗凋亡的作用。
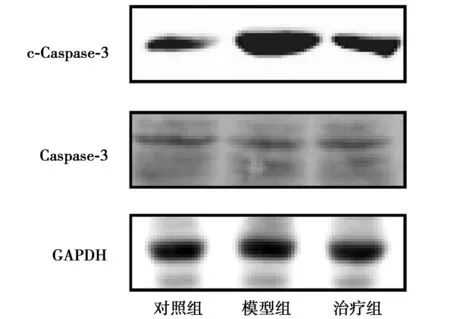
图1 BR缓解Aβ 1~42引起的Caspase-3活化
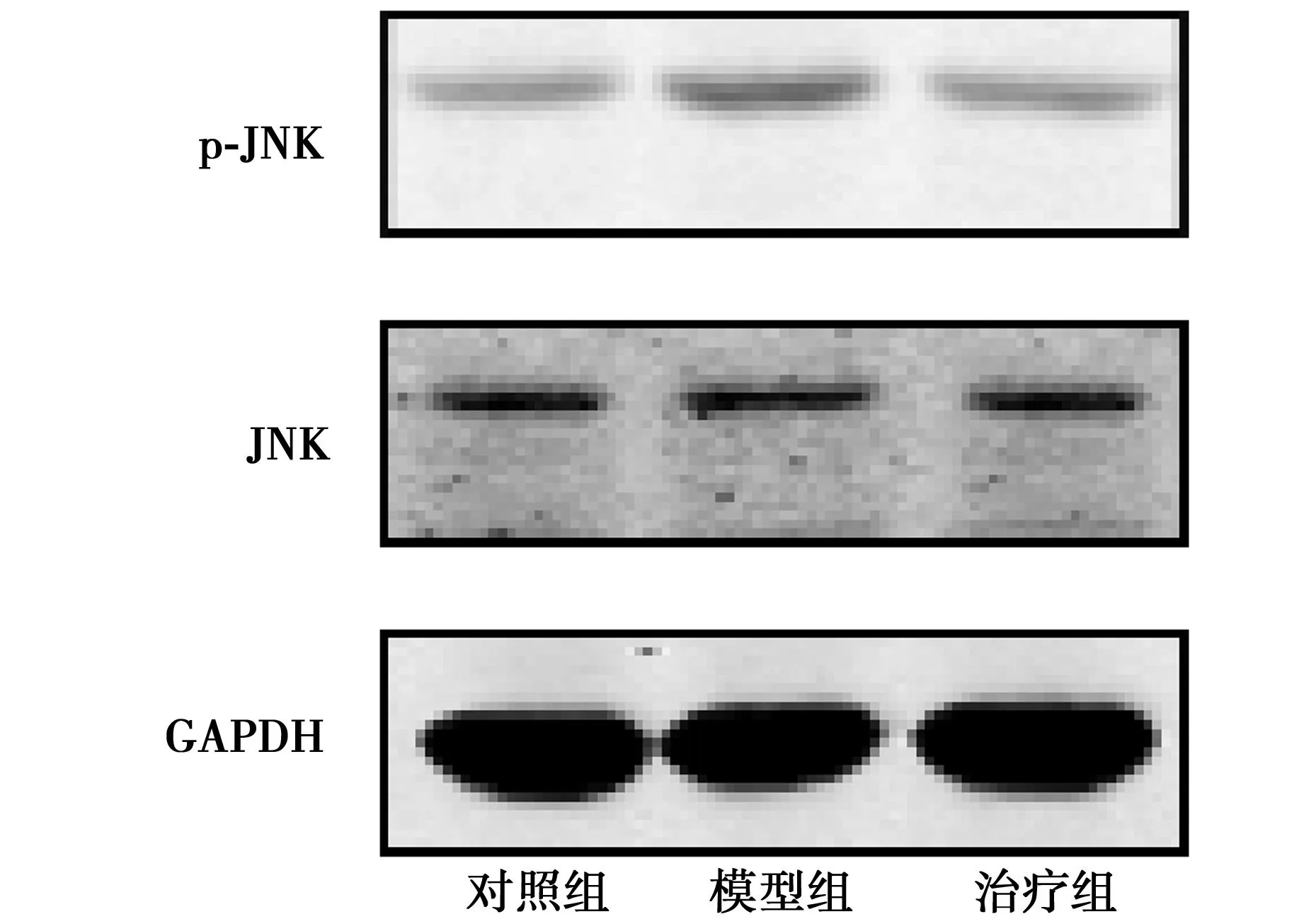
图2 BR缓解Aβ 1~42诱导的JNK激活
3讨论
AD是老年人群中最常见的痴呆形式,它是一种渐进性的神经退行性疾病。它导致大脑内特定区域出现大量神经元丢失,例如海马、内嗅皮层等。AD的特征性神经病理学改变是细胞外淀粉样蛋白沉积形成的老年斑,细胞内神经纤维缠结,以及突触和神经元的丢失。老年斑的主要成分是Aβ1~42。Aβ1~42能够调节神经和突触活性,脑内异常聚集的Aβ1~42能破坏正常的突触活性,并且能够诱发一系列的炎症反应,神经毒性和凋亡现象〔7〕,因此研究Aβ1~42的毒性作用机制以及预防保护措施在AD研究领域中有着重要的意义。
BR在临床中作为非处方药广泛应用于治疗胃肠炎、腹泻等。近年来药理学研究也表明BR具有显著的抗心律失常、抗心力衰竭、改善胰岛素抵抗、降低胆固醇、抗血小板、抗炎等重要作用,因而黄连素在心脑血管系统疾病方面可能有着重要的应用前景,并日益受到重视〔8〕。
越来越多的证据表明BR在AD的发病过程中也发挥重要作用。BR能够改善AD模型大鼠的氧化应激损伤,影响Aβ前体蛋白加工,抑制乙酰胆碱酯酶活性,降低Tau蛋白过度磷酸化,表明BR对于AD的研究和治疗有着重要意义〔5~7〕。本研究中发现20 μmol/L的Aβ1~42能够引起HEK293细胞活性降低,出现凋亡,并伴随着JNK和Caspase-3的激活,而给予BR预处理则能够逆转Aβ1~42诱导的一系列细胞毒性和凋亡效应,发挥重要的抗凋亡作用。JNK信号通路在维持细胞稳态方面起重要作用,JNK激酶控制着很多细胞过程,包括细胞增殖分化、转化、凋亡等过程〔9〕。以往研究发现JNK参与了Aβ1~42诱发的细胞毒性作用,抑制JNK活性能够缓解Aβ1~42引起的细胞毒性〔10〕。这些都表明JNK的激活对于Aβ1~42诱发细胞毒性发挥重要作用,而BR的对抗Aβ1~42诱导的凋亡的机制可能是通过它抑制JNK激活,进而抑制Caspase-3活化来实现的。
总之,目前研究表明BR能够缓解Aβ1~42诱发的细胞凋亡,其预防保护机制可能是通过抑制JNK激活来抑制Caspase-3的活化,抑制凋亡效应,表明BR可以作为研究Aβ1~42细胞毒性作用的新靶点。
4参考文献
1Kozauer N,Katz R.Regulatory innovation and drug development for early-stage Alzheimer′s disease 〔J〕.N Engl J Med,2013;368(13):1169-71.
2Bassil N,Mollaei C.Alzheimer′s dementia:a brief review 〔J〕.J Med Liban,2012;60(4):192-9.
3Hyeon JW,Kim SY,Park JS,etal.The association between prion proteins and Aβ1~42oligomers in cytotoxicity and apoptosis 〔J〕.Biochem Biophys Res Comm,2012;424(2):214-20.
4Jiang Y,Wu A,Zhu C,etal.The protective effect of berberine against neuronal damage by inhibiting matrix metalloproteinase-9 and laminin degradation in experimental autoimmune encephalomyelitis 〔J〕.Neurol Res,2013;35(4):360-8.
5Panahi N,Mahmoudian M,Mortazavi P,etal.Effects of berberine on β-secretase activity in a rabbit model of Alzheimer′s disease 〔J〕.Arch Med Sci,2013;9(1):146-50.
6Yu G,Li Y,Tian Q,etal.Berberine attenuates calyculin A-induced cytotoxicity and Tau hyperphosphorylation in HEK293 cells 〔J〕.J Alzheimers Dis,2011;24(3):525-35.
7Esparza TJ,Zhao H,Cirrito JR,etal.Amyloid-β oligomerization in Alzheimer dementia versus high-pathology controls 〔J〕.Ann Neurol,2013;73(1):104-19.
8宋兵,王晓东,黄秀艳,等.黄连素对脑缺血再灌注小鼠胸腺细胞的保护作用 〔J〕.暨南大学学报(自然科学与医学版),2011;32(6):584-8.
9Xiao F,Liu B,Zhu QX.c-Jun N-terminal kinase is required for thermotherapy-induced apoptosis in human gastric cancer cells 〔J〕.World J Gastroenterol,2012;18(48):7348-56.
10Ramin M,Azizi P,Motamedi F,etal.Inhibition of JNK phosphorylation reverses memory deficit induced by β-amyloid(1-42) associated with decrease of apoptotic factors 〔J〕.Behav Brain Res,2011;217(2):424-31.
〔2014-05-19修回〕
(编辑安冉冉/曹梦园)

