低氧诱导因子-1α、脑红蛋白与缺血性脑卒中严重程度及预后的相关性
低氧诱导因子-1α、脑红蛋白与缺血性脑卒中严重程度及预后的相关性
王媛媛窦志杰
(承德医学院附属医院,河北承德067000)
摘要〔〕目的观察缺血性脑卒中患者血浆低氧诱导因子(HIF)-1α及脑红蛋白(Ngb)的浓度,揭示HIF-1α、Ngb对缺血性脑卒中患者病情严重程度及预后的影响。方法选取2014年1~3月80例首次发病缺血性脑卒中患者作为研究对象,采用酶联免疫吸附法(ELISA)测定血浆HIF-1α和Ngb的浓度,然后在患者接受治疗的第1天及第14天分别进行NIHSS评分。结果血浆低HIF-1α组与高HIF-1α组患者相比,缺血性脑卒中严重程度轻、预后好(P<0.05);血浆低Ngb组比高Ngb组患者缺血性脑卒中严重程度轻、预后好(P<0.05)。Logistic 回归分析显示血浆HIF-1α和Ngb水平影响缺血性脑卒中患者预后独立于年龄、血压、性别、血脂和血糖等危险因素(P<0.05);缺血性脑卒中患者血浆HIF-1α与Ngb的浓度呈正相关。结论HIF-1α及Ngb可通过神经保护作用改善缺血性脑卒中的严重程度及预后;监测缺血性脑卒中患者血浆HIF-1α和Ngb的含量,可作为判断缺血性脑卒中严重程度、评价神经功能恢复情况、评估疾病预后的新的重要参考指标;HIF-1α与Ngb的表达具有相关性。
关键词〔〕低氧诱导因子-1α;脑红蛋白;缺血性脑卒中;神经功能缺损
中图分类号〔〕R743.32〔文献标识码〕A〔
通讯作者:窦志杰(1969-),女,硕士,主任医师,教授,硕士生导师,主要从事脑血管病和神经电生理方面的研究。
第一作者:王媛媛(1989-),女,在读硕士,主要从事脑血管病和神经电生理方面的研究。
低氧诱导因子(HIF)-1α 是在缺氧情况下,使组织细胞耐受缺氧、维持氧稳态的主要核转录因子。Higashida 等〔1〕发现HIF-1α通过调节下游一系列与缺氧相关的基因表达参与神经细胞损伤修复。脑红蛋白(Ngb)是2000年发现的一种在神经元中携氧、运氧的特异性球蛋白,脑缺血缺氧后表达升高,是一种研究价值很高的神经细胞损伤修复蛋白〔2〕。目前,关于Ngb及HIF-1α的研究还局限在动物实验阶段。本实验拟探讨Ngb及HIF-1α对缺血性脑卒中严重程度及预后的影响。
1资料与方法
1.1研究对象选取2014年1~3月承德医学院附属医院神经内科的80例首次发病缺血性脑卒中患者作为研究对象,男48例,女32例,平均年龄(60.31±13.37)岁。严格遵循缺血性脑卒中诊断标准,最后经CT扫描或磁共振成像确诊,并且患者都是在48 h内病发。排除冠心病、甲状腺疾病、胰腺病、血液病、严重的肝肾疾病、自身免疫性疾病、肿瘤外伤所致的缺血性脑卒中、慢性缺氧性疾病及妊娠患者。
1.2样本采集和测定所有患者入院后均给予活血化瘀、抗血小板聚集、脑保护等常规治疗。记录患者身高、体重、血压、体重指数(BMI)等。所有患者过夜禁食12~14 h于入院次日清晨肘部静脉采血9 ml,注入三个抗凝管中,一管混匀后以2 000 r/min离心15 min,分离的血浆标本冻存于-80℃冰箱,采用酶联免疫吸附法(ELISA)测定血浆中HIF-1α及Ngb的浓度。另两管血送检验科测定空腹血糖、血脂、凝血四项等影响缺血性脑卒中的常规指标。
1.3分组及观察指标将所有研究对象按血浆HIF-1α及Ngb的平均浓度分组,高HIF-1α组血浆HIF-1α>645.73 pg/ml,低HIF-1α组血浆HIF-1α<645.73 pg/ml;高Ngb组血浆Ngb>108.47 ng/ml,低Ngb组血Ngb<108.47 ng/ml。按NIHSS评分量表对所有研究对象在接受治疗的第1天及第14天分别进行神经功能缺损评分,按首次评分结果把患者分为轻、中、重度缺血性脑卒中,其中0~7分为轻度,8~13分为中度,≥14分为重度〔3〕。按两次NIHSS评分变化把疾病预后分为六类:基本痊愈:在观察时间内NIHSS评分下降91%~100%;显著进步:得分下降46%~90%;进步:得分下降18%~45%;无变化:得分下降或上升17%以内;恶化:得分上升18%以上;死亡;其中基本痊愈、显著进步、进步视为预后良,无变化、恶化、死亡视为预后差。
1.4统计学分析采用SPSS17.0软件。等级强度的比较用秩转换的非参数检验,计数资料的比较用χ2检验,控制可能影响观察结果的因素用Logistic回归分析。
2结果
2.1低HIF-1α组与高HIF-1α组缺血性脑卒中患者发病严重程度的比较低HIF-1α组缺血性脑卒中患者病情轻度27例(54.0%),中度18例(36.0%),重度5例(10.0%),高HIF-1α组患者病情轻、中、重度分别为10例(33.3%)、12例(40.0%)、8例(26.7%)。经秩转换的非参数检验,两组患者缺血性脑卒中严重程度的差别有统计学意义(Z=2.131,P=0.033),因为低HIF-1α组患者NIHSS评分的中位数(6分)低于高HIF-1α组NIHSS评分的中位数(9分),所以血浆低HIF-1α组患者缺血性脑卒中的严重程度轻于高HIF-1α组。
2.2低HIF-1α组与高HIF-1α组患者预后比较低HIF-1α组缺血性脑卒中患者经治疗基本痊愈、显著进步、进步分别为4、20、11例,无变化、恶化分别为14、1例,预后良好患者占70%。高HIF-1α组基本痊愈、显著进步、进步分别为2、4、6例,无变化、恶化、死亡分别为15、1、2例,预后良好患者占40%。血浆低HIF-1α组患者预后比高HIF-1α组好(χ2=6.963,P=0.008)。
2.3HIF-1α影响预后的Logistic回归分析将80例缺血性脑卒中患者HIF-1α、年龄、性别、血压、血糖、血脂、凝血等影响缺血性脑卒中患者预后的因素进行Logistic 回归分析,预后做应变量。只有HIF-1α、高密度脂蛋白胆固醇(HDL-C)两个因素被引入回归方程,表明患者血浆HIF-1α水平影响缺血性脑卒中预后独立于年龄、血压、血脂和血糖等危险因素,见表1。

表1 影响缺血性脑卒中预后的Logistic回归分析
2.4低Ngb组与高Ngb组缺血性脑卒中患者发病严重程度的比较低Ngb组缺血性脑卒中患者病情轻度32例(53.3%),中度21例(35.0%),重度7例(11.7%);高Ngb组患者病情轻、中、重度分别为5例(25.0%)、9例(45.0%)、6例(30.0%)。经秩转换的非参数检验,两组患者缺血性脑卒中严重程度的差别有统计学意义(Z=2.437,P=0.015),因为低Ngb组患者NIHSS评分的中位数(6分)低于高Ngb组(9.5分),所以血浆低Ngb组患者缺血性脑卒中的严重程度轻于高Ngb组。
2.5低Ngb组与高Ngb组患者预后的比较低Ngb组基本痊愈、显著进步、进步分别为5、22、12例,无变化、恶化分别为19、2例,预后良好患者占65%。 高Ngb组基本痊愈、显著进步、进步分别为1、2、5例,无变化、死亡分别为10、2例,预后良好患者占40%。因此低Ngb组患者预后比高Ngb组好(χ2=3.868,P=0.049)。
2.6Ngb影响预后的Logistic回归分析将80例缺血性脑卒中患者Ngb、年龄、性别、血压、血糖、血脂、凝血等影响脑梗死患者预后的因素进行logistic 回归分析,预后做应变量。只有Ngb、BMI、HDL-C三个因素引入回归方程,表明患者血浆Ngb水平影响缺血性脑卒中的预后独立于年龄、血压、血脂和血糖等危险因素,见表2。
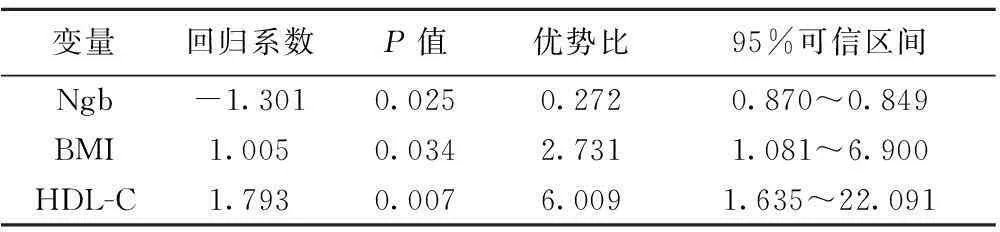
表2 影响缺血性脑卒中预后的Logistic回归分析
2.7血浆HIF-1α与Ngb的相关性分析Spearman秩相关分析显示,HIF-1α与Ngb呈正相关(r=0.675,P<0.000 1)。
3讨论
正常情况下,HIF-1α在血浆中含量很低,而在脑组织缺血、缺氧时,神经细胞内HIF-1 α的转录及表达增多,同时降解HIF-1 α的脯氨酰羟化酶及泛素-蛋白酶体系统被抑制〔4〕,再加上缺血缺氧损伤造成神经细胞完整性破坏,血脑屏障通透性增加,HIF-1α漏出,使其在血浆中含量增加。所以考虑本实验结果可能与低HIF-1α组脑组织的病理损伤轻有关〔5〕。脑血栓形成使脑组织局灶性缺血缺氧,神经细胞HIF-1α表达增加。近年来有研究〔6,7〕发现HIF-1α可以对多个与缺氧相关的基因如血管内皮生长因子、葡萄糖转运蛋白、促红细胞生成素、诱导型一氧化氮合酶、B-细胞淋巴瘤基因2、半胱天冬酶、腺病毒干扰蛋白3、Ngb、热休克蛋白70等进行调节,而这些基因通过促进无氧代谢增加ATP的释放,促进微循环的重建和血管扩张,促进红细胞生成、提高携氧量,减少神经细胞凋亡等作用,减轻缺血性脑卒中后的脑组织损伤。然而,也有研究提出在严重持续缺血、缺氧的脑组织中HIF-1α过度表达,可以激活p53、Notch-1等基因促进细胞凋亡,激活大量炎症细胞(中性粒细胞和巨噬细胞)和炎症介质(NF-xB、COX-2),增加脑组织水肿和血脑屏障通透性,反而敲除HIF-1α基因或抑制HIF-1α的表达,可以减轻缺血性脑卒中后的脑组织损伤,促进神经功能恢复〔8〕。因此,鉴于HIF-1α在不同时期的不同作用,我们在应用HIF-1α治疗缺血性脑卒中时,必须严格控制治疗时间窗及药物的剂量,让HIF-1α的神经保护作用发挥主导,尽可能降低其神经损伤功能,从而更好地治疗缺血性脑卒中。
缺血性脑卒中患者血浆Ngb浓度越低、患者病情越轻,预后越好,且血浆Ngb水平影响缺血性脑卒中预后独立于年龄、血压、血脂和血糖等危险因素。分析原因:(1)一般情况下Ngb在血浆中含量很低,而在脑组织缺血、缺氧时,神经元内Ngb表达升高,细胞完整性破坏,与应激相关的物质增多,增加血脑屏障通透性,Ngb等大分子蛋白漏出,进入脑脊液从而进入血浆,使其在血浆中明显升高。所以考虑本实验结果可能与血浆低Ngb组,神经元内Ngb过度表达,脑组织的病理损伤轻有关〔9〕。脑血栓形成使脑组织局灶性缺血缺氧,神经细胞Ngb表达增加,它通过参与神经组织对氧的摄取、运输,协助氧向线粒体扩散提高氧的利用率,清除氧化应激反应中产生的活性氧和活性氮,调节Na+-K+-ATP酶活性维持细胞内稳态,作为鸟嘌呤核苷酸解离抑制剂促进细胞存活,抑制细胞凋亡等方面抵抗缺血缺氧对脑组织的损伤,保护神经细胞,促进神经功能恢复〔10,11〕,改善缺血性脑卒中患者预后。
本文发现HIF-1α与Ngb的表达呈正相关。这与Haines等〔12〕提出敲除HIF-1α基因可使Ngb表达下降的结论相符。但由于HIF-1α调控的基因启动子区域都有HIF-1结合低氧反应元件,而在Ngb中并没有发现该反应元件。所以,具体这两种神经保护因子如何相互作用目前尚不明确,还需进一步研究。
综上所述,如果在脑梗死发生的一定时间内,通过一系列干预措施人为地调控HIF-1α及Ngb的表达,就可以挽救缺血半暗带区可逆性损伤的神经细胞,促进神经功能恢复,减轻脑组织损伤,从而更好地治疗缺血性脑卒中。另外,监测缺血性脑卒中患者血浆HIF-1α和Ngb的含量,可作为判断缺血性脑卒中严重程度、评价神经功能恢复情况、评估疾病预后的新的重要的参考指标。
4参考文献
1Higashida T,Peng C,Li J,etal.Hypoxia-inducible factor-1α contributes to brain edema after stroke by regulating aquaporins and glycerol distribution in brain 〔J〕.Curr Neurovasc Res,2011;8(1):44-51.
2Jin K,Mao Y,Mao X,etal.Neuroglobin expression in ischemic stroke〔J〕.Stroke,2010;41(3):557-9.
3Idicula TT,Brogger J,Naess H,etal.Admission C-reactive protein after acute ischemic stroke is associated with stroke severity and mortality:The Bergen stroke study〔J〕.BMC Neurol,2009;9(1):18.
4Semenza GL.Oxygen homeostasis〔J〕.Wiley Interdiscip Rev Syst Biol Med,2010;2(3):336-61.
5Zhang QC,Bian HM,Li Y,etal.Preconditioning with the traditional Chinese medicine Huang-Lian-Jie-Du-Tang initiates HIF-1α-dependent Neuroprotection against cerebral ischemia in rats〔J〕.J Ethnopharmacol,2014;154(2):443-52.
6Zhang ZY,Yan JQ,Taheri S,etal.Hypoxia-inducible factor1 contributes to N-acetylcysteine′s protection in stroke〔J〕.Free Radical Biol Med,2014;68(1):8-21.
7Ogle ME,Gu XH,Espinera AR,etal.Inhibition of prolyl hydroxylases by dimethyloxaloylglycine after stroke reduces ischemic brain injury and requires hypoxia inducible factor-1α〔J〕.Neurobiol Dis,2012;45(2):733-42.
8Cheng YL,Park JS,Manzanero S,etal.Evidence that collaboration between HIF-1α and Notch-1 promotes neuronal cell death in ischemic stroke〔J〕.Neurobiol Dis,2014;62(1):286-95.
9Fiocchetti M,Marinis ED,Ascenzi P,etal.Neuroglobin and neuronal cell survival〔J〕.Biochim Biophys Acta,2013,1834(9):1744-9.
10Hundahl CA,Hannibal J,Fahrenkrug J,etal.Neuroglobin expression in the rat suprachiasmatie nucleus:colocalization,innervation,and response to light〔J〕.J Comp Neurol,2010;518(9):1556-69.
11Hua S,Antao ST,Coder A,etal.The significance of neuroglobin in the brain〔J〕.Curr Med Chem,2010;17(24):160-72.
12Haines B,Demaria M,Mao X,etal.Hypoxia-inducible factor-1 and neuroglobin expression〔J〕.Neurosci Lett,2012;514(2):137-40.
〔2014-05-07修回〕
(编辑李相军)

