一株雏鹅呼肠孤病毒的分离与鉴定
陈红梅,万春和,程龙飞,傅光华,施少华,傅秋玲,张丹青,黄 瑜
(福建省农业科学院畜牧兽医研究所 福建省畜禽疫病防治工程技术研究中心,福州 350013)
·简报·
一株雏鹅呼肠孤病毒的分离与鉴定
陈红梅,万春和,程龙飞,傅光华,施少华,傅秋玲,张丹青,黄 瑜
(福建省农业科学院畜牧兽医研究所 福建省畜禽疫病防治工程技术研究中心,福州 350013)
2013年福建省某鹅场发生一起以肝脏和脾脏均有灰白坏死点(肝白点)为典型病变特征的急性传染病。本研究利用10日龄非免疫番鸭胚,从病死雏鹅肝脏中分离到1株病毒。病毒分离株没有血凝活性,其ELD50为10-3.25/0.2 mL,可被鹅呼肠孤病毒高免血清特异性中和。利用鹅呼肠孤病毒特异性检测引物对FJ-06株病毒尿囊液进行RT-PCR检测,可扩增到约572 bp特异性目的条带。将RT-PCR产物进行克隆测序,Blast分析表明,克隆的基因片段为鹅呼肠孤病毒δC蛋白基因片段。结果表明成功分离到1株鹅呼肠孤病毒。
鹅呼肠孤病毒;分离;鉴定
鹅呼肠孤病毒(Goose reovirus,GRV)感染呈世界分布,该病原最早由Fahey和Crawley于1954年众患有慢性呼吸道的鸡呼吸道内分离出[1]。随后学者们从野鸭[2]、北京鸭[3]、观赏鸭[4]和番鸭[5]等不同品种鸭体分离到呼肠孤病毒。王永坤等[6]2002年首次从表现为典型出血性坏死的病死鹅肚脏中分离到鹅呼肠孤病毒。2003年,Palya等[7]报道呼肠孤病毒可导致鹅关节炎,并详细介绍了患鹅的发病特点。是属于呼肠孤病毒科、正呼肠孤病毒属II亚群[8],主要侵害3周龄以内雏鹅,被感染雏鹅主要的病变特征是肝脾坏死,并伴有肾脏坏死,心内膜部分出血。2013 年11月,福建省某鹅场23日龄雏鹅出现精神沉郁、行动迟缓、蹲伏或侧卧,剖检病变为肝脏与脾脏均有大量坏死点。采集1份疑似感染GRV的病鹅肝脏,接种番鸭胚后获得1株病毒(命名为FJ-06),并使用RT-PCR检测方法对其进行鉴定,经克隆测序表明成功分离到1株鹅呼肠孤病毒。
1 材料与方法
1.1 主要试剂Trizol Reagent 购自Life Technologies公司;AMV反转录酶、HPRI、dNTPs (2.5 mmol/L)和pMD18-T载体均购自宝生物工程(大连)有限公司;Go Taq Master Green Mix 购自Promega 公司;琼脂糖凝胶回收小量试剂盒、质粒小量抽提试剂盒购自Omega公司;大肠杆菌(Escherichia coli)DH5α感受态细胞自制;其他试剂均为分析纯。
1.2 实验动物和实验胚3日龄健康雏鹅购自福建省长乐市某非免疫养殖场,10日龄健康番鸭胚购自福建省莆田市某非免疫种鸭场。
1.3 病毒分离采集病死鹅肝脏剪碎后,按1∶5比例加入灭菌生理盐水研磨成乳状,反复冻融3 次,12 000×g离心10 min,取上清液经0.22 μm滤膜过滤。将无菌的滤液经尿囊腔途径接种10日龄健康番鸭胚,每枚接种0.5 mL,弃去24 h内死亡胚,连续观察7 d。收获番鸭胚尿囊液后菌检,确定无菌后经尿囊腔途径接种10日龄健康番鸭胚,连续传代3次,收获的番鸭胚尿囊液作为种毒(命名为FJ-06株),检查无菌后分装于-80℃保存备用。
1.4 病毒分离株的部分生物学特性
1.4.1 血凝活性 分别配制1%的鸡和豚鼠红细胞悬液,取100 μL番鸭胚尿囊液,按微量血凝试验方法分别测定FJ-06株病毒的血凝活性。
1.4.2 病毒对番鸭胚的ELD50测定 将FJ-06株病毒液用灭菌PBS进行10倍梯度稀释后备用。取10-2~10-7共6个稀释度,分别接种于10日龄番鸭胚尿囊腔中,每个稀释度接种5个番鸭胚,每胚0.2 mL。连续观察7 d,每天记录死亡情况。按Reed-Muench法计算病毒对番鸭胚的ELD50。
1.4.3 血清中和实验 1∶10稀释鹅呼肠孤灭活疫苗免疫健康鹅获得的高免血清(自制),与5 mL 100 ELD50等体积混合后,37℃作用2 h。接种10日龄健康番鸭胚,每枚0.2 mL,接种5枚。连续观察7 d,记录死亡情况。同时设立尿囊液组、高免血清组和PBS对照组。
1.5 病毒的分子生物学鉴定
1.5.1 病毒核酸提取 取300 μL蚀斑克隆株鸭胚液毒,加入700 μL Trizol Reagent RNA 提取液,按照说明书提取病毒RNA。再按照反转录酶使用说明书进行反转录合成cDNA,-20℃保存备用。
1.5.2 病毒的分子生物学鉴定 参照GenBank上已发表的番鸭呼肠孤毒δC蛋白序列,设计1对引物:上游引物:5'-GAATCGTGGTCTAGCGAC-3';下游引物5'-CTCGCATCTGCTGATCATAATTA CC-3',其理论扩增长度为572 bp。用所设计的特异性引物对1.5.1制备的cDNA进行PCR扩增,扩增体系为50 μL:2×Go Taq Master Green Mix 25 μL、上下游引物(20 μm/ mL)各1 μL、cDNA模板1 μL,补充灭菌ddH2O至总体积50 μL。反应程序94℃预变性 5 min;94℃变性30 s、53℃退火30 s、72℃延伸45 s,35 个循环;72℃延伸 10 min。取PCR产物5 μL,在1.0 %琼脂糖凝胶上电泳,应用凝胶成像系统进行观察拍照。将PCR产物经胶回收试剂盒回收纯化后与载体pMD18-T连接,转化至DH5α感受态细胞,用PCR方法鉴定重组质粒,阳性重组质粒送至上海生工生物工程技术服务有限公司进行序列测定。
2 结果与讨论
2.1 病毒血凝活性FJ-06株病毒对1%的鸡和豚鼠红细胞均无肉眼可见的凝集作用。
2.2 病毒ELD50测定病毒液以10-2稀释度接种鸭胚死亡5枚,10-3稀释度接种鸭胚死亡3枚,10-4稀释度接种鸭胚死亡1枚,10-5稀释度至10-7稀释度接种鸭胚没有死亡。根据Reed-Muench法计算,病毒ELD50为10-3.25/0.2 mL。
2.3 病毒血清中和实验从血清中和实验可以看出,FJ-06株病毒稀释液和鹅呼肠孤病毒高免血清中和后,接种番鸭胚均未见死亡。尿囊液组接组种5枚番鸭胚均死亡,而高免血清组和PBS对照组均未见死亡。尿囊液接种死亡番鸭胚体肝脏有明显的白色坏死点。
2.4 病毒的鉴定用特异性引物进行RT-PCR扩增,结果显示扩增片段大小约572 bp (见图1)。

图1 RT-PCR检测FJ-06株的δC基因序列结果Fig.1 RT-PCR results of δC gene of FJ-06 strain
2.5 序列测定与分析通过DNAStar 软件对FJ-06株δC蛋白基因序列与GenBank上发表的8株禽源呼肠孤病毒株进行核苷酸序列的同源性比对(见表1)。结果表明,FJ-06分离毒株的序列与水禽源的呼肠孤病毒的同源型很高,为93.0%~97.4%,而与鸡源的呼肠孤病毒同源性很低,仅有74.4%。从遗传进化图(图2)上可清晰地看到,鸡源和水禽源的呼肠孤病毒各占一支,FJ-06株与水禽源的呼肠孤病毒的遗传关系很近,而与鸡源的呼肠孤病毒遗传关系较远,由此可进一步推断出:所分离的FJ-06株为鹅呼肠孤病毒。
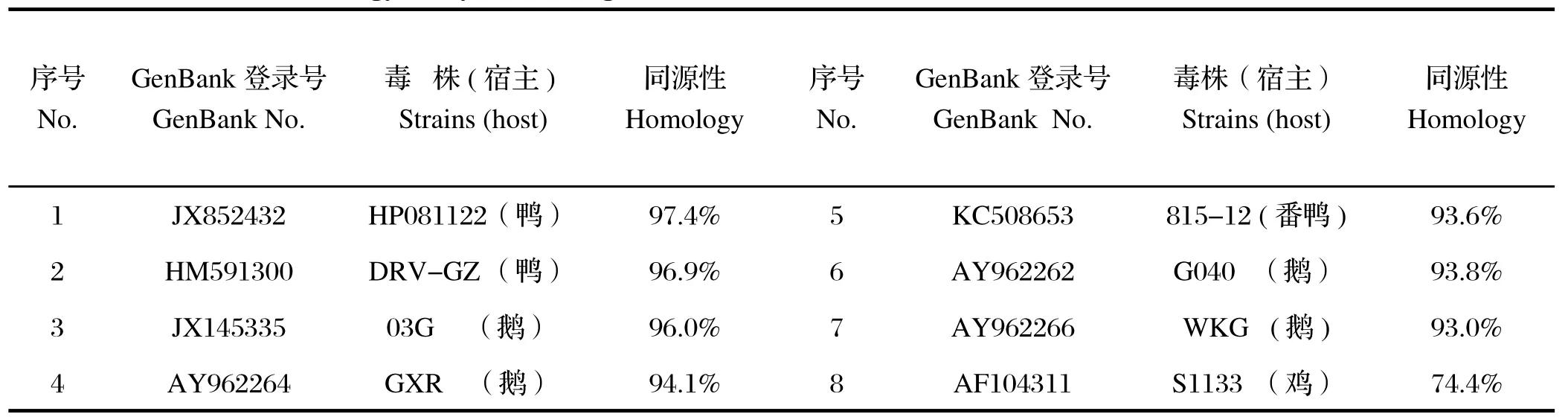
表1 FJ-06株δC基因序列与部分禽源呼肠孤病毒核苷酸同源性比较Table1 Homology analysis of δC gene nucleotides of FJ-o6 strain and other Avian Reovirus strains
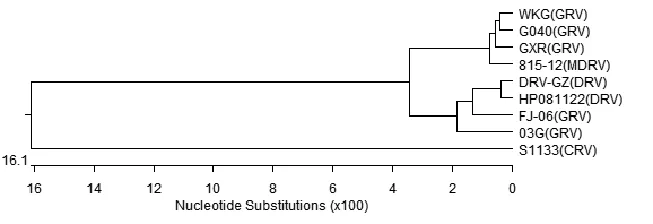
图2 禽源呼肠孤病毒δC基因的遗传进化树分析Fig.2 Phylogenetic tree based onδC gene of Avian Reovirus
参考文献
[1] Dobson K N, Glisson J R.Economic impact of a documented case of reovirus infection in broiler breeders[J].Avian Dis, 1992, 36(3)∶ 788-791.
[2] Jones R C.Avian reovirus infections[J].Rev Sci Tech, 2000, 19(2)∶ 614-625.
[3] Guo Z Y, Giambrone J J, Liu Z.Effect of in ovo administered reovirus vaccines on immune responses of specific-pathogen-free chickens[J].Avian Dis, 48(1)∶224-228.
[4] Engstrom B E, Fossum O, Luthman M.Blue wing disease of chickens∶ Experimental infection with Swedish isolate of chicken anemia agment and an avian reovirus[J].Avian Pathol, 1988, 17(1)∶ 33-50.
[5] 吴宝成, 陈家祥, 姚金水, 等.番鸭呼肠孤病毒的分离与鉴定[J].福建农业大学学报, 2001, 30(2)∶ 227-230.
[6] 王永坤, 周继宏, 严维巍, 等.鹅出血性坏死性肝炎的初步研究[J].中国家禽, 2002, 24(18)∶ 9-11.
[7] Palya V, Glavits R, Dobos-Kovacs M, et al.Reovirus identified as cause of disease in young geese [J].Avian Pathol, 2003, 32(2)∶ 129-138.
[8] Saif Y M.禽病学[M].苏敬良, 高福, 索勋, 译.12版.北京∶ 中国农业出版社, 2012∶ 355-371.
ISOLATION AND IDENTIFICATION OF A GOSLING REOVIRUS
CHEN Hong-mei, WAN Chun-he, CHENG Long-fei, FU Guang-hua, SHI Shao-hua, FU Qiu-ling, ZHANG Dan-qing, HUANG Yu (Fujian Animal Disease Control Technology Development Center, Institute of Animal Husbandry and Veterinary Medicine, Fujian Academy of Agricultural Science, Fuzhou 350013, China)
An acute infectious disease occurred in a gosling fl ock in 2013 in Fujian Province.Gray necrotic spots were observed in livers and spleens.Livers collected from dead goslings were homologized and inoculated into 10-day-old Muscovy duck embryos for virus isolation.The isolated virus had no hemagglutinating activity for chicken and guinea pig red blood cells.When duck embryos were inoculated with the isolated virus, the ELD50was determined to be 10-3.25/0.2 mL.In addition, the isolated virus was neutralized with the hyper-immune serum from vaccinated geese.Viral RNA was amplifi ed from the isolated virus using RT-PCR with specifi c target primers.A fragment of 572 bp was obtained, then sequenced and analyzed.The results confi rmed that the isolated virus was a reovirus.
Goose reovirus; isolation; identifi cation
S852.659.4
:B
:1674-6422(2015)01-0047-04
2014-09-02
国家公益性行业科研专项(201003012);现代农业产业技术体系建设专项资金(CARS-43)
陈红梅,硕士,助理研究员,主要从事畜禽传染病研究
黄瑜, E-mail:huangyu_815@163.com

