日本血吸虫PDIA3的原核表达和多抗血清制备
刘 群,段明明,苑纯秀,李丹丹,葛 程,马丽贞,冯新港
(1.上海师范大学生命与环境科学学院,上海200234;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
·研究论文·
日本血吸虫PDIA3的原核表达和多抗血清制备
刘 群1,2,段明明2,苑纯秀2,李丹丹1,2,葛 程1,2,马丽贞2,冯新港2
(1.上海师范大学生命与环境科学学院,上海200234;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
为获得日本血吸虫(Schistosoma japonicum, Sj)PDIA3(SjPDIA3)重组蛋白,并制备多克隆抗体血清,本研究以日本血吸虫cDNA文库为模版,利用PCR技术扩增得到PDIA3 ORF全长,并克隆到pET28a (+) 载体中,将得到的重组质粒pET28a-SjPDIA3转化至BL21(DE3)感受态细胞,经IPTG诱导后His-Ni柱亲和层析纯化得到SjPDIA3重组蛋白,利用重组蛋白免疫BALB/c小鼠,制备多克隆抗体,Western blot分析重组蛋白的免疫原性。扩增得到长为1482 bp日本血吸虫PDIA3的ORF序列,该序列编码493个氨基酸,含两个硫氧还原蛋白结构域和一段信号肽,无扩膜结构。在原核表达系统中表达得到大小为55 kDa的SjPDIA3重组蛋白,分析显示其具有良好的抗原性。
日本血吸虫; SjPDIA3; 原核表达; 多克隆抗体
血吸虫病是一种广泛流行且危害严重的人畜共患寄生虫病,控制血吸虫病的传播是国家亟待解决的公共卫生问题之一[1,2]。由于药物治疗存在重复感染且反复使用可能产生耐药性等弊端,因此,控制血吸虫病流行依旧依赖于安全有效疫苗的研制。研究表明致弱尾蚴或童虫免疫的动物模型能诱导产生较高的免疫保护力,但由于存在材料来源困难,使用安全等问题,所以不适于直接应用。通过模拟辐照致弱尾蚴或童虫疫苗(RAV)的效应机制来研发血吸虫疫苗是一条值得探索的新途径。我们推断在RAV模型中,可能存在一类虫源性分子与它的这种高保护性效应机制有关。本课题组研究发现,在RAV模型中,SjCRT、SjHMGB1和SjHSP70能够发生一定的迁移且能活化宿主树突状细胞(dendritic cells, DC)[3,4],形成引发和驱使保护性先天和适应性免疫应答的环境。此外,在肿瘤凋亡细胞中的相关研究显示这类分子的迁移过程与PDIA3(Protein disulfide isomerase A3,蛋白质二硫键异构酶A3)具有相关性[5]。因此我们推测,在RAV模型中,SjPDIA3在SjCRT、SjHMGB1等相关分子的迁移过程也可能具有相关功能。
本研究克隆表达SjPDIA3基因,Western blot分析重组蛋白的免疫原性,制备得到特异性较好的多克隆抗体,为后续了解RAV模型中相关虫源性分子的迁移机制,以及RAV诱异高保护性效应的机制等研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌株、载体与细胞日本血吸虫虫卵cDNA文库、原核表达载体pET28a(+)由中国农业科学院上海兽医研究所血吸虫病研究室保存;大肠杆菌菌株DH5α和BL21(DE3)感受态细胞均购于北京天根生物科技公司。
1.1.2 实验动物 6周龄雌性BALB/c小鼠(SPF级)购自上海斯莱克实验动物中心
1.1.3 主要试剂 限制性内切酶BamHⅠ、XhoⅠ、Ex Taq 酶、T4 DNA 连接酶、小型质粒抽提试剂盒和DNA 纯化试剂盒均购自TaKaRa 公司;Ni-NTA His●Bind 树脂及色谱柱购自Novagen公司;核酸Marker、His标签抗体购自北京天根生物科技有限公司;蛋白Marker购自上海麦约尔生物公司;Goat anti-Mouse IgG Antibody(IRDye800CW)抗体购自上海仪涛生物科技公司。
1.2 方法
1.2.1 引物设计 根据GenBank的SjPDIA3基因(登录号:FN320610.1)序列设计引物,上游引物加入BamHⅠ酶切位点,下游引物加入XhoⅠ酶切位点,引物由Invitrogen公司合成。上游引物:5'-GGATCCAGTGAGGTTCTCGAA- 3' ;下游引物:5'- CGCTCGAGCTATAGATCACTCT-3'。
1.2.2 SjPDIA3的扩增 以日本血吸虫虫卵cDNA文库为模板进行PCR扩增,扩增条件:94℃ 预变性5 min;94℃变性 45 s,55℃退火 45 s,72℃延伸2 min,32个循环;最后72℃延伸10 min。将扩增产物经1%(m/v)琼脂糖凝胶电泳分析鉴定,参照DNA纯化试剂盒操作方法对鉴定正确的产物进行纯化回收。
1.2.3 重组原核表达载体的构建 将PCR纯化产物与pET28a (+) 载体质粒分别经BamHⅠ和XhoⅠ双酶切,酶切产物分别纯化回收后16℃连接过夜,之后将连接产物转入DH5α感受态细胞中,取转化产物涂布到LB琼脂培养板(Kana+10μg/mL)上,37℃恒温培养箱培养过夜。挑平板上的单菌落到LB液体培养基(Kana+10 μg/mL)中,培养8~12 h,取菌液进行PCR鉴定并将阳性送上海桑尼生物公司测序,自过夜培养菌液抽提阳性重组质粒后双酶切鉴定插入片段的正确性,并将阳性质粒命名为pET28a-SjpDIA3。
1.2.4 SjPDIA3基因的生物信息学分析 利用在线分析软件ExPAsy Compute pI/Mw tool(http∶//web.expasy.org/compute_pi/),预测SjPDIA3蛋白及等电点大小。利用在线软件TMHMM Server v 2.0 (http∶//www.cbs.dtu.dk/services/TMHMM/)分析SjPDIA3蛋白跨膜结构,SignalP 4.1 Server(http∶//www.cbs.dtu.dk/services/SignalP/)预测是否含有信号肽,ScanProsite tool(http∶//prosite.expasy.org/ scanprosite/)分析可能结构。
1.2.5 SjPDIA3蛋白的表达 重组阳性质粒pET28a-SjPDIA3转入BL21(DE3)感受态细胞中,37℃过夜培养后,挑取阳性克隆至LB培养基并培养至对数期,加入IPTG至终浓度为1.0 mmol/L,诱导培养5~8 h,同时设未诱导组为对照。分别取诱导及未诱导菌液10 800×g离心2 min,弃上清,PBS重悬菌体后与2×SDS PAGE loading bufffer等体积混匀,沸水浴微波煮沸5 min,12%的聚丙酰胺凝胶进行电泳,考马斯亮蓝染色、脱色后分析结果并拍照保存。
1.2.6 重组蛋白的可溶性分析 将阳性克隆表达菌大批量诱导培养后,菌液以10 000×g离心10 min,弃上清,按每100 mL培养基所得菌体加入1×结合缓冲液20 mL重悬菌体,反复冻融3次。超声裂解菌体至菌液透亮不粘,取超声后的菌液1 mL,10 800×g离心10 min,沉淀用约1 mL脲素(8 mol/L)溶解,分别取上清及沉淀按前述方法制样,蛋白电泳鉴定该蛋白分子可溶性表达情况。
1.2.7 重组蛋白的纯化和鉴定 将超声菌液以16 000×g离心30 min,上清经0.45 μm滤膜过滤进一步去除不溶成分,得到的上清按照His柱层析纯化蛋白手册进行分离纯化,收集的含目的蛋白的洗脱样品经透析、浓缩后进行SDS-PAGE电泳,经考马斯亮蓝染色、脱色后分析。纯化蛋白SDS-PAGE电泳,转膜后封闭4~8 h,以感染日本血吸虫42日龄的小鼠阳性血清为一抗,4℃作用过夜;PBST洗3次,Goat anti-Mouse IgG Antibody (IRDye800CW)为二抗,室温孵育45 min,PBST洗2次,PBS洗2次,Odyssey双色红外激光成像系统拍照分析。
1.2.8 SjPDIA3抗血清制备 将浓缩SjPDIA3蛋白用BCA法测其浓度后,与206佐剂以46∶54比例充分混匀后皮下多点免疫6~8 周龄雌性BALB/c小鼠,首免100 μg/只,第二次免疫和三次免疫免蛋白浓度减半,免疫间隔为2 w,三免后d6眼眶采血分离血清。1.2.9 SjPDIA3蛋白免疫原性分析 Western blot检测多抗血清特异性,分析重组蛋白的免疫原性。制备重组SjPDIA3蛋白及虫体蛋白样品,SDS-PAGE凝胶电泳后转膜,抗SjPDIA3多抗血清和His标签抗体分别为一抗,其他操作同1.2.7。
2 结果
2.1 SjPDIA3基因的克隆和重组载体鉴定以虫卵cDNA为模扳进行PCR扩增,产物经1.0%琼脂糖凝胶电泳得到大小约为1482 bp(图1 A)的序列,符合预期结果。该基因片段与pET28a (+) 载体的重组质粒经BamHⅠ和XhoⅠ限制性内切酶酶切鉴定,核酸电泳鉴定(图1 B),载体大小约为5369 bp,目的片段约为1482 bp,证明重组载体建成功。

图1 SjPDIA3基因的PCR扩增(A)和重组质粒pET-28a-SjPDIA3的酶切鉴定(B)Fig.1 Amplifi cation of SjPDIA3 gene(A) and verifi cation of recombinant plasmid by enzyme digestion(B)
2.2 SjPDIA3基因生物信息学分析ExPAsy Compute pI/Mw tool分析结果显示:SjPDIA3基因编码493个氨基酸,预计分子量大小55.67 kDa,等电点7.12;ScanProsite 分析显示SjPDIA3序列中有两个含氧化还原催化位点的硫氧还原蛋白结构域;SignalP4.1 Server在线分析显示SjPDIA3分子的可知信号肽序列:MFVRRALKMLWLSPFLLLFAFATC;TMHMM Server v 2.0分析显示SjPDIA3分子无跨膜结构。
2.3 SjPDIA3 蛋白的表达分析将重组质粒pET28a-SjPDIA3转化至大肠杆菌感受态细胞BL21(DE3)中,IPTG诱导表达,经SDS-PAGE电泳鉴定得到大小约为55 kDa的重组蛋白(图2 A),符合预期值,而对照组无该条带。可溶性分析结果表明融合蛋白主要以包涵体形式存在于沉淀中(图2 B)。
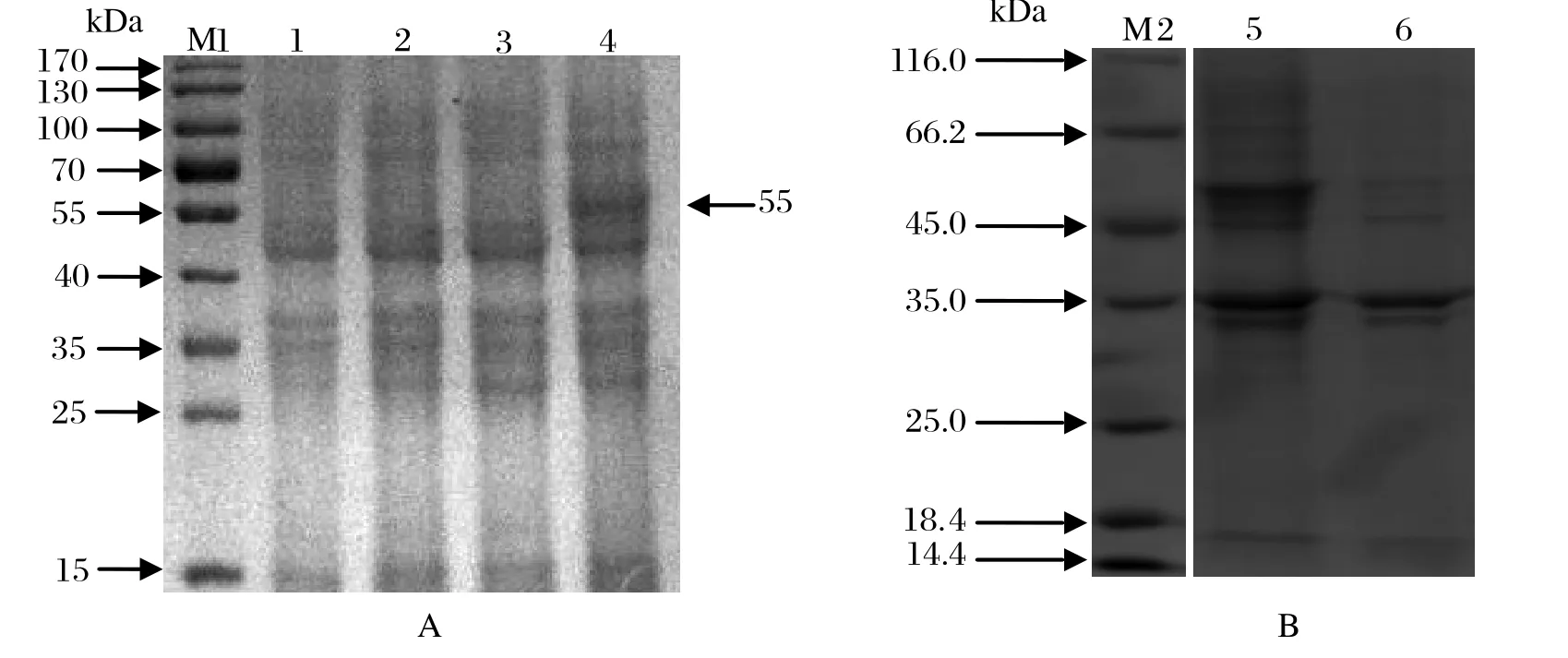
图2 SDS-PAGE分析pET-28a-SjPDIA3重组蛋白的表达(A)和可溶性(B)分析Fig.2 The expression and solubility analysis of recombinant protein pET-28a-SjPDIA3 by SDS-PAGE
2.4 SjPDIA3重组蛋白的纯化和鉴定His亲和层析柱纯化融合蛋白,Western blot分析融合蛋白能否被感染日本血吸虫42 d的小鼠阳性血清识别。结果表明(图3A)在55 kDa处有特异性条带,说明重组蛋白在大肠杆菌中成功表达,且该蛋白可被小鼠阳性血清识别(图3B),表明其具有良好的反应原性。
2.5 SjPDIA3重组蛋白免疫原性鉴定纯化蛋白免疫小鼠后得到SjPDIA3多抗血清, Western blot结果显示,SjPDIA3多抗血清可特异性识别55 kDa的虫体蛋白(图4),表明SjPDIA3重组蛋白具有较好的免疫原性。
3 讨论
蛋白质二硫键异构酶(protein disulfide isomerase,PDI)是一类多功能蛋白,主要存在于真核生物细胞内质网腔中。PDIA3是PDI家族的一员,能够催化二硫键的氧化还原异构反应[6],研究表明,肿瘤细胞或凋亡细胞经某些药物或紫外照射等处理后,细胞内质网中的PDIA3与钙网织蛋白(calreticulin, CRT)可通过蛋白与蛋白间的交互作用形成分子复合物,二者协同自内质网内腔转至质膜表面发挥相关生物学作用[5]。除了在内质网分布以外,PDIA3也定位及作用于其他部位,如细胞质[7]、细胞核[8,9]。此外,在多种哺乳动物细胞核内,PDIA3在紫外照射或甲醛等处理后可与DNA形成复合物,PDIA3与高迁移率族蛋白B1/B2(HMGB1/ HMGB2)形成一个复杂的蛋白核复合物,识别受损的DNA[6]。此外,研究表明癌症细胞中的HMGB1、HMGB2和PDIA3是影响抗代谢药物反应重要决定因素[10]。本课题组研究发现,在RAV模型中,SjCRT、SjHMGB1和SjHSP70能够活化宿主树突状细胞(DC)[3,4],形成引发和驱使保护性先天和适应性免疫应答的环境。故我们推测,在RAV模型中,SjPDIA3可能在SjCRT由胞内转移至质膜过程中发挥分子伴侣的作用,此外,它在SjHMGB1的迁移过程也可能具有相关功能。
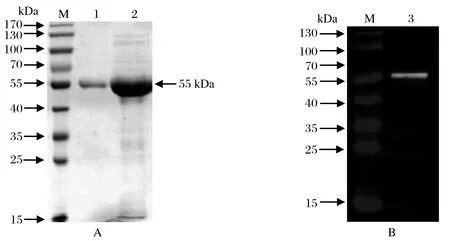
图3 SjPDIA3重组蛋白的纯化(A)和Western blot鉴定(B)Fig.3 The purifi cation and identifi cation of recombinant protein SjPDIA3
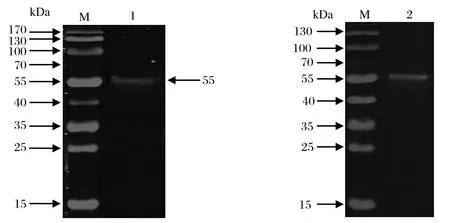
图4 SjPDIA3融合蛋白免疫小鼠获得的抗血清的Western blot分析Fig.4 Western blot analysis of SjPDIA3 antiserum from mouse infected by fusion protein
PDIA3目前的研究多集中其在内质网中的相关功能,其生物学功能主要有参与糖蛋白的正确折叠及质量控制[11,12],构成主要组织相容性复合物的肽运载复合体[13,14],鉴于PDIA3与(CRT)紧密结合在细胞内质网腔中,故其与CRT介导的特异性抗肿瘤免疫机制的研究也紧密相关[4],此外,Natalia 等[15]发现PDIA3与HMGB1/2在癌症的治疗过程中,可触发相关细胞反应以应对化疗引起的DNA损伤。研究发现,PDIA3也是一种应激相关蛋白,在急性脊椎缺血再灌注(spinal cord ischemia reperfusioninjury,SCIRI) 损伤过程中呈现差异性分布的特点[16]。
目前,对PDIA3分子的相关研究主要集中于哺乳动物的精卵融合及肿瘤免疫机制的研究等方面,其在日本血吸虫中的相关研究几乎处于空白状态。本课题组的研究发现SjCRT、SjHMGB1等应急分子可能与RAV诱导宿主产生高保护性效应机制有关[9,17],初步推断,辐照可引起这类应急分子的迁移,进而迁移后发挥一定的生物学效应。结合PDIA3与CRT及HMGB1之间的关系,我们推测,在RAV模型中,SjPDIA3可协助SjCRT这类应急分子胞内至胞外的迁移,从而增强凋亡或坏死虫体细胞的免疫原性。本研究以日本血吸虫cDNA文库为模板,利用PCR技术扩增SjPDIA3全长序列,并在原核表达载体pET28a (+) 中成功表达,利用重组蛋白SjPDIA3制备得到特异性良好的多克隆抗体血清,为我们后续研究SjPDIA3与SjCRT在RA血吸虫中的共定位问题提供材料。
[1] Chitsulo L, Engels D, Montresor A, et al.The global status of schistosomiasis and its control[J].Act a Trop, 2000, 77(1)∶ 41-51.
[2] 周晓农, 林丹丹, 汪天平, 等.我国“十二五”期间血吸虫病防治策略与工作重点[J].中国血吸虫病防治杂志, 2011, 23(1)∶ 1-4.
[3] 李莹, 李运燕, 徐瑞敏, 等.日本血吸虫钙网织蛋白在Sf9昆虫细胞中的表达及其活化树突细胞的初步分析[J].中国动物传染病学报, 2012, 20(4)∶ 45-51.
[4] 徐瑞敏.日本血吸虫热休克蛋白70(SjHSP70)的免疫学功能研究[D].北京∶ 中国农业科学院, 2013.
[5] T Panaretakis, Joza N, Modjtahedi N, et al.The cotranslocation of ERp57 and calreticulin determines the immunogenicity of cell death[J].Cell Death Differ, 2008, 15(9)∶ 1499-1509.
[6] 吕利霞, 汤睿智, 邢万金.PDIA3的结构与功能及其在精卵融合过程中的作用[J].生物技术通报, 2010, 3∶ 31-35.
[7] Ndubuisi M I, Guo G G, Fried V A, et al.Cellular physiology of STAT3∶ Where’s the cytoplasmic monomer[J].Biol Chem, 1999, 274(36)∶ 25499-25509.
[8] Altieri F, Maras B, Eufemi M, et al.Purification of a 57kD nuclear matrix protein associated with thiol∶protein-disulfide oxidoreductase and phospholipase C activities[J].Biochem Biophys Res Commun, 1993, 194(3)∶ 992-1000.
[9] Ohtani H, Wakui H, Ishino T, et al.An isoform of protein disulfide isomerase is expressed in the developing acrosome of spermatids during rat spermiogenesis and is transported into the nucleus of mature spermatids and epididymal spermatozoa[J].Histochemistry, 1993, 100(6)∶423-429.
[10] Natalia F K, Manali S P, Sachin H J, et al.Chromatinassociated proteins HMGB1/2 and PDIA3 trigger cellular response to chemotherapy-induced DNA damage[J].Mol Cancer Ther, 2009, 8(4)∶ 864-872.
[11] Frickel E M, Frei P, Bouvier M, et al.ERP57 is a multifunctional thiol-disulfide oxidoreductase[J].Bio Chem, 2004, 279 ( 18)∶ 18277-18287.
[12] Carlo T, Elisa G, Caterina G, et al.ERp57/GRP58∶ A protein with multiple [J].Cell Mol Bio Lett, 2011, 16(4)∶539-563.
[13] Garbi N, Hämmerling G, Tanaka S.Interaction of ERp57 and tapasin in the generation of MHC class Ⅰ-peptide complexes[J].Curr Opin Immunol, 2007, 19(1)∶ 99-105.
[14] Matsuo Y, Masutani H, Son A, et al.Physical and functional interaction of transmembrane thioredoxinrelated protein with major histocompatibility complex Class Ⅰheavy chain∶redox-based protein quality control and its potential relevance to immune response[J].Mol Biol Cell, 2009, 20(21)∶ 4552-4562.
[15] Krynetskaia N F, Phadke M S, Jadhav S H, et al.Chromatin-associated proteins HMGB1/2 and PDIA3 trigger cellular response to chemotherapy-induced DNA damage[J].Mol Cancer Ther, 2009, 8(4)∶ 864-872.
[16] 张善勇.急性脊髓缺血/再灌注损伤应激相关蛋白鉴定与功能分析[D].吉林∶ 吉林大学, 2013.
[17] 李运燕.辐照致弱日本血吸虫免疫生物学功能的初步研究[D].上海∶ 上海师范大学, 2013.
PROKARYOTIC EXPRESSION OF PDIA3 PROTEIN OF SCHISTOSOMA JAPONICUM AND PREPARATION OF POLYCLONAL ANTIBODIES
LIU Qun1,2, DUAN Ming-ming2, YUAN Chun-xiu2, LI Dan-dan1,2, GE Cheng1,2, MA Li-zhen2, FENG Xin-gang2
(1.College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China; 2.Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The objective of the present study was to express recombinant SjPDIA3 protein in E.coli and prepare polyclonal antibodies.The PDIA3 gene was amplifi ed in PCR using the genome of Schistosoma japonicum as a template.The PCR products obtained were inserted into prokaryotic expression vector pET28a(+).The recombinant plasmid pET28a(+)-SjPDIA3 was transformed into E.coli BL21(DE3).Subsequently, SjPDIA3 protein was expressed with induction of IPTG and purifi ed using NI-NTA resin.The BALB/c mice were immunized with recombinant SjPDIA3 protein to generate polyclonal antibodies.The results showed that a cDNA of 1482 bp was amplifi ed.Bioinformatics analysis determined that the full-length ORF was 1482 bp encoding 493 amino acids and SjPDIA3 protein had a thiol-disulfi de oxidoreductase domain and a signal peptide with no transmembrane peptide.Western blot demonstrated prokaryotic expression of the recombinant SjPDIA3 protein with molecular mass of 55 kDa and its effi cient antigenicity and immunogenicity as expected.
Schistosoma japonicum; SjPDIA3; prokaryotic expression; polyclonal antibody
S852.735
:A
:1674-6422(2015)01-0033-06
2014-04-17
中央级公益性科研院所基本科研业务费专项(2013JB15);动物血吸虫病创新团队基金
刘群,女,硕士研究生,动物学专业
冯新港,E-mail∶ boming666@163.com

