犬吉氏巴贝斯虫截短型抗原BgTRAP的重组表达及其在诊断上的初步应用
杨其清,曹 杰,周勇志,侯加法,周金林
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室, 上海200241,2.南京农业大学动物医学院,南京210095)
·研究论文·
犬吉氏巴贝斯虫截短型抗原BgTRAP的重组表达及其在诊断上的初步应用
杨其清1,2,曹 杰1,周勇志1,侯加法2,周金林1
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室, 上海200241,2.南京农业大学动物医学院,南京210095)
吉氏巴贝斯虫BgTRAP蛋白是一个重要的诊断抗原候选分子。为建立一种实用的犬吉氏巴贝斯虫血清学诊断方法,本研究选取BgTRAP C-末端跨膜区前,包含TSP功能区和抗原区的411个氨基酸的编码基因片段,重组表达了一个可溶性截短型BgTRAP抗原,解决了完整蛋白重组表达纯化的困难。免疫荧光试验表明,截短型抗原具有良好的抗原性。纯化的截短型抗原作为酶联免疫试验诊断抗原,可清晰地区分阴性及阳性犬血清,并与其他病原感染无交叉反应,具有良好的特异性。犬感染吉氏巴贝斯虫系列血清检测表明,该抗原可检测早期感染(4 d)和感染200 d以后的样本。结果提示,重组BgTRAP截短型抗原可作为一种诊断制剂检测犬吉氏巴贝斯虫抗体。
犬吉氏巴贝斯虫;截短型BgTRAP;诊断
吉氏巴贝斯虫是寄生在犬红细胞中的一种蜱传原虫,是犬梨形虫病(俗称焦虫病)的主要病原之一,可引起犬发热、贫血、血红蛋白尿和消瘦,甚至死亡[1,2]。目前,吉氏巴贝斯虫病的诊断主要依赖于红细胞染色镜检,但对于红细胞染虫率低的非急性感染诊断困难。因此,建立检测抗体的吉氏巴贝斯虫病血清学诊断方法极其重要[3,4]。早期用虫体抗原进行血清学诊断,其敏感性和特异性均不够理想。近几年,鉴定虫体重要抗原分子并应用重组蛋白进行血清学诊断取得了较大进展[4-8],其中,顶复体分泌蛋白BgTRAP(Babesia gibsoni thrombospondin-related adhesive proteins,凝血酶致敏相关粘附蛋白)是一个与细胞入侵有关的重要抗原分子,其原核表达的完整重组蛋白显示了一定的诊断价值[9,10]。但是BgTRAP全长编码基因表达产物主要以包涵体形式存在,可溶性蛋白表达量极少,分离纯化非常困难,不利于拓展该分子在诊断上的进一步应用。本研究通过对其编码基因进行生物信息学分析,选择主要免疫原性蛋白编码基因片段,重组高效表达其可溶性截短型抗原,并评估其截短型抗原作为酶联免疫联吸附试验(enzyme-linked immunoSorbent assay,ELISA)诊断抗原的应用价值。
1 材料和方法
1.1 菌种质粒大肠杆菌菌株DH5α、BL21(DE3)及含有吉氏巴贝斯虫 TRAP全长基因的克隆质粒pBluescript SK(+)/BgTRAP,均由中国农业科学院上海兽医研究所动物寄生虫病研究室提供;pGEX-4T-1载体购自Amersham Pharmacia Biotech 公司;pGEM-T Easy 载体购自Promega公司。
1.2 血清样本犬吉氏巴贝斯虫人工感染犬血清、正常犬血清、犬巴贝斯虫、犬巴贝斯虫罗氏株感染血清、犬巴贝斯虫韦氏株感染血清、犬巴贝斯虫指名株感染血清由日本国立原虫病研究中心馈赠;犬感染伊氏锥虫和刚第弓形虫血清由上海兽医研究所提供。
1.3 试剂DNA胶回收试剂盒、质粒提取试剂盒,以及Taq DNA聚合酶、限制性内切酶、DNA Marker购自TaKaRa公司;TEMED、Acr、Bis、T4 DNA连接酶购于Promega公司;氨苄青霉素、琼脂糖、IPTG、X-gal购自上海生工生物工程有限公司;透析袋、DTT、蛋白胨、酵母提取物、低分子量蛋白Marker购自上海普飞生物技术有限公司;感受态细胞购自北京博大泰克生物基因技术有限责任公司;羊抗犬IgG-HRP购于BETHYL Laboratories;ABTS [2,20-azinobis (3-ethylbenzthiazoline sulfonic acid)] 购于Sigma公司。
1.4 引物根据报道的吉氏巴贝斯虫BgTRAP基因序列和编码蛋白的结构分析[9],选取C-末端跨膜区前,包含TSP功能区和抗原区的411个氨基酸的1284 bp编码基因片段,设计PCR扩增引物:TRAP-F∶ 5'-GC GAATTCAGTGCACTGGCCCTTGAAGAG-3' (包含EcoR Ⅰ酶切位点GAATTC);TRAP-R∶ 5'-GACTCG AGCTTGTACTCCCAGAAAAGAG-3' (包含Xho Ⅰ酶切位点CTCGAA),引物由赛百盛公司合成。
1.5 BgTRAP基因的选择性片段的克隆和表达以含全长TRAP基因的重组质粒pBluescript SK(+)/ BgTRAP为模板、TRAP-F和TRAP-R为引物进行截短型抗原基因片段的PCR扩增,PCR扩增条件:94℃预变性2 min;然后94℃变性45 s,55℃退火 1 min,72℃延伸1.5 min,共30个循环;循环结束后72℃延伸7 min。PCR扩增反应产物于1.5%的琼脂糖凝胶上电泳分析。用DNA胶回收试剂盒回收PCR产物,将纯化产物经EcoR Ⅰ和Xho Ⅰ双酶切后,在T4 DNA连接酶作用下,连接于经同样内切酶酶切处理的pGEX-4T-1质粒中。将连接产物转化感受态细胞DH5α,提取重组质粒进行双酶切和PCR鉴定,阳性的重组质粒转化宿主菌BL21(DE3)。重组表达菌在37℃、1 mmol/L IPTG诱导下进行表达,对表达产物进行SDS-PAGE电泳分析。重组蛋白用GST融合蛋白纯化系统纯化,BCA试剂盒测定蛋白浓度。
1.6 重组蛋白抗血清的制备和免疫荧光试验将纯化的重组蛋白免疫小鼠,按常规免疫方法制备抗血清。免疫荧光试验参照文献[9]进行:选优质载玻片,洗净后浸泡于无水乙醇和乙醚等量混合液中,用时取出用绸布擦净。将PBS洗净后的感染吉氏巴贝斯虫犬红细胞滴于玻片上,用含2.5%丙酮的甲醇固定30 min,固定后以冷的PBS(0.01 mol/L、pH 7.4)浸泡冲洗,制备感染巴贝斯虫红细胞抗原片,最后以蒸馏水冲洗,防止自发性荧光。取固定标本,加不同稀释度的重组GST-TRAP免疫鼠血清(试验组)或重组GST免疫鼠血清(对照组),37℃孵育30 min。PBS冲洗3次,每次5 min,再加1∶5000稀释的荧光标记的羊抗鼠抗体,37℃孵育30 min。PBS冲洗 3次,每次5 min,加含50 μg/mL RNase A 的6.25 μg/mL propidium iodide(PI)。PBS冲洗 3次,每次5 min,加甘油缓冲液,封片,荧光显微镜检和激光显微镜检查。
1.7 酶联免疫吸附试验(ELISA)
1.7.1 特异性分析 选用人工感染吉氏巴贝斯虫的犬血清、正常犬血清、犬巴贝斯虫感染血清、伊氏锥虫感染犬血清和刚第弓形虫感染犬血清,以重组蛋白为诊断抗原,检测ELISA方法的特异性。其中重组蛋白GST-TRAP和对照GST蛋白分别以0.1 μg/mL包被96孔板,空白对照加PBS。待检血清用PBST 1∶200稀释,二抗为辣根过氧化物酶标记的羊抗鼠IgG,用PBST 1∶4000稀释使用。底物为新配制的ABTS酶底物液,ELISA结果用酶标仪在波长415 nm处测OD值表示。
1.7.2 人工感染犬抗体消长检测 约10 000个吉氏巴贝斯虫染虫红细胞经皮下注射人工感染的比格犬,感染后从0~200 d的不同时间段,分别采集犬血液,制备感染后不同时间的系列血清,应用本研究建立的ELISA方法进行犬体内抗体消长的检测分析。
2 结果
2.1 BgTRAP编码基因及其演绎蛋白的生物信息学分析周金林等[9]在2006年首次报道了吉氏巴贝斯虫BgTRAP分子的鉴定,该分子为顶复体分泌的具有很强免疫原性的功能分子,与吉氏巴贝斯虫入侵红细胞的生物学过程密切相关。BgTRAP全长cDNA序列已登录GenBank,序列号:AB053292。BgTRAP基因全长2373 bp,含有一个编码735个氨基酸的开放阅读框架(open reading frame,ORF)。SignalP软件(http∶//www.cbs.dtu.dk/services/SignalP/)预测显示,在其演绎蛋白的N-端有一个疏水性的信号肽序列;成熟的蛋白由713个氨基酸构成,分子量为80 kDa。蛋白质含有 vWFA 和TSP1两个功能结构域;在C-末端有一个转膜区;另外,在TSP1和转膜区间是谷氨酸富含区,包括3个五联谷氨酸重复,是蛋白质免疫原性区段。BgTRAP预测蛋白的结构分析(http∶//smart.embl-heidlberg.de /smart/job_status.)见图1。
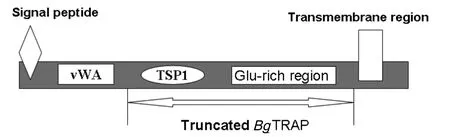
图1 BgTRAP蛋白分子的一级结构示意图Fig.1 The illustration of deduced protein BgTRAP primary structure
2.2 BgTRAP截短型基因的克隆和表达以含有全长吉氏巴贝斯虫BgTRAP基因序列的质粒pBluescript SK(+)/BgTRAP为模板,经截短型基因特异性引物TRAP-F和TRAP-R的PCR扩增,获得大小为1233 bp左右的特异片段(图2),与预期大小一致。目的基因经胶回收,连接于表达质粒pGEX-4T-1中,阳性质粒通过测序分析,证实目的基因已连接到表达载体质粒中。重组阳性质粒转化宿主菌BL21(DE3)后,经1 mmol/L IPTG诱导表达。SDS-PAGE结果表明,空质粒pGEX-4T-1表达的GST标签蛋白为26 kDa左右,重组质粒表达的融合蛋白约为71 kDa左右,与预期大小45 kDa基本一致。细菌经反复冰融和超声波处理后,并用SDS-PAGE检测,表明该融合蛋白以可溶性的蛋白形式存在,表达产物经GST融合蛋白纯化系统纯化,得到单一条带(图3)。

图2 吉氏巴贝斯虫BgTRAP基因PCR产物的电泳结果Fig.2 PCR products of BgTRAP

图3 重组蛋白BgTRAP蛋白的表达与纯化Fig.3 Expression and purifi cation of recombinant truncated BgTRAP
2.3 重组蛋白抗血清的制备和免疫荧光试验重组截短型蛋白和对照GST蛋白免疫小鼠后,经琼脂扩散实验测定效价1∶16以上,眼球采血,制备抗血清。抗血清梯度稀释后进行免疫荧光实验,结果表明,抗重组蛋白的抗血清可以与红细胞中的虫体发生特异性反应,而与宿主红细胞无反应。对照GST蛋白的抗血清则无反应信号(图4)。

图4 抗重组蛋白抗血清与吉氏巴贝斯虫表面反应的激光显微图Fig.4 Localization of antigens recognized by the antirBgTRAP serum in confocal laser micrographs
2.4 ELISA方法特异性实验结果表明,重组BgTRAP作为ELISA 诊断抗原,可以明确区分吉氏巴贝斯虫感染犬血清和正常犬血清,而对照GST蛋白则对阴性和阳性血清样品都没有反应。犬巴贝斯虫不同亚种、犬弓形虫和锥虫感染血清测试结果显示,只有吉氏巴贝斯虫感染犬血清能被检测出,其他寄生虫感染血清均为阴性(图5)。
2.5 感染吉氏巴贝斯虫犬抗体消长的ELISA检测以重组蛋白为抗原建立的ELISA方法进行检测,对一条人工感染吉氏巴贝斯虫的犬的系列血清的检测结果表明,感染后4 d即可检测到明显的抗体,7 d后抗体维持在较高的水平,到感染后207 d抗体均维持较高水平,此时犬感染后红细胞染虫率很低(图6)。

图5 重组蛋白为抗原的ELISA方法特异性检测Fig.5 The specifi city of ELISA using the recombinant truncated BgTRAP as diagnosis antigen

图6 人工感染吉氏巴贝斯虫犬的抗体消长变化Fig.6 Dynamic changes of antibody to rBgTRAP in a dog experimentally infected with B.gibsoni
3 讨论
通过去除跨膜区等疏水性区域编码基因的方法,重组表达截短型可溶性蛋白已有不少成功范例[11,12]。吉氏巴贝斯虫BgTRAP分子量为80 kDa,从N端到C端,依次含有信号肽、vWFA 和TSP1两个功能结构域、谷氨酸富含区和跨膜区[9]。本研究根据该分子的结构特点,选取C-末段跨膜区前, 包含TSP功能区和抗原区的45 kDa大小的多肽作为截短型抗原,成功进行了高效可溶性表达。这为该蛋白大量分离纯化提供了重要基础,解决了全长基因表达的蛋白产量少、难提纯的问题。
截短型重组蛋白是否保留抗原性是本研究成败的另一个关键。通过免疫荧光和激光显微镜观察,证实了该蛋白保留了完整抗原的类似抗原性。以BgTRAP截短型抗原作为ELISA 诊断抗原,可以明确区分吉氏巴贝斯虫感染犬血清和正常犬血清,对犬巴贝斯虫其他亚种感染、锥虫感染和弓形虫感染犬血清也没有交叉反应,显示了该抗原良好的诊断特异性。对感染犬的系列血清的检测结果显示,在感染早期以及慢性感染期均可检测,表明该重组蛋白具有较好的应用价值。
血液原虫的检测方法主要依赖血片镜检,但低染虫率常导致漏检。犬吉氏巴贝斯虫感染后,红细胞染虫率在2~3 w有一个峰期,容易在血片中观察到,但在感染早期和慢性期,红细胞染虫率极低,很难用血片观察到。尽管PCR技术也可以用于低染虫率的犬吉氏巴贝斯虫病的诊断[13-15],但血清学检测方法由于样本处理简单并且可同时检测众多样品,特别适合于流行病学调查或大量样本检测,因此是防治工作中不可替代的重要技术之一。本研究获得的高效表达可溶性截短型BgTRAP抗原,将为研发相关诊断试剂盒提供基础。
[1] Boozer A L, Macintire D K.Canine babesiosis[J].Vet Clin North Am Small Anim Pract, 2003, 33(4)∶ 885-904.
[2] Miyama T, Sakata Y, Shimada Y, et al.Epidemiological survey of Babesia gibsoni infection in dogs in eastern Japan[J].J Vet Med Sci, 2005, 67(5)∶ 467-471.
[3] Jia H, Terkawi M A, Aboge G O, et al.Identification of secreted antigen 3 from Babesia gibsoni[J].Clin Vaccine Immunol, 2009, 16(6)∶ 944-948.
[4] Fukumoto S, Xuan X, Nishikawa Y, et al.Identification and expression of a 50-kilodalton surface antigen of Babesia gibsoni and evaluation of its diagnostic potential in an enzyme-linked immunosorbent assay[J].J Clin Microbiol, 2001, 39(7)∶ 2603-2609.
[5] Aboge G O, Jia H, Kuriki K, et al.Molecularcharacterization of a novel 32-kDa merozoite antigen of Babesia gibsoni with a better diagnostic performance by enzyme-linked immunosorbent assay[J].Parasitol, 2007, 134(Pt9)∶ 1185-1194.
[6] Goo Y K, Jia H, Aboge G O, et al.Characterization of the Babesia gibsoni 12-kDa protein as a potential antigen for the serodiagnosis[J].Parasitol Int, 2009, 58(1)∶ 55-60.
[7] Jia H, Zhou J, Ikadai H, et al.Identification of a novel gene encoding a secreted antigen 1 of Babesia gibsoni and evaluation of its use in serodiagnosis[J].Am J Trop Med Hyg, 2006, 75(5)∶ 843-850.
[8] Zhou J, Jia H, Nishikawa Y, et al.Babesia gibsoni rhoptry-associated protein 1 and its potential use as a diagnostic antigen[J].Vet Parasitol, 2007, 145(1-2)∶ 16-20.
[9] Zhou J, Fukumoto S, Jia H, et al.Characterization of the Babesia gibsoni P18 as a homologue of thrombospondin related adhesive protein[J].Mol Biochem Parasitol, 2006, 148(2)∶ 190-198.
[10] Goo Y K, Jia H, Aboge G O, et al.Babesia gibsoni∶Serodiagnosis of infection in dogs by an enzyme-linked immunosorbent assay with recombinant BgTRAP[J].Exp Parasitol, 2008, 118(4)∶ 555-560.
[11] Chahan B, Gaturaga I, Huang X, et al.Serodiagnosis of Neospora caninum infection in cattle by enzymelinked immunosorbent assay with recombinant truncated NcSAG1[J].Vet Parasitol, 2003, 118(3-4)∶ 177-185.
[12] Huang X, Xuan X, Yokoyama N, et al.High-level expression and purification of a truncated merozoite antigen-2 of Babesia equi in Escherichia coli and its potential for immunodiagnosis[J].J Clin Microbiol, 2003, 41(3)∶ 1147-1151.
[13] Birkenheuer A J, Levy M G, Breitschwerdt E B.Development and evaluation of a seminested PCR for detection and differentiation of Babesia gibsoni and B.canis DNA in canine blood samples[J].J Clin Microbiol, 2003, 41 (9)∶ 4172-4177.
[14] Fukumoto S, Xuan X, Shigeno S, et al.Development of a polymerase chain reaction method for diagnosing Babesia gibsoni infection in dogs[J].J Vet Med Sci, 2001, 63(9)∶977-981.
EXPRESSION AND PRELIMINARY APPLICATION OF RECOMBINANT TRUNCATED BGTRAP OF BABESIA GIBSONI
YANG Qi-qing1,2, CAO Jie1, ZHOU Yong-zhi1, HOU Jia-fa2, ZHOU Jin-lin1
(1.Key Laborator of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2.College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China)
The BgTRAP protein of Babesia gibsoni is an important candidate for the development of a diagnostic reagent for canine babesiosis.In order to develop a diagnostic method for practical use, the gene fragment encoding truncated BgTRAP that covered TSP region and antigenic area ahead of transmembrane region was cloned and expressed in E.coli in soluble form.The recombinant truncated BgTRAP protein showed strong antigenicity in indirect fluorescent-antibody test and ELISA.The ELISA method using truncated BgTRAP protein was able to differentiate B.gibsoni-infected dog serum and non-infected dog serum.In dogs experimentally infected with B.gibsoni, ELISA method also detected antibody response as early as 4 days, or as late as 200 days post infection.These results demonstrated that the recombinant truncated BgTRAP protein might be a useful diagnostic reagent for detection of B.gibsoni antibodies in dogs.
Babesia gibsoni; truncated BgTRAP; diagnosis
S852.723
:A
:1674-6422(2015)01-0021-06
2014-05-29
卫生行业科研专项经费资助项目(201202019)
杨其清, 男,博士,主要从事小动物疾病研究
周金林,E-mail∶ jinlinzhou@shvri.ac.cn

