C3、C4及联合多项指标检测在腹腔积液良恶性鉴别中的诊断价值
C3、C4及联合多项指标检测在腹腔积液良恶性鉴别中的诊断价值
郭正武孙静芳胡高峰续薇
(吉林大学第一医院检验科,吉林长春130021)
摘要〔〕目的探讨补体C3、C4及多项指标联合检测在腹腔积液良恶性鉴别诊断中的应用价值。方法收集2014年3~8月该院的85例良性和43例恶性腹腔积液,采用免疫散射比浊法测定C3、C4、高敏C-反应蛋白(hs-CRP)及铁蛋白(FERR),电化学发光法测定甲胎蛋白(AFP)、CA125、CA199、癌胚抗原(CEA),酶速率法测定胆固醇(CHO),采用受试者工作曲线(ROC)及Logistic回归分析各指标及联合多项指标检测对腹腔积液鉴别诊断的价值。结果与良性腹水组相比,恶性腹腔积液组CA125、CA199、CEA、C3、C4、CHO、hs-CRP及FERR均增高(P均<0.05),其检测灵敏度分别为55.8%,44.2%,60.5%,86.0%,90.7%,60.5%,79.1%,51.2%;特异性分别为85.9%,96.5%,92.9%,90.6%,84.7%,89.4%,74.1%,76.5%;准确度为75.8%,78.9%,82.0%,89.1%、88.3%,79.7%,75.8%,68.0%。采用CA199、CEA、C4、FERR联合检测后,其灵敏度、特异性、准确度分别为93.0%,92.9%,93.8%。结论恶性腹腔积液中补体C3、C4升高,且在单项指标中,C3及C4对于恶性腹腔积液的诊断价值最高,联合多项指标检测后可为恶性腹腔积液提供较高的诊断价值。
关键词〔〕腹腔积液;补体;标志物
中图分类号〔〕R446.19〔文献标识码〕A〔
通讯作者:续薇(1956-),女,博士生导师,主任医师,主要从事血液病与肿瘤分子生物学研究。
第一作者:郭正武(1989-),男,硕士,主要从事血液病与肿瘤的分子诊断研究。
腹腔积液是常见的临床表现之一,病因较多。恶性腹腔积液的出现往往预示着肿瘤已发生转移。腹腔积液脱落细胞学检查是诊断恶性腹腔积液的金标准,但敏感性低,诊断的阳性率只有40%~60%。随着对于恶性腹腔积液研究的增多,乳酸脱氢酶(LDH)、腺苷脱氨酶(ADA)、胆固醇(CHO)、基质金属蛋白酶、铁蛋白(FERR),肿瘤标志物等一系列检测指标应用于腹腔积液良恶性的鉴别中。这些检测提高了恶性腹腔积液的诊断正确率,但目前这些检测的灵敏度和特异性尚不能满足临床需求。已有研究证实,肿瘤组织中补体升高〔1,2〕,本研究通过检测腹腔积液中补体C3、C4水平及联合检测多项肿瘤标志物、生化指标,以期更好地鉴别诊断恶性腹腔积液。
1对象与方法
1.1对象选取我院2014年3~8月收集到的住院并且已确诊良恶性的腹腔积液128例,其中恶性腹腔积液43例,良性85例。恶性腹腔积液组43例患者中,胃癌14例,卵巢癌10例,宫颈癌2例,结肠癌3例,肺癌2例,胆囊癌3例,胰腺癌3例,膀胱癌1例,未明原发部位者5例,其中男18例,女25例,平均年龄57.4岁,均经过手术、影像、病理、脱落细胞学检查等手段确诊恶性腹腔积液。良性组腹腔积液包括肝硬化组74例,心衰患者6例,肾衰患者5例,男48例,女37例,平均年龄54.6岁,以上所有样本均经临床确诊,且未进行过相关治疗。
1.2检测仪器和方法采用我科日立7600-210ISE型全自动生化仪器测试FERR、CHO。铁蛋白采用免疫散射比浊法测定,CHO采用酶法测定。瑞士罗氏CobasE601型电化学发光分析仪测定癌胚抗原(CEA),甲胎蛋白(AFP),糖类抗原(CA)125,CA199,测定方法为电化学发光;西门子BNⅡ型全自动特定蛋白分析仪测定C3、C4、高敏C-反应蛋白(hs-CRP),测定方法为免疫散射比浊法。所有测试均在6h内完成。
1.3样本收集方法所有样本均在送到检验科12h内用无菌20ml试管收集后3 000r/min离心10min,取2ml上清液体于无菌试管中-20℃保存,1个月内进行测定。乳糜及血性腹腔积液经离心后仍乳浊及血性者弃去。
1.4统计学方法采用SPSS16.0软件进行Mann-WhitneyU检验、绘制ROC并进行LogisticRegression运算。
2结果
2.1各项指标在良恶性腹腔积液中的检测结果除恶性腹腔积液与良性腹腔积液AFP组间比较无统计学差异外(P=0.368),其他各项指标均在恶性腹腔积液中增高(P<0.05),见表1。
2.2各项指标对于良恶性腹腔积液诊断价值将各组数据经过ROC曲线分析后,选取约登指数最大的点为cut-off值,大于cut-off值可认为其为恶性腹腔积液的可能性较大,用SPSS计算这些指标鉴别诊断良恶性腹腔积液的灵敏度、特异性和准确度及曲线下面积(AUC)。
由表2可知,CA125及FERR诊断价值较低,CA199、CEA、CHO、hs-CRP对于良恶性腹腔积液鉴别有一定准确度,而C3及C4的测定对于良恶性腹腔积液的鉴别来说具有较高的准确度。已知AUC在0.8以上时其诊断价值较好。
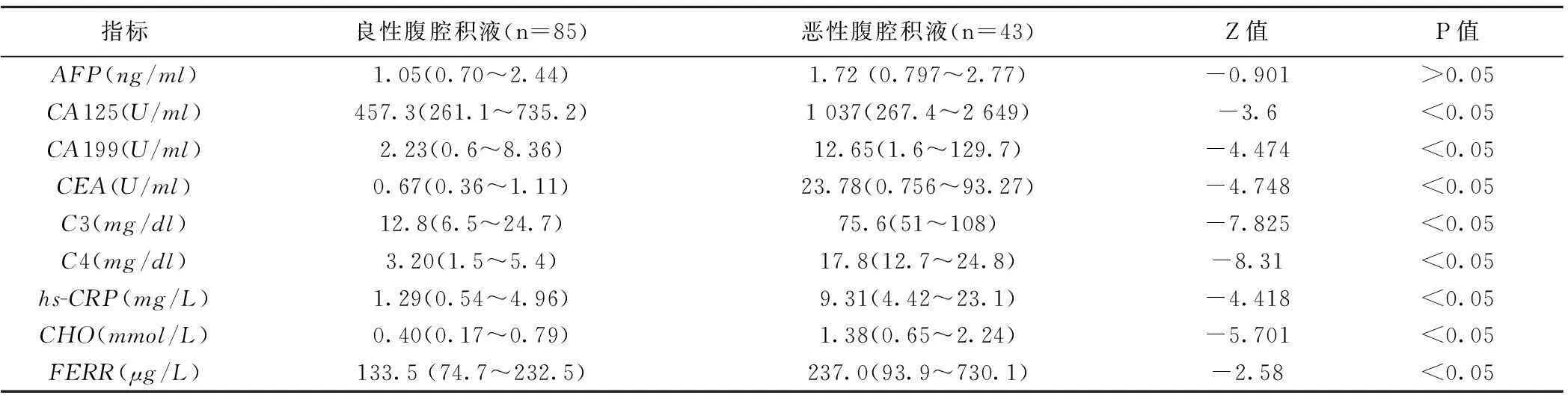
表1 9项指标在良恶性腹腔积液中的测定结果〔 P50( P25~ P75)〕
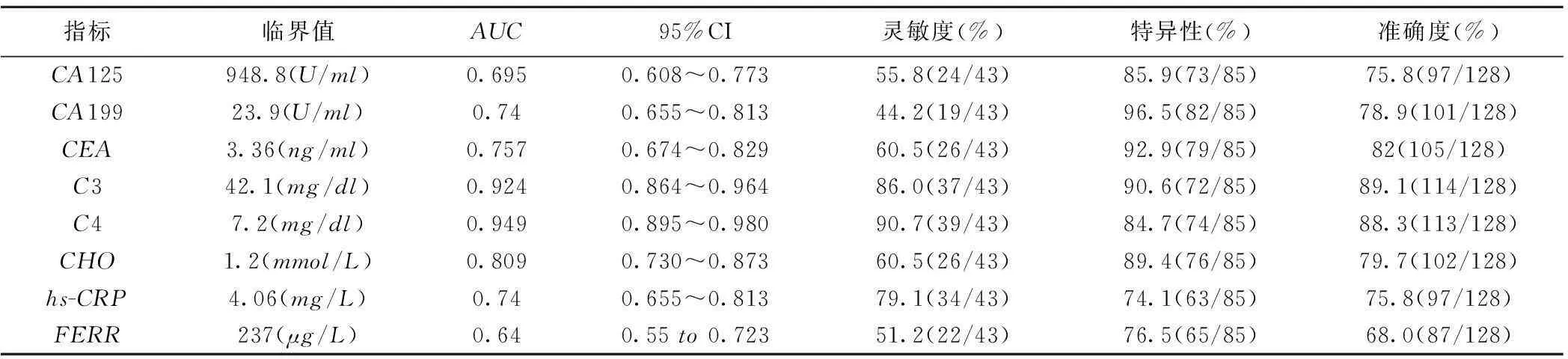
表2 各指标对于良恶性腹腔积液的诊断价值
对上述指标先进行单因素LogisticRegression回归分析,将有意义的指标进行多因素分析,分别进行前向逐步分析与后向逐步分析,选取准确度较高的后向逐步分析结果纳入方程,将符合条件的C3、C4,CA199,CEA,CA125,CHO,FERR纳入回归方程,并对联合指标产生的新变量PRE-1绘制的ROC进行分析后得出,C4、CEA、CA199及FERR联合诊断时AUC最大(0.983),95%CI为(0.939~0.997),对应的Logistic回归方程为Y=1/ 〔 1+e-(-5.739 + 0.035CA199+ 0.08CEA+ 33.121C4+0.001FERR) 〕,最佳预测概率值为0.321,预测概率值≥0.321时,诊断为恶性腹腔积液。诊断灵敏度、特异性及准确度分别为93.0%,92.9%,93.8%,其检测的灵敏度及特异性均较单一指标检测提高。见表3。
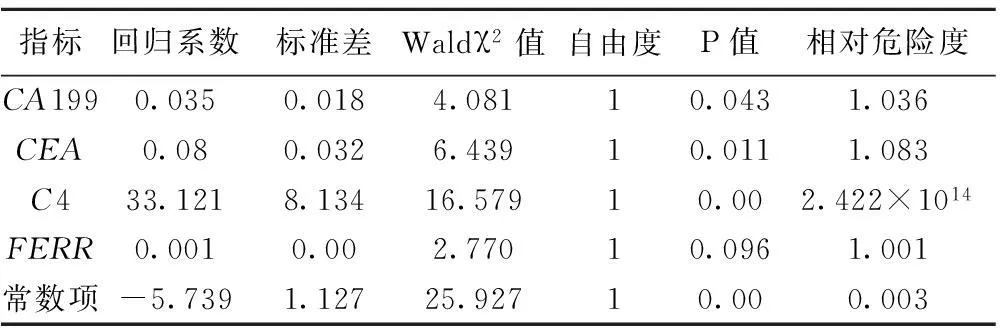
表3 Logistic回归分析结果
3讨论
在临床工作中,很多良性疾病可导致腹腔积液的产生,其与恶性肿瘤引起的腹腔积液常需进行鉴别诊断。临床上已应用包括脱落细胞学、肿瘤标志物检测、生化检测等手段对腹腔积液进行鉴别诊断。近期以来,肿瘤细胞与周围环境中炎症分子间相互作用逐渐引起重视,已有研究表明肿瘤周围微环境中白细胞介素(IL)-10、转录活化因子(STAT)3、转化生长因子(TGF)-β等分子可抑制机体的免疫活动,使得肿瘤细胞更易发生免疫逃逸,且肿瘤在发生转移后,可以改变新的转移部位的一些免疫分子数量,这些分子可作为肿瘤转移的标志物。
补体是机体的固有免疫系统中具有重要酶活性的蛋白质分子,作为固有免疫重要的组成部分,广泛参与机体抗感染的防御反应、恶变细胞的清除以及免疫调节。在肿瘤细胞表面已发现一些抵抗补体发挥作用的分子,如补体调节蛋白CD46、CD55 及CD59,使得肿瘤细胞周围微环境中补体沉积。这些细胞膜补体调节蛋白在肿瘤表面的过度表达,抑制了补体系统的正常作用,介导了肿瘤细胞的免疫耐受。一些研究已证实中和补体或清除补体可以更好地发挥药物作用和增强自然杀伤(NK)细胞的杀伤肿瘤的作用〔3〕。肿瘤细胞表面补体调节蛋白的表达可使得肿瘤周围微环境中的补体升高,同时一些研究也表明在肿瘤患者中可发现补体系统的表达增强,参与肿瘤细胞的免疫逃逸〔4〕,这些发现揭示了肿瘤免疫逃逸机制的多样性和复杂性。研究表明,相对于良性腹腔积液而言,恶性腹腔积液中的补体C3和C4也会升高〔5〕,其可以作为辅助诊断恶性腹腔积液的良好指标。
AFP是临床上用于筛查肝癌的特异性指标,在血液检测中具有良好的诊断价值。CA125在包括良性腹腔积液在内的患者腹腔积液均呈明显升高。具体机制尚不明确,或许与腹腔积液的产生刺激间皮细胞CA125基因表达,产生大量CA125分泌入腹腔积液有关。CA199和CEA均可在胰腺癌、结直肠癌及胃癌等多种肿瘤中升高,对于腹腔积液良恶性鉴别来说,两者诊断恶性腹腔积液准确度较高,具有较好的诊断价值,灵敏度及特异性与一些国内外研究结论相似〔6,7〕。
CHO是脂类代谢物质,有文献报道其在恶性腹腔积液中含量常增高。本研究显示CHO作为鉴别良恶性腹腔积液诊断价值较好,研究结果与国外报道一致〔8〕。hs-CRP及FERR均为急性时相蛋白,有报道认为他们在腹腔积液中的含量可在肿瘤存在的情况下增高〔9〕。本研究发现CRP及FERR在良恶性腹腔积液鉴别中虽有作用,但诊断价值较小。补体也可成为检测肿瘤的良好标志物。
4参考文献
1CanalesNA,MarinaVM,CastroJS,et al.A1BGandC3areoverexpressedinpatientswithcervicalintraepithelialneoplasiaⅢ〔J〕.OncolLett,2014;8(2):939-47.
2LeeI,ChenCH,SheuJC,et al.IdentificationofcomplementC3aasacandidatebiomarkerinhumanchronichepatitisCandHCV-relatedhepatocellularcarcinomausingaproteomicsapproach〔J〕.Proteomics,2006;6(9):2865-73.
3WangSY,VeeramaniS,RacilaE,et al.DepletionoftheC3componentofcomplementenhancestheabilityofrituximab-coatedtargetcellstoactivatehumanNKcellsandimprovestheefficacyofmonoclonalantibodytherapyinaninvivomodel〔J〕.Blood,2009;114(26):5322-30.
4ChenJ,WuW,ChenL,et al.Profilingthepotentialtumormarkersofpancreaticductaladenocarcinomausing2D-DIGEandMALDI-TOF-MS:Up-regulationofComplementC3andalpha-2-HS-glycoprotein〔J〕.Pancreatology,2013;13(3):290-7.
5BjørgeL,HakulinenJ,VintermyrO,et al.Asciticcomplementsysteminovariancancer〔J〕.BrJCancer,2005;92(5):895-905.
6KaletaEJ,TolanNV,NessKA,et al.CEA,AFPandCA19-9analysisinperitonealfluidtodifferentiatecausesofascitesformation〔J〕.ClinBiochem,2013;46(9):814-8.
7谷欢,邓翔宇,严璐,等.联合检测腹水、血清肿瘤标志物及其比值对鉴别良恶性腹水的诊断价值〔J〕.中国现代医学杂志,2011;21(14):1595-9.
8GulyasM,KaposiA,ElekG,et al.Valueofcarcinoembryonicantigen(CEA)andcholesterolassaysofasciticfluidincasesofinconclusivecytology〔J〕.JClinPathol,2001;54(11):831-5.
9YukselI,KaraahmetF,CoskunY,et al.SignificanceofserumandasciticfluidC-reactiveproteinindifferentialdiagnosisofbenignandmalignantascites〔J〕.DigDisSci,2014;59(10):2588-93.
〔2015-03-26修回〕
(编辑李相军/滕欣航)

