酿酒酵母吸附海水中铅离子的研究
(国家海洋局天津海水淡化与综合利用研究所,天津300192)
随着沿海地区经济的发展和人类海洋活动的频繁,海洋污染日益严重。据统计,2014年我国主要河流排海污染物中重金属为2.1万t,其中铅为1 830t。这些重金属被排入近海海域,因其不能被生物分解代谢而在生物体内累积传递,严重威胁海洋生态环境和人类健康。
生物吸附是利用生物体及其衍生物对水中重金属离子的吸附作用去除重金属的过程[1]。与传统吸附剂相比,生物吸附剂具有适应性广、选择性高、再生能力强、运行成本低等优点,在重金属污染废水处理领域具有广阔的应用前景[2-3]。目前研究较多的生物吸附材料有细菌[4]、真菌[5-8]、藻类[9-10]和农林废弃物,主要集中在对淡水中Cu2+、Cd2+、Zn2+、Cr2+的吸附效果和机理研究[11-12],而对海水中重金属离子吸附行为的研究[13]较少。
作者以酿酒酵母冻干粉为吸附材料,研究其对海水中Pb2+的最佳吸附条件,包括pH 值、吸附剂用量、吸附温度、Pb2+初始浓度、吸附时间等,并对吸附动力学过程和吸附模型进行分析,系统研究酿酒酵母对海水中Pb2+的吸附性能,以期为微生物吸附海水中重金属提供参考。
1 实验
1.1 材料、培养基与仪器
酿酒酵母菌种,由天津科技大学食品工程学院提供。将酿酒酵母接种到发酵培养基中,28 ℃、160r·min-1恒温培养72h;10 000r·min-1离心5min,收集菌体,冷冻干燥后研磨过筛,备用。用优级纯硝酸铅配制模拟含Pb2+海水。
YPDA 液体培养基:蛋白胨20g,酵母提取物10g,葡萄糖2g,0.2%腺嘌呤溶液15mL,加蒸馏水定容至1L,pH 值6.5,115 ℃灭菌30min。
YPDA 固体培养基:YPDA 液体培养基中加入1.5%琼脂。
PL2002型电子天平,Mettler Toledo 公司;sky-2102C型摇床,上海苏坤实业有限公司;Orion 3Star型pH 计、iCAP6500型电感耦合等离子体发射光谱仪,美国Thermo公司;原子力显微镜,美国Vecco公司;离心机,德国Sigma公司。
1.2 方法
1.2.1 吸附条件实验
称取一定量的硝酸铅溶解于去离子水中配制1g·L-1的Pb2+储备液。将取自天津天碱海水净化厂澄清池的陈海水过滤,加入一定量的Pb2+储备液。在250mL三角瓶中加入100mL含Pb2+海水,调节一定的pH 值、吸附剂用量、吸附温度、Pb2+初始浓度,吸附一定时间后置于25 ℃摇床中160r·min-1恒温振荡4h,10 000r·min-1离心5 min,测定上清液中剩余Pb2+的浓度。海水pH 值用1mol·L-1的NaOH 溶液或HNO3溶液调节。
1.2.2 等温吸附实验
等温吸附条件为:pH 值6、吸附剂用量1.0g·L-1、吸附温度40℃、摇床转速160r·min-1,在Pb2+初始浓度分别为10mg·L-1、20mg·L-1、40mg·L-1、60mg·L-1、80mg·L-1、100mg·L-1时振荡反应4h,测定海水中剩余Pb2+的浓度。
1.2.3 吸附动力学实验
吸附动力学条件为:pH 值6、Pb2+初始浓度50 mg·L-1、吸附剂用量1.0g·L-1、吸附温度40 ℃、摇床转速160r·min-1,分别振荡反应5min、10min、20min、30min、40min、60min、120min、180min、240 min,测定海水中剩余Pb2+的浓度。
1.3 吸附量和吸附率的计算
吸附量(q)和吸附率(p)分别按式(1)、(2)计算:

式中:q为吸附量,mg·g-1;V为海水体积,L;c0为海水中Pb2+初始浓度,mg·L-1;c1为吸附平衡时海水中Pb2+浓度,mg·L-1;ms为酿酒酵母干质量,g;p为吸附率,%。的吸附位点,导致吸附剂的吸附量降低;pH 值较大,Pb2+易与水中的OH-形成不溶性的氧化物或氢氧化物的沉淀[14],并覆盖于吸附剂表面,抑制了酿酒酵母对Pb2+的吸附,也导致吸附量降低。

图1 pH 值对酿酒酵母吸附Pb2+的影响Fig.1 Effect of pH value on adsorption of Pb2+by Saccharomyces cerevisiae
2.1.2 吸附剂用量对酿酒酵母吸附Pb2+的影响
吸附剂用量直接影响吸附效果,用量太少不能有效吸附金属离子,用量过多容易造成资源浪费。在Pb2+初始浓度为50mg·L-1、吸附温度为25 ℃、pH值为6的条件下,考察吸附剂用量(0.5~4.0g·L-1)对酿酒酵母吸附Pb2+的影响,结果见图2。
2 结果与讨论
2.1 吸附条件研究
2.1.1 pH 值对酿酒酵母吸附Pb2+的影响
pH 值不仅影响金属离子化学存在状态,还对吸附剂表面吸附位点的数量有很大的影响。在Pb2+初始浓度为50mg·L-1、吸附剂用量为1.0g·L-1、吸附温度为25 ℃的条件下,考察pH 值(3~8)对酿酒酵母吸附Pb2+的影响,结果见图1。
从图1 可以看出,pH 值对酿酒酵母吸附海水中Pb2+影响较大。在pH 值为5~7 时,酿酒酵母对Pb2+的吸附效果较好,吸附率维持在90%以上,且在pH 值为6时,酿酒酵母的吸附率和吸附量均达到最高,分别为98.87%和43.6mg·g-1;当pH 值增大到7时,溶液中出现了大量白色沉淀,虽然吸附率维持在90.23%,但是吸附量下降到34.5 mg·g-1。这是因为,溶液pH 值较小时,吸附剂表面带负电荷,水合氢离子和海水中Mg2+、Ca2+等会与Pb2+竞争菌体表面
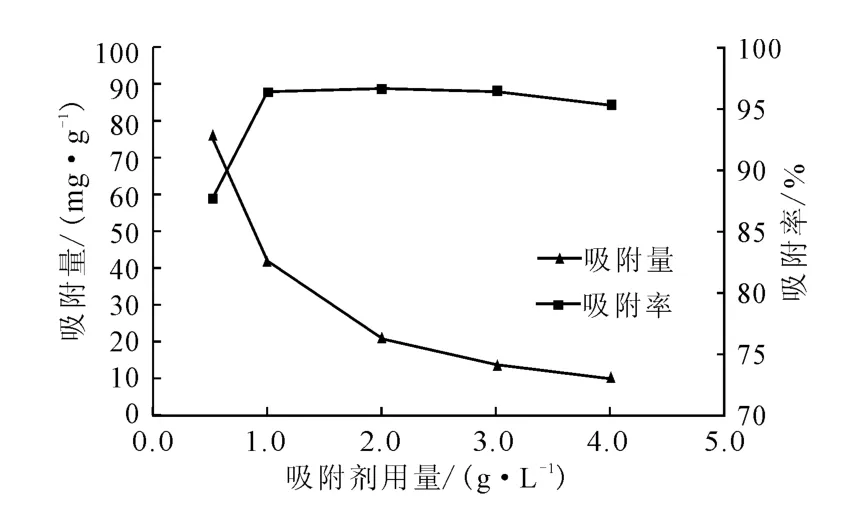
图2 吸附剂用量对酿酒酵母吸附Pb2+的影响Fig.2 Effect of adsorbent dosage on adsorption of Pb2+by Saccharomyces cerevisiae
从图2可以看出,随着吸附剂用量的增加,吸附量从76.1mg·g-1下降到10.34mg·g-1,而吸附率上升,并维持在95%以上。这是因为,在一定浓度范围内,增加吸附剂用量,可以增大吸附剂的比表面积,给Pb2+提供更多的吸附位点,吸附率上升;但吸附剂用量增加到一定值后,菌体间相互聚集,粒径增大,吸附剂比表面积减小,活性吸附位点被覆盖,吸附量下降[15-16],但是总的吸附容量能满足海水中Pb2+的浓度(50mg·L-1),因此酿酒酵母对海水中Pb2+具有较好的吸附效果。
2.1.3 吸附温度对酿酒酵母吸附Pb2+的影响
在吸附剂用量为1.0g·L-1、Pb2+初始浓度为50 mg·L-1、pH 值为6 的条件下,考察吸附温度(10~80 ℃)对酿酒酵母吸附Pb2+的影响,结果见图3。
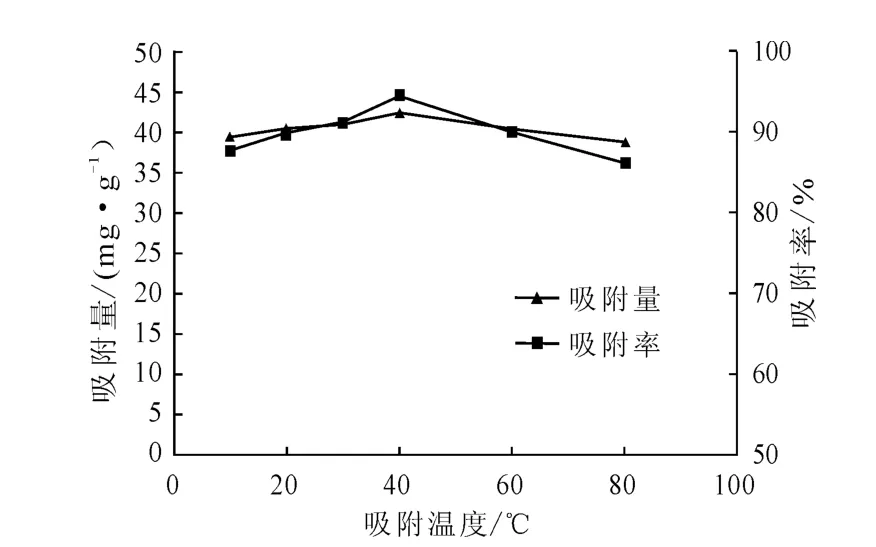
图3 吸附温度对酿酒酵母吸附Pb2+的影响Fig.3 Effect of adsorption temperature on adsorption of Pb2+by Saccharomyces cerevisiae
从图3可以看出,在吸附温度低于40 ℃时,吸附量和吸附率均随吸附温度的升高而上升;在吸附温度为40 ℃时,吸附量和吸附率均达到最高,分别为42.6 mg·g-1和94.57%;继续升高温度,吸附量和吸附率略有下降。从图3还可以看出,在实验温度范围内,单位吸附量的最大差值(Δq)为3.8mg·g-1,说明酿酒酵母作为生物吸附剂具有较宽的温度适应范围,生物吸附为离子交换过程,温度对吸附效果的影响较小。
2.2 等温吸附研究
2.2.1 海水中Pb2+初始浓度对酿酒酵母吸附Pb2+的影响
在吸附温度为40 ℃、吸附剂用量为1.0g·L-1、pH 值为6的条件下,考察Pb2+初始浓度(10~100mg·L-1)对酿酒酵母吸附Pb2+的影响,结果见图4。
从图4可以看出,当海水中Pb2+初始浓度从10 mg·L-1增大到100mg·L-1时,吸附率从94.4%下降到62.77%,吸附量从9.19 mg·g-1上升到55.62 mg·g-1。由于吸附剂用量为1.0g·L-1,随着Pb2+初始浓度的增大,吸附量逐渐上升,当酿酒酵母表面的吸附位点被占满后,继续增大海水中Pb2+初始浓度,吸附量变化不大,吸附率下降。

图4 Pb2+初始浓度对酿酒酵母吸附Pb2+的影响Fig.4 Effect of initial concentration of Pb2+on adsorption of Pb2+by Saccharomyces cerevisiae
2.2.2 等温吸附分析
常用的等温吸附模型有Langmuir方程(式3)和Freundlich方程(式4):

式中:q为平衡时吸附量,mg·g-1;qm为最大吸附量,mg·g-1;c为平衡浓度,mg·L-1;KL为Langmuir吸附平衡常数,L·g-1;KF为Freundlich与吸附能力有关的常数,L·g-1;n为与温度有关的常数。
酿酒酵母吸附海水中Pb2+的等温模型拟合结果如图5所示。

图5 Langmuir和Freundlich吸附等温曲线Fig.5 Langmuir and Freundlich adsorption isotherm curves
从图5 可以看出,Langmuir 方程相关系数为0.9905,Freundlich 方程相关系数为0.8734,说明酿酒酵母对海水中Pb2+的吸附能较好拟合Langmuir吸附模型。
在Pb2+初始浓度为10~100mg·L-1、吸附温度为40 ℃、吸附剂用量为1.0g·L-1、pH 值为6时,酿酒酵母最大吸附量qm为60.98 mg·g-1。平衡参数RL=1/(1+KL×c0),RL值直接反映吸附过程的好坏[17],在上述实验条件下,RL值在0~1之间,说明反应有利于Pb2+的吸附,且随着海水中Pb2+初始浓度的增大,RL值逐渐减小。
2.3 吸附动力学研究
2.3.1 吸附时间对酿酒酵母吸附Pb2+的影响
在吸附温度为40 ℃、吸附剂用量为1.0g·L-1、Pb2+初始浓度为50 mg·L-1、pH 值为6 的条件下,分别测定吸附5min、10min、20min、30min、40min、60min、120min、180min、240min时酿酒酵母对海水中Pb2+的吸附量,结果如图6所示。
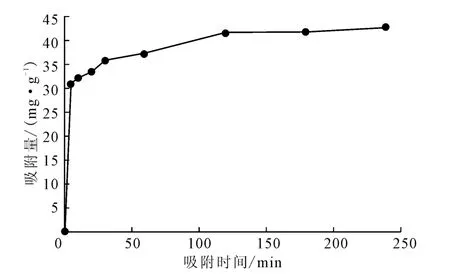
图6 吸附时间对酿酒酵母吸附Pb2+的影响Fig.6 Effect of adsorption time on adsorption of Pb2+by Saccharomyces cerevisiae
从图6可以看出,吸附5min时,吸附量达31.08 mg·g-1,吸附率为66.7%;吸附120min时,吸附趋于平衡,吸附量达41.58mg·g-1。
2.3.2 吸附动力学分析
通常情况下,采用准一级反应动力学模型(式5)和准二级反应动力学模型(式6)来描述生物吸附过程:

式中:qt为t时刻吸附量,mg·g-1;k1为一级速率常数,min-1;k2为二级反应动力学吸附速率常数,g·mg-1·min-1;q为吸附平衡时吸附量,mg·g-1。通常二价金属离子的生物吸附过程可以用准二级反应动力学模型拟合,如图7所示。
由图7可知,准二级反应动力学模型可以较好拟合酿酒酵母对海水中Pb2+的吸附过程,相关系数为0.9991,吸附平衡时的吸附量为43.67mg·g-1,与实验得到的最大吸附量43.23mg·g-1接近。
2.4 原子力显微镜分析
采用原子力显微镜(AFM)在5μm 范围内扫描,观察酿酒酵母吸附Pb2+前后的细胞形态,结果如图8所示。

图7 酿酒酵母吸附Pb2+的准二级反应动力学模型Fig.7 The pseudo-second-order kinetic model for adsorption of Pb2+by Saccharomyces cerevisiae

图8 酿酒酵母吸附Pb2+前(a)后(b)的AFM 照片Fig.8 AFM Images of Saccharomyces cerevisiae before(a)and after(b)adsorption of Pb2+
从图8可以看出,吸附前(图8a)的酵母菌为椭圆形结构,且形态规则整齐;吸附后(图8b)的酵母菌表面粗糙,凹凸不平。说明细胞表面的物质与Pb2+发生了作用,生成沉淀物附着在细胞壁上,引起细胞形态的变化。
3 结论
将酿酒酵母菌制成的生物吸附剂用于重金属污染海水中Pb2+的生物吸附,研究了pH 值、吸附剂用量、吸附温度、Pb2+初始浓度、吸附时间等因素对生物吸附效果的影响。结果表明,酿酒酵母对海水中Pb2+具有较好的吸附效果,最佳吸附条件为:pH 值6、吸附剂用量1.0g·L-1、吸附温度40 ℃、Pb2+初始浓度50 mg·L-1、吸附时间120 min,吸附率达94.57%。吸附过程能较好拟合Langmuir方程,理论最大吸附量为60.98mg·g-1。动力学分析表明,酿酒酵母对海水中Pb2+吸附120min达到平衡,吸附过程可用准二级反应动力学模型拟合,相关系数为0.9991。原子力显微镜照片显示,Pb2+被吸附到酿酒酵母表面,与细胞壁上的物质结合生成沉淀物附着在细胞壁上。
[1]陈灿,王建龙.酿酒酵母吸附重金属离子的研究进展[J].中国生物工程杂志,2006,26(1):69-76.
[2]VOLESKY B.Detoxification of metal-bearing effluents:Biosorption for the next century[J].Hydrometallurgy,2001,59(2-3):203-216.
[3]LU D D,CAO Q L,LI X M,et al.Kinetics and equilibrium of Cu(Ⅱ)adsorption onto chemically modified orange peel cellulose biosorbents[J].Hydrometallurgy,2009,95(1-2):145-152.
[4]秦玉春,关晓辉,王海涛,等.浮游球衣菌对Cu2+的吸附及生物吸附机理初探[J].环境科学学报,2008,28(5):892-896.
[5]曲娟娟,彭泓杨,顾海东,等.一种真菌吸附剂对废水中Pb2+的吸附[J].东北农业大学学报,2014,45(7):31-37.
[6]谢莹,张涛,许崇利,等.耐低温真菌的筛选及对水体铅离子的生物吸附[J].北京联合大学学报(自然科学版),2013,27(3):41-44.
[7]胡晓婧,藏婷婷,顾海东,等.平菇菌糠对废水中铜离子的生物吸附性能[J].环境科学,2014,35(2):669-677.
[8]徐莹,刘文磊,姜凯元,等.耐盐鲁氏酵母(Zygsoaccharomyces rouxii)CICC1379吸附水中重金属Cu2+研究[J].环境科学学报,2010,30(10):1985-1991.
[9]崔大练,邓一兵,马玉心,等.鼠尾藻吸附水体重金属铅离子的研究[J].海洋环境科学,2013,32(6):893-895.
[10]ARECO M M,HANELA S,DURAN J,et al.Biosorption of Cu(Ⅱ),Zn(Ⅱ),Cd(Ⅱ)and Pb(Ⅱ)by dead biomasses of green al-gaUlvalactucaand the development of a sustainable matrix for adsorption implementation[J].Journal of Hazardous Materials,2012,213-214:123-132.
[11]周艾平,尹华,叶锦韶,等.酵母融合菌对Cr的吸附性能及机理分析[J].环境科学与技术,2011,34(6):37-42.
[12]张广金,信欣,毛言,等.一株产絮酵母菌废菌体对Cd2+的吸附特性[J].环境工程学报,2012,6(5):1595-1598.
[13]寇希元,张晓青,张爱君,等.小球藻对海水中Pb2+的生物吸附研究[J].化学工业与工程,2011,28(2):40-44.
[14]WILIAMS C J,ADERHOLD D,EDYVEAN R G J.Comparison between biosorbents for the removal of metal ions from aqueous solutions[J].Water Research,1998,32(1):216-224.
[15]代群威,NOONAN M J,董发勤,等.灭活面包酵母菌对溶液中铅离子的吸附研究[J].安全与环境学报,2008,8(4):49-53.
[16]GOKSUNGUR Y,UREN S,GUVENC U.Biosorption of cadmium and lead ions by ethanol treated waste baker′s yeast biomass[J].Bioresource Technology,2005,96(1):103-109.
[17]GUNAY A,ARSLANKAYA E,TOSUN I.Lead removal from aqueous solution by natural and pretreated clinoptilolite:Adsorption equilibrium and kinetics[J].Journal of Hazardous Materials,2007,146(1-2):362-371.

