盐酸莫西沙星的合成及结构解析
沈小莉,陈家润
(1.广州南沙龙沙有限公司,广东广州511455;2.广东省食品药品监督管理局审评认证中心,广东广州510080)
盐酸莫西沙星(Ⅳ),化学名1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-[(4aS,7aS)-八氢-6H-吡咯并[3,4-b]吡啶-6-基]-4-氧代-3-喹啉羧酸盐酸盐,结构式见图1。

图1 盐酸莫西沙星的结构式Fig.1 Structural formula of moxifloxacin hydrochloride
莫西沙星是第四代新型8-甲氧基氟喹诺酮类抗菌药物,是具有快速性和浓度依赖性的抗生素[1]。目前在我国商品化的有莫西沙星片、胶囊及注射液[2]。莫西沙星不但保留喹诺酮类药物对革兰氏阴性菌的抗菌活性和抗菌谱,而且8-甲氧基团增加了其对革兰氏阳性菌的抗菌活性和抗菌谱,对非典型病原菌如肺炎支原体、衣原体、军团菌非常有效[3-4]。莫西沙星以其抗菌谱广、抗菌能力强、体内分布广、体内药物浓度高、半衰期长、疗效好、副作用小、与其它抗菌药物无交叉耐药性、几乎无光敏反应等优点在临床得到广泛应用[5],主要用于治疗成人呼吸道感染,同时也可作为糖尿病患者、老年患者以及肾损伤患者的选择性药物[6]。其在呼吸道组织和分泌物中的浓度都明显超过其在血液中的浓度[7]。
盐酸莫西沙星的合成方法已有不少文献报道,但因操作较复杂[8-9]、需要手性拆分[10]及使用高沸点溶剂DMSO 或DMF等[10],而限制了其工业化生产。近年来,直接以喹啉羧酸酯为原料与莫西沙星侧链(Ⅲ)缩合得到莫西沙星的方法,因路线简单、便于工业化生产而受到研究者的青睐[11-13]。
作者在深入研究和细致比较文献报道的工艺路线的基础上,沿用以喹啉羧酸为原料的方案合成莫西沙星:先将喹啉羧酸乙酯(Ⅰ)与硼酸酯螯合得到中间体Ⅱ,以活化7位的氟原子,再与Ⅲ缩合,制得目标产物盐酸莫西沙星(Ⅳ),并对其结构进行解析。合成路线如图2所示。

图2 盐酸莫西沙星的合成路线Fig.2 Synthetic route of moxifloxacin hydrochloride
1 实验
1.1 盐酸莫西沙星的合成
1.1.1 母核硼酸化物(Ⅱ)的合成
于反应瓶中加入醋酐(150g,1.47mol),70 ℃搅拌下,缓慢加入硼酸(30.0g,0.485mol),控制反应温度不超过90 ℃,加毕,保持温度继续搅拌2h,然后加入莫西沙星母核喹啉羧酸乙酯(Ⅰ)(100g,0.309 mol),升温至90 ℃反应3h,冷却至室温后将反应液加至冰水中,搅拌,抽滤,滤饼用大量水洗涤,自然干燥,得淡黄色固体母核硼酸化物(Ⅱ)124g,收率94.5%。
1.1.2 盐酸莫西沙星(Ⅳ)的合成
于反应瓶中加入母核硼酸化物(Ⅱ)(124g,0.293 mol)、莫西沙星侧链(Ⅲ)(37g,0.293 mol)、三乙胺(35.6g,0.352mol)、乙腈(600mL),回流反应1.5h,冷却至室温,滴加浓盐酸调pH 值至1,0~5 ℃下搅拌1h,抽滤,滤饼用少量乙腈洗涤,自然干燥,得盐酸莫西沙星粗品98g,收率96.4%。
1.1.3 盐酸莫西沙星的精制
将盐酸莫西沙星粗品98g 加入反应瓶中,加1 000mL70%的乙醇,加热回流并搅拌,待粗品完全溶解后,抽滤,滤液在0℃左右静置析晶过夜,抽滤,滤饼用乙醇洗1次,在60℃下干燥12h,得产品96g,收率98.0%。用HPLC峰面积归一化法测定盐酸莫西沙星的纯度为99.96%。
1.2 盐酸莫西沙星的结构解析
高分辨质谱(HRMS)和二级高分辨质谱用Agilent 1100系列SL离子阱质谱仪测定,ESI电离条件;紫外光谱(UV)用日本岛津UV2201型紫外光谱仪测定;红外光谱(IR)用Bruker IFS-55型红外光谱仪(依据中国药典2010版二部附录ⅣC 校正)测定,KBr压片法;1HNMR、13CNMR、DEPT、H-H COSY、NOESY 和HSQC 谱用AV-600型核磁共振仪测定;X-射线粉末衍射图谱(XRD)用日本理学(Rigaku)D/max 2500PC型X-射线衍射仪测定。
2 结果与讨论
2.1 高分辨质谱(HRMS)
在ESI 电离方式、阳离子监测和电喷雾电压550.0Vpp的条件下,准分子离子峰m/z402.1822为莫西沙星的[M+H]+峰,由m/z402.1822拟合所得的元素组成为C21H25FN3O4,与莫西沙星的分子式C21H24FN3O4加1个H 相符。
2.2 紫外光谱(UV)
分别以蒸馏水、0.1 mol·L-1盐酸和0.1 mol·L-1氢氧化钠溶液为溶剂,精确称量样品,配成5.0μg·mL-1的溶液,进行紫外检测,扫描波长为200~400 nm,结果见表1。

表1 盐酸莫西沙星的紫外光谱数据Tab.1 UV Data of moxifloxacin hydrochloride
由表1可知,在盐酸莫西沙星的紫外光谱中,294 nm 处的最大吸收为苯环的E2吸收带,由于苯环与羰基生色团相连,又与烷氧基、胺基等助色团相连,所以吸收波长增大、吸收强度增强。
2.3 红外光谱(IR)
盐酸莫西沙星的红外光谱数据如下:3 427.3 cm-1处为羧基的O-H 伸缩振动峰;3 469.7cm-1处为仲胺结构中的NH 伸缩振动峰;2 925.2cm-1处为亚甲基的C-H 伸缩振动峰;1 707.7cm-1处为3位羧基的C=O 伸缩振动峰;1 622.9cm-1处为喹啉酮母核4位羰基的C=O 伸缩振动峰,由于与3位羧基上的氢原子形成氢键,故吸收峰向低波数方向移动;1 514.6cm-1和1 454.8cm-1处为苯环的骨架振动吸收峰。表明,分子中含有羧基、NH、亚甲基、苯环、羰基等结构片段,与盐酸莫西沙星分子结构相符。
2.4 核磁共振谱
2.4.1 核磁共振氢谱(1HNMR)
盐酸莫西沙星的1HNMR 谱图中,δ15.15为羧基上的氢吸收峰;δ9.72 和δ8.81处的吸收峰均为宽单峰,分别为NH 和盐酸的氢吸收峰;δ8.67和δ7.69处分别是芳香环上4位和9位氢原子的吸收峰,4位氢原子由于同时受到羧基和羰基影响,化学位移在较低场,9位氢原子受邻位氟原子的影响,裂分为二重峰,偶合常数为14.2Hz;δ4.14为环丙烷结构片断中的3位氢原子的吸收峰,受氮原子诱导效应的影响,化学位移增大;δ1.19、δ1.11、δ1.02 和δ0.86 处的4 组吸收峰均为多重峰,对应环丙烷结构片断中1位和2位上的2个亚甲基;δ3.86和δ2.65处的吸收峰分别为19位和15位的稠合边氢信号,19位氢原子受邻位氮原子诱导效应的影响,化学位移在较低场;δ4.07 和δ3.57处的吸收峰对应20 位亚甲基;δ3.89 和δ3.75处的吸收峰对应14位的亚甲基;δ3.19和δ2.92处的吸收峰对应18 位亚甲基;δ1.76 处的多重峰,积分面积为4,为16位和17位上2个亚甲基的重合峰;δ3.59处的单峰,积分面积为3,对应21位的甲氧基。样品的1HNMR 数据与盐酸莫西沙星的结构相符。
2.4.2 核磁共振碳谱(13CNMR)
在盐酸莫西沙星的13CNMR 谱图中共有21组吸收峰(其中10 位碳原子受氟原子的偶合,裂分为δ153.7和δ152.1的双峰,偶合常数为248.6 Hz),对应21个碳原子。在低场区,δ176.5、δ166.3分别为6位和7位的羰基碳原子信号;δ140.8、δ137.1、δ135.0、δ117.7、δ106.9为5 个季碳信号,分别归属为12 位、11位、13位、8位和5位;δ150.9和δ107.1为2个叔碳信号,分别归属为4 位和9 位碳原子。在高场区,δ62.3 为21 位甲氧基碳的吸收峰;δ55.0、δ54.6、δ52.2、δ42.0、δ41.1 为5 个与氮原子相连的碳信号,分别归属为20位、19位、14位、18位和3位;最高场的5 个吸收峰δ34.6、δ20.9、δ18.0、δ10.1、δ8.8 则分别归属为15 位、16 位、17 位、1 位和2 位。样品的13CNMR数据与盐酸莫西沙星的结构相符。
2.4.3 DEPT 谱
盐酸莫西沙星的DEPT(135°)谱中有13 组吸收峰,其中7组负吸收峰对应7个仲碳,6组正吸收峰对应1个伯碳和5个叔碳,另外有8组13CNMR 谱中的吸收峰在DEPT 谱中消失,对应8 个季碳。样品的DEPT 谱信息与盐酸莫西沙星的结构相符。
2.4.4 H-H COSY 谱(图3)
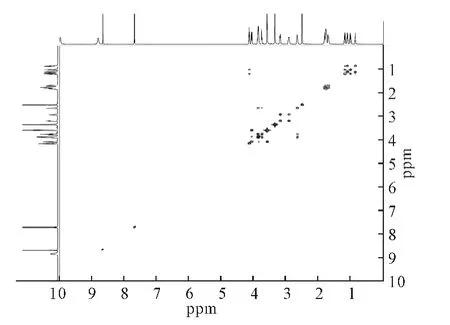
图3 盐酸莫西沙星的H-H COSY谱Fig.3 H-H COSY Spectrum of moxifloxacin hydrochloride
在H-H COSY 谱图中,H-3分别与H-1、H-2耦合,对应环丙烷结构;H-19和H-20耦合,H-14和H-15耦合,H-18分别与H-16、H-17耦合,H-15分别与H-16、H-17耦合,对应11位侧链结构。
2.4.5 NOESY 谱(图4)

图4 盐酸莫西沙星的NOESY谱Fig.4 NOESY Spectrum of moxifloxacin hydrochloride
在NOESY 谱图中,δ2.65与δ3.86之间有NOE效应,说明8 位氢原子和13 位氢原子的空间距离较近,应位于环的同一侧,为顺式异构体,这与盐酸莫西沙星的空间结构相符。
2.4.6 HSQC谱(图5)
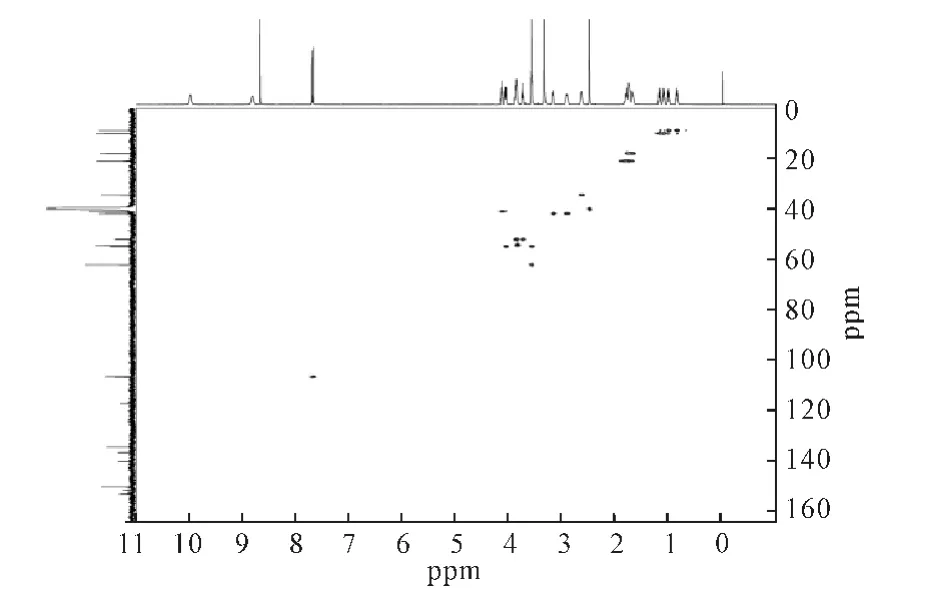
图5 盐酸莫西沙星的HSQC谱Fig.5 HSQC Spectrum of moxifloxacin hydrochloride
在HSQC谱图中,1、2位亚甲基和3位次甲基对应环丙烷结构,4、9位次甲基和21位甲基对应喹啉酮母核,14、16、17、18、20位上的亚甲基对应吡咯并[3,4-b]吡啶侧链。
盐酸莫西沙星的1HNMR、13CNMR、DEPT、HSQC、H-H COSY 具体数据如表2所示。
2.5 二级高分辨质谱
莫西沙星的电离路径如图6所示。
在ESI电离方式、阳离子监测、电喷雾电压800.0 Vpp的条件下测定盐酸莫西沙星的二级高分辨质谱,结果见图7。
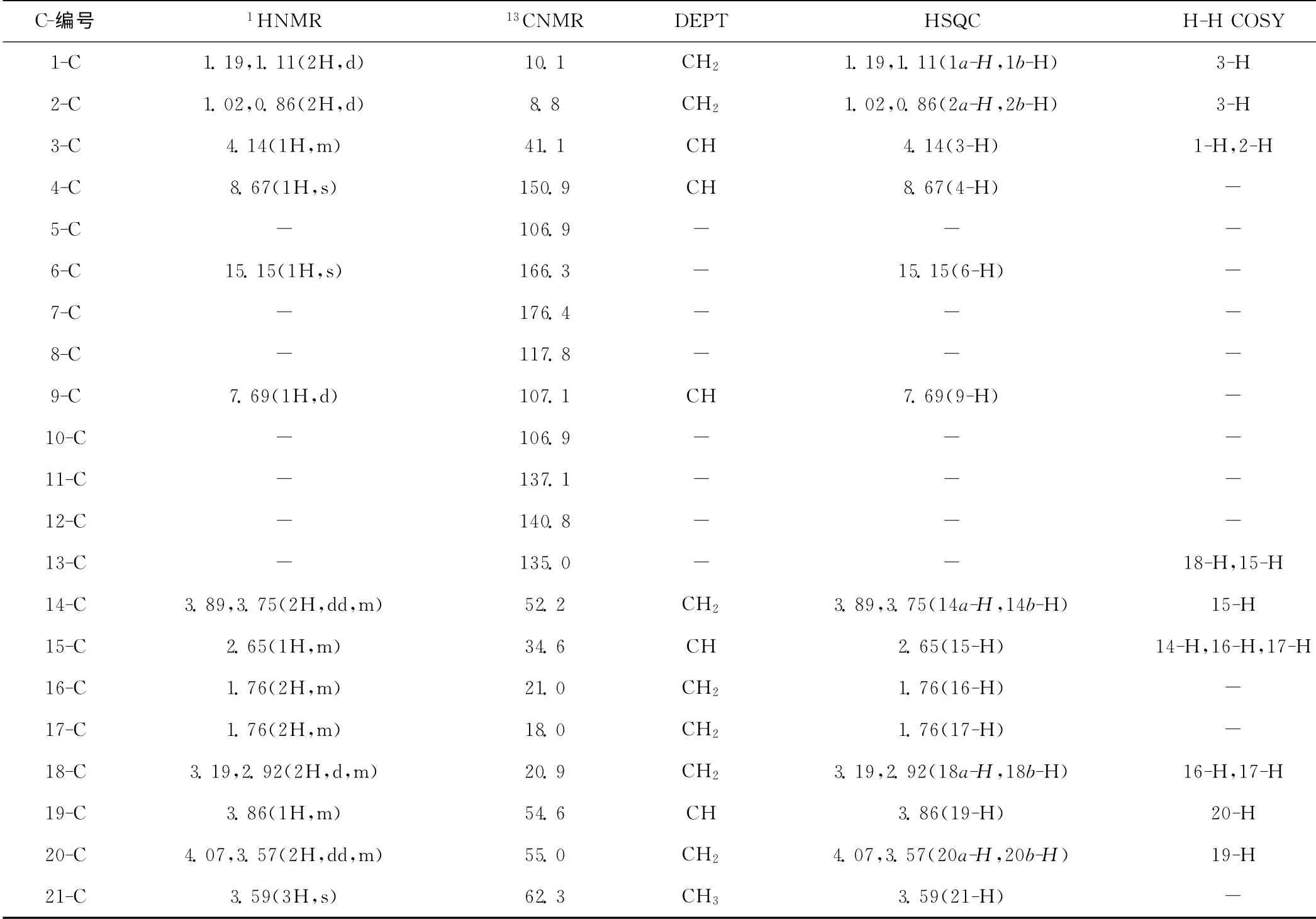
表2 盐酸莫西沙星的1 HNMR、13CNMR、DEPT、HSQC、H-H COSY数据Tab.2 1 HNMR,13CNMR,DEPT,HSQC and H-H COSY data of moxifloxacin hydrochloride

图6 莫西沙星的电离路径Fig.6 Ionization pathways of moxifloxacin
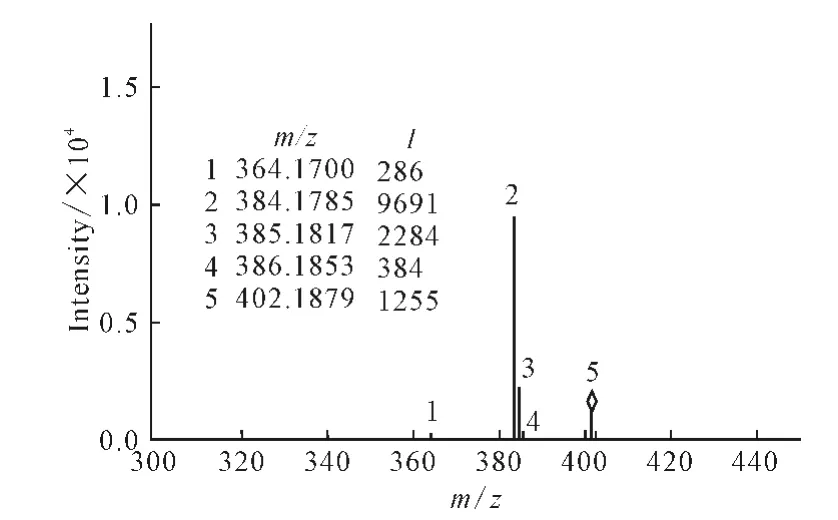
图7 盐酸莫西沙星的二级高分辨质谱Fig.7 Two-stage HRMS spectrum of moxifloxacin hydrochloride
2.6 X-射线粉末衍射(XRD)
测试条件:Cuκa辐射,管电压50kV,管电流300 mA,石墨单色器衍射束单色化。XRD 数据见表3。
3 结论
以莫西沙星母核为起始原料,经硼酸酯活化、烃化、酸解三步反应合成盐酸莫西沙星。HRMS分析得到化合物的分子式C21H24FN3O4,与质谱数据相吻合,IR 谱、1HNMR 谱和13CNMR 谱表明化合物中存在羧基结构片段、环丙烷结构和7号侧链结构;UV 谱、IR谱、1HNMR 谱、13CNMR谱及HRMS谱表明化合物中存在喹啉酮母核结构;NOESY 谱说明化合物为顺式异构体。最终确证化合物结构为1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-[(4aS,7aS)-八氢-6H-吡咯并[3,4-b]吡啶-6-基]-4-氧代-3-喹啉羧酸盐酸盐(盐酸莫西沙星)。该方法路线较短、操作简单,对盐酸莫西沙星的质量控制具有重要的参考价值。

表3 盐酸莫西沙星的XRD数据Tab.3 XRD Data of moxifloxacin hydrochloride
[1]张家军,韩绍杰,刘道轩,等.莫西沙星的临床药理学介绍[J].中国实用内科杂志,2002,22(11):697-700.
[2]黄道秋,李家莉.莫西沙星的临床应用[J].中国医院药学杂志,2007,27(3):372-373.
[3]刘明亮,郭惠元.喹诺酮的演变[J].国外医药:抗生素分册,2006,27(2):69-75.
[4]王辉.莫西沙星对呼吸道病原体的体外抗菌活性[J].中国新药杂志,2002,11(10):801-804.
[5]孟静娟.新抗生素莫西沙星国内外研究应用最新进展[J].微生物学杂志,2007,27(5):98-101.
[6]万志龙,刘明亮,郭惠元.莫西沙星的安全性评价[J].国外医药:抗生素分册,2006,27(3):105-109.
[7]BREILH D,JOUGON J,DJABAROUTI S,et al.Diffusion of oral and intravenous 400mg once-daily moxifloxacin into lung tissue at pharmacokinetic steady-state[J].Journal of Chemotherapy,2003,15(6):558-562.
[8]王福东,李谦和,彭东明.莫西沙星合成方法[J].药学进展,2003,27(4):217-220.
[9]UWE P,ANDREAS K,THOMAS S,et al.Quinolone and naphthyridone carboxylic acid derivatives as antibacterial agents:EP,0550903[P].1993-07-14.
[10]BERND K.Process for the preparation of moxifloxacin hydrochloride:EP,1992626[P].2008-11-19.
[11]卢定强,王维胞,凌岫泉,等.新一代喹諾酮类盐酸莫西沙星的合成及应用研究进展[J].现代化工,2014,34(2):33-37.
[12]王庆娟,王秀娟,郭彦玲.盐酸莫西沙星的合成研究[J].齐鲁药事,2011,30(12):683-684.
[13]晁阳,包玉胜,叶海,等.盐酸莫西沙星的合成工艺改进[J].海峡药学,2013,25(10):16-18.

