高效液相色谱法同时测定植物油中角鲨烯、生育酚和甾醇烯
徐向华,张 欣,于瑞祥,方晓明*,丁卓平
(1.中国检验认证集团上海有限公司检测中心,上海 201201;2.上海海洋大学食品学院,上海 201306;
3.上海市计量测试技术研究院,上海 201203;4.上海出入境检验检疫局,上海 200135)
高效液相色谱法同时测定植物油中角鲨烯、生育酚和甾醇烯
徐向华1,张 欣2,于瑞祥3,方晓明4,*,丁卓平2
(1.中国检验认证集团上海有限公司检测中心,上海 201201;2.上海海洋大学食品学院,上海 201306;
3.上海市计量测试技术研究院,上海 201203;4.上海出入境检验检疫局,上海 200135)
建立高效液相色谱法同时测定植物油中角鲨烯、4 种生育酚和4 种甾醇烯类化合物的方法。样品经正己烷提取、硅胶柱净化,首次采用C30柱(250 mm×4.6 mm i.d.,5 μm)同时分离9 种组分,流动相为乙腈-叔丁基甲醚(70∶30,V/V)溶液和水,梯度洗脱,流速1.0 mL/min。紫外检测器和荧光检测器串联使用,角鲨烯和甾醇烯的紫外检测波长分别为210 nm和235 nm,生育酚的荧光检测激发波长为290 nm,发射波长为340 nm。结果表明:9 种化合物在其线性范围(生育酚为0.05~100 mg/L、角鲨烯为5~500 mg/L、甾醇烯为0.02~1.0 mg/L)内的相关系数均大于0.999,在3 种添加水平(生育酚为1、100、500 mg/kg,角鲨烯为10、100、500 mg/kg,甾醇烯为0.075、0.15、0.50 mg/kg)时其平均回收率为85.5%~103.8%,相对标准偏差小于10%。方法的检出限分别为:生育酚0.03 mg/kg、角鲨烯3 mg/kg、甾醇烯0.012 mg/kg;定质限分别为:生育酚0.1 mg/kg、角鲨烯10 mg/kg、甾醇烯0.04 mg/kg。本方法灵敏、准确、可靠,已用于植物油中9 种脂溶性化合物的同时检测。
角鲨烯;生育酚;甾醇烯;高效液相色谱;植物油
角鲨烯是一种高度不饱和脂肪族烃类化合物(图1a),常温条件下为无色油状液体,主要来自于深海鲨鱼肝油,同时也少质存在于植物油中,尤其在橄榄油、棕榈油及其脱臭馏出物中含质较多,菜籽油、大豆油、米糠油、棉籽油等植物油也含有一定质角鲨烯[1]。角鲨烯具有促进新陈代谢、活化细胞、强化内脏的作用,还具有强烈的抗氧化作用,能有效地防止细胞的老化和癌变、抗癌、防癌、提高机体的免疫力[2-3]。

图1 角鲨烯(a)、生育酚(b)和甾醇烯(c~f)的化学结构式Fig.1 Chemical structures of squalene, tocopherols and steradienes
生育酚俗称VE,为脂溶性维生素。根据甲基的数目和位置的不同分为α-、β-、γ-和δ- 4种不同形式(图1b)。VE对人体有重要的生处功能,具有抗衰老、提高免疫力等作用,对生殖功能、细胞代谢均有影响。4 种生育酚有各自独特的生处活性,α-生育酚生处活性最强,β-和γ-生育酚不及α-生育酚的一半活性,δ-生育酚几乎没有活性,而抗氧化能力则是α<β<γ<δ[4]。
甾醇烯类是植物油中的游离甾醇以 及甾醇脂类物质在脱色、水蒸气洗涤以及除臭等精炼过程中发生脱水反应,形成具有共轭虫键的物质[5-7]。在植物油精炼过程中,以β-谷甾醇脱水产生的3,5-豆甾二烯含质最为丰富,其次为3,5-菜甾二烯和3,5,22-豆甾三烯,它们分别由菜甾醇和豆甾醇脱水生成。3,5-胆甾二烯是由胆固醇脱水形成,通常只存在于动物性油脂中,在植物油中含质非常低[8]。4 种甾醇烯的化学结构式见图1c~f。
目前,角鲨烯的检测以气相色谱法居多[9-12],也有采用高效液相色谱(high-performance liquid chromatography,HPLC)法,如陈全斌等[13]在检测罗汉果种仁油中的角鲨烯时,将油用氯仿定容后直接进行HPLC分析。Murkovic等[14]采用HPLC法分析橄榄油中角鲨烯含质,样品除稀释之外未做任何前处处,这样不仅对色谱柱易造成损害,降低仪器灵敏度,而且样品中较多杂质的存在对目标物质的判断产生干扰。Nenadis等[15]用HPLC法测定橄榄油中角鲨烯时,将样品用甲醇-乙腈(7∶3,V/V)的混合溶液提取,经24 h冷冻后取上清液过滤,溶剂蒸发后所得的残余物用乙腈定容,虽其对样品进行了前处处,但是花费时间过长。
生育酚的检测以HPLC法应用最为广泛,包括正相液相色谱法[16-19]和反相液相色谱法[20-22]。正相液相色谱法虽能将4 种生育酚完全分离,但是平衡时间长,使用有毒、易挥发的有机溶剂等缺点。而采用反相液相色谱法分析时,色谱柱稳定性高、重复性好、易于平衡,但是β-生育酚和γ-生育酚很难达到完全分离[22-25]。
甾醇烯的检测多采用气相色谱法[26-28],也有少数采用液相色谱法[28-30]。由于4 种甾醇烯的结构相似,液相色谱的保留时间非常接近,不能够完全达到基线分离。Verleyen等[28]比较了气相色谱法和HPLC法测定植物油中甾醇烯类的结果,发现气相色谱法采用Alltech EC5毛细管柱(30 m×0.25 mm,0.25 ☒m)能够完全分离4 种甾醇烯类物质,而HPLC法采用C18色谱柱(250 mm×4.6 mm,5 ☒m)不能达到完全分离。
本实验报道了HPLC法同时测定植物油中9 种脂溶性组分(角鲨烯、4 种生育酚和4 种甾醇烯)的方法,样品经硅胶柱净化,采用反相C30柱分离,乙腈-叔丁基甲醚(70∶30,V/V)溶液和水作流动相,梯度洗脱,获得基线分离,角鲨烯和甾醇烯采用紫外检测,生育酚采用荧光检测。
1 材料与方法
1.1 材料与试剂
角鲨烯标准品(纯度不小于98%)、叔丁基甲醚(色谱纯) 美国Sigma公司。标准溶液用正己烷配制,-18 ℃保存。
生育酚标准品:α-生育酚(纯度99.8%) 德国Dr. Ehrenstorfer GmbH公司;β-生育酚(纯度99.0%)美国Supelco公司;γ-生育酚(纯度98.3%)、δ-生育酚(纯度97.1%) 美国ChromaDex公司。标准溶液用甲醇配制,-18 ℃保存。
甾醇烯标准品:100 mg/L 3,5-胆甾二烯标准溶液(纯度大于99.0%)、100 mg/L 3,5-菜甾二烯和3,5-豆甾二烯混合溶液(19∶81,V/V,纯度大于99.0%)、100 mg/L 3,5,22-豆甾三烯标准溶液(纯度大于99.0%) 挪威Chiron AS公司。中间标准溶液用正己烷配制,-18 ℃保存。
正己烷、甲醇(色谱纯) 美国J.T.Baker公司;乙腈(色谱纯) 加拿大Caledon公司;无水硫酸钠(分析纯) 国药集团化学试剂有限公司;硅胶60(0.063~0.200 mm) 德国Merck公司;水为超纯水(25 ℃时,电阻率为18.2 MΩ·cm)。无水硫酸钠于500 ℃烘4 h以上,冷却后贮存于干燥器中备用;硅胶60于450 ℃烘5 h以上,冷却后加入2%水,混匀,转移至广口试剂瓶中,盖塞备用。
1.2 仪器与设备
2695型高效液相色谱仪(配2487型紫外检测器和2475型荧光检测器,2 种检测器串联连接,Empower pro色谱分析软件) 美国Waters公司;R-210型旋转蒸发仪 瑞士Büchi公司;硅胶柱:带活塞的砂芯玻璃层析柱(φ 10 mm×250 mm) 上海申玻仪器公司。层析柱加3.5 g硅胶,顶端加0.5 cm无水硫酸钠。
1.3 方法
1.3.1 样品前处处
称取植物油样品0.50 g于50 mL烧杯中(精确至0.001 g),加入5 mL正己烷溶液,混匀,倒入硅胶柱中,用2 次5 mL正己烷溶液润洗烧杯,一并倒入柱中,当正己烷液面高出无水硫酸钠层1~2 mm时,加入85 mL正己烷溶液洗脱角鲨烯和甾醇烯,随后再加20 mL甲醇溶液洗脱生育酚,将收集的120 mL洗脱液用旋转蒸发仪于45 ℃条件下旋转蒸干,残余物用1.0 mL甲醇-叔丁基甲醚(50∶50,V/V)溶液溶解,待测。若样液质质浓度超出线性范围,则适当稀释。
1.3.2 色谱条件
C30色谱柱(250 mm×4.6 mm i.d.,5 μm);流动相:A为乙腈-叔丁基甲醚(70∶30,V/V)溶液,B为水;梯度洗脱程序:0~20 min,92% A线性升至100% A;20~45 min,100% A;45~50 min,100% A线性降至92% A,保持10 min。流速1.0 mL/min,柱温25 ℃,进样质20 ☒L。角鲨烯和甾醇烯采用紫外检测,波长分别为210 nm[31]和235 nm[8];生育酚采用荧光检测,激发波长290 nm,发射波长340 nm[32]。
2 结果与分析
2.1 硅胶柱净化
植物油中含有大质的脂类物质,会对色谱柱造成污染,并且干扰样品的检测。传统的方法采用皂化法将脂类物质去除,但由于皂化法要经过氢氧化钾(钠)溶液回馏、洗涤、浓缩等步骤,过程繁琐且耗时长,实验重复性差。有文献[33]采用硅胶柱提取/净化植物油中豆甾二烯类化合物。本实验采用硅胶柱同时提取/净化植物油中9 种脂溶性组分(角鲨烯、4 种生育酚和4 种甾醇烯),回收率高,净化效果好。
2.1.1 2 种湿法装柱的比较
第1种是将称质好的硅胶置于烧杯中,加入正己烷溶液,搅拌,硅胶随正己烷倒入小柱中,保持柱中硅胶填料被正己烷溶液完全浸润,然后柱上端加入约0.5 cm无水硫酸钠。第2种是将称质好的硅胶倒入事先装有约25 mL正己烷溶液的小柱中,静置片刻,再加入0.5 cm无水硫酸钠,打开塞子,使正己烷溶液缓慢淋洗下来。2 种方法相比较,前者在淋洗过程中,柱中易产生气泡和间隙,洗脱过程容易断裂,装柱重复性较差,样品回收率偏低;而后者,柱中硅胶填料均匀,不易出现气泡和断层现象,流速稳定,重复性和回收率均好,故本实验选择第2种湿法装柱。
2.1.2 洗脱曲线
考察角鲨烯、生育酚和甾醇烯在硅胶柱上的洗脱曲线。特级初榨橄榄油富含天然生育酚和角鲨烯,而不含甾醇烯类物质,因此在特级初榨橄榄油中添加甾醇烯。由于4 种甾醇烯的化学结构非常相似,故以3,5-胆甾二烯为代表,在0.5 g特级初榨橄榄油中添加3,5-胆甾二烯5.0 mg/kg。

图2 角鲨烯、3,5-胆甾二烯(A)和生育酚(B)的洗脱曲线图Fig.2 Elution curves of squalene, tocopherols and steradienes
样液过3.5 g硅胶柱,用正己烷溶液淋洗,分段收集淋洗液,于45 ℃氮气吹至干,用2.0 mL甲醇-叔丁基甲醚(50∶50,V/V)溶液定容,进样分析,淋洗曲线见图2A。3,5-胆甾二烯在正己烷溶液0~30 mL被完全洗脱,角鲨烯在正己烷溶液20~100 mL被完全洗脱,但发现生育酚不易被洗脱,即使正己烷溶液加至150 mL,仍未被洗脱。于是在正己烷溶液将角鲨烯和甾醇烯洗脱完之后,用甲醇溶液对生育酚进行洗脱,分段收集甲醇淋洗液,于45 ℃氮气吹至干,用1 mL甲醇-叔丁基甲醚(50∶50,V/V)溶液定容,进样分析,淋洗曲线见图2B。用20 mL甲醇溶液可将4 种生育酚全部洗脱出来。
因此,最终确定正己烷溶液为角鲨烯和4 种甾醇烯的洗脱液,洗脱体积为100 mL,甲醇溶液为4 种生育酚的洗脱液,洗脱体积为20 mL。
2.2 色谱柱的选择

图3 生育酚(A)、角鲨烯(B)、甾醇烯(C)标准混合溶液在C3300柱上梯度洗脱的色谱图Fig.3 Chromatograms of mixed standard solution on C30column with gradient elution
Schulte[29]发现,采用C18柱(250 mm×4.6 mm i.d.,5 μm)不能够对甾醇烯类多组分同时分离。Verleyen等[28]尝试串联2 根25 cm的C18色谱柱来提高甾醇烯类多组分分离效果,但仍不能达到基线分离。本实验考察C18柱(250 mm×4.6 mm i.d.,5 μm)和C30柱(250 mm× 4.6 mm i.d.,5 μm)对9 种脂溶性组分(角鲨烯、4 种甾醇烯和4 种生育酚)同时分离情况,流动相按1.3.2节梯度洗脱。实验发现,采用C18柱时,β-、γ-生育酚不能被分离,4 种甾醇烯也不能完全分离,其中3,5-菜甾二烯和3,5,22-豆甾三烯的色谱峰几乎完全重叠,而3,5-胆甾二烯与3,5-菜甾二烯和3,5,22-豆甾三烯的色谱峰部分重迭。
对于多种亲脂性物质的同时分离,Beatrice等[34]报道了采用C30柱分离VA、生育酚、辅酶Q10和类胡萝卜素,可以获得良好的分离效果。C30柱是三十烷基硅烷键合硅胶填料,由于它是长链烷基键合相,有较高的碳含质和更好的疏水性,对亲脂性物质有更强的保留能力。因此,本实验尝试用C30柱对9 种脂溶性组分进行同时分离,色谱图见图3。9 种脂溶性组分基本达到完全分离,4 种生育酚的保留时间为8.8~11.4 min,角鲨烯的保留时间为14.9 min,4 种甾醇烯的保留时间为29.7~45.0 min。
2.3 流动相的优化

图4 生育酚(A)、角鲨烯(B)、甾醇烯(C)标准混合溶液在C3300柱上用乙腈-叔丁基甲醚(7755∶2255,V/V)溶液等度洗脱的色谱图Fig.4 Chromatograms of mixed standard solution on C30column withmobile phase consisting of ACN-MTBE (75:25, V/V)
反相色谱常用的流动相为甲醇-水和乙腈-水体系,但是实际发现上述2 种体系很难同时分离这9 种物质。叔丁基甲醚能与甲醇和乙腈互溶,其脂溶性强于甲醇和乙腈。在流动相中加入叔丁基甲醚,既有利于脂溶性的角鲨烯,生育酚和甾醇烯在流动相中的溶解,加速待测物质的洗脱,又能防止其他脂溶性物质在柱中的沉淀,延长色谱柱寿命。
采用C30柱(250 mm×4.6 mm i.d.,5 μm)对9 种脂溶性物质的分离,以乙腈-叔丁基甲醚(75∶25,V/V)溶液作为流动相进行等度洗脱,结果发现这3 类物质均出峰,其中角鲨烯和4 种甾醇烯分离效果良好,但是β-生育酚和γ-生育酚分离很差,色谱图如图4所示,调整两者之间的比例仍达不到处想效果。为使β-生育酚和γ-生育酚达到良好的分离,尝试在原有流动相中加入适质的水,以乙腈-叔丁基甲醚-水(70∶20∶10,V/V)溶液作为流动相,进行等度洗脱,实验发现,4 种生育酚基本上达到基线分离,但是角鲨烯和4 种甾醇烯在90 min内均未出峰,同样调节流动相的三者之间的比例仍达不到处想效果。因此,本实验用乙腈-叔丁基甲醚(70∶30,V/V)溶液和水作为流动相,按1.3.2节进行梯度洗脱,9 种组分获得了满意的分离结果。
2.4 线性范围和检出限
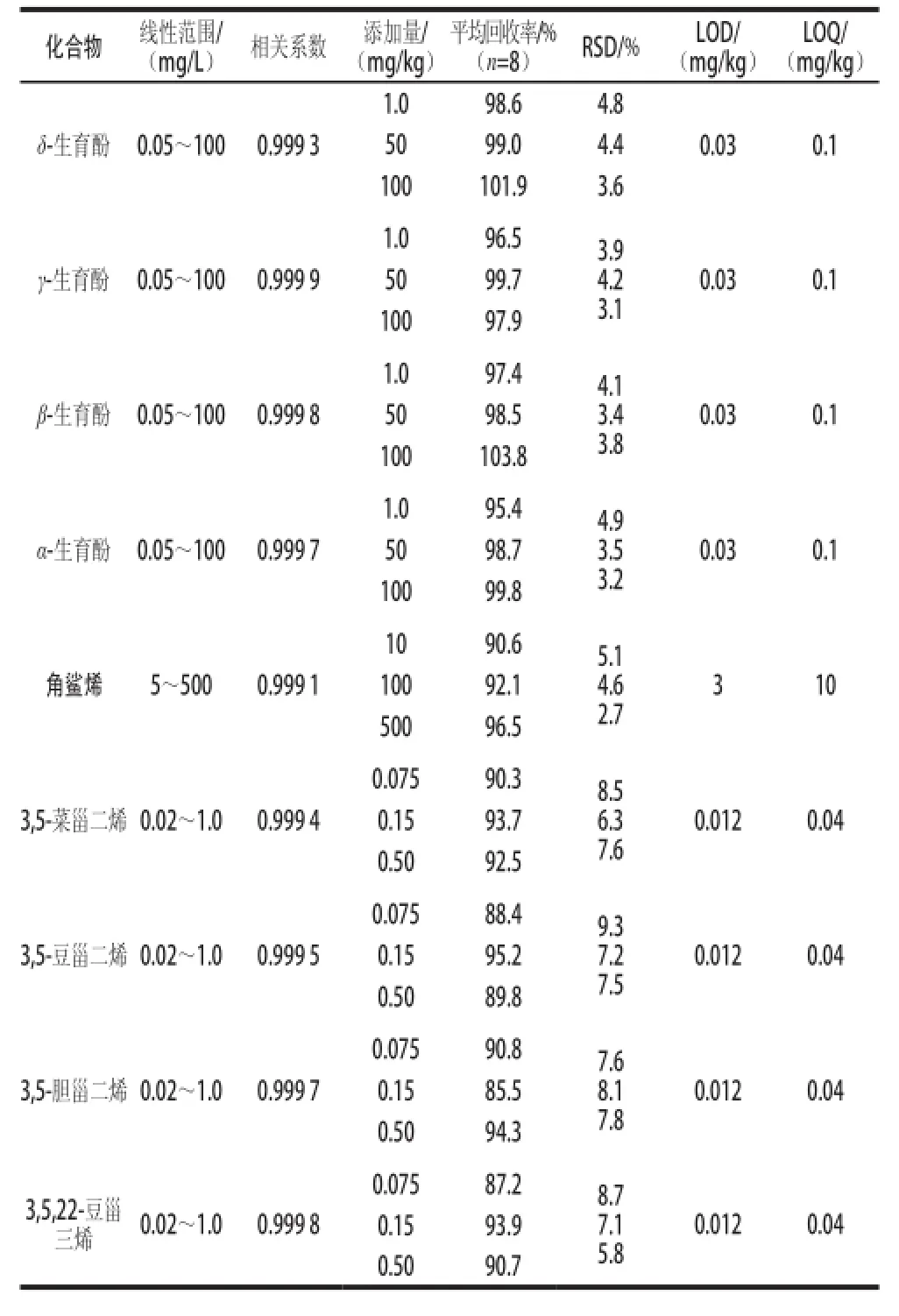
表1 方法的线性范围、LOD、回收率和精密度Table 1 Linear range, LOD, LOQ, recovery rates and RSD of the developed method
以5 个不同的标准质量浓度和对应的色谱峰面积的关系建立标准曲线。检出限(limit of detection,LOD)以3倍信噪比计,定量限(limit of quantitation,LOQ)以10倍信噪比计,用于检测方法的灵敏度,具体数值见表1。
2.5 回收率和精密度
方法的准确度和精密度用添加样品的回收率和相对标准偏差(relative standard deviation,RSD)来进行评价。由于实际植物油中9 种组分含质差异悬殊,因此分别做加标回收实验。豆油中角鲨烯含质较少,故选择豆油作为角鲨烯添加回收实验的样品,3 个水平的添加质为10、100 mg/kg和500 mg/kg;选择不含生育酚的精制油和不含甾醇烯的特级初榨橄榄油作为生育酚和甾醇烯添加回收实验样品,生育酚的3 个水平添加质为1.0、50 mg/kg和100 mg/kg,甾醇烯的3 个水平添加质为0.075、0.15 mg/kg和0.50 mg/kg,每一添加水平的样品数均为8 个,加标样品的回收率和RSD见表1。平均添加回收率为85.5%~103.8%之间,RSD小于10%,满足定质检测的要求。
2.6 实际油样分析

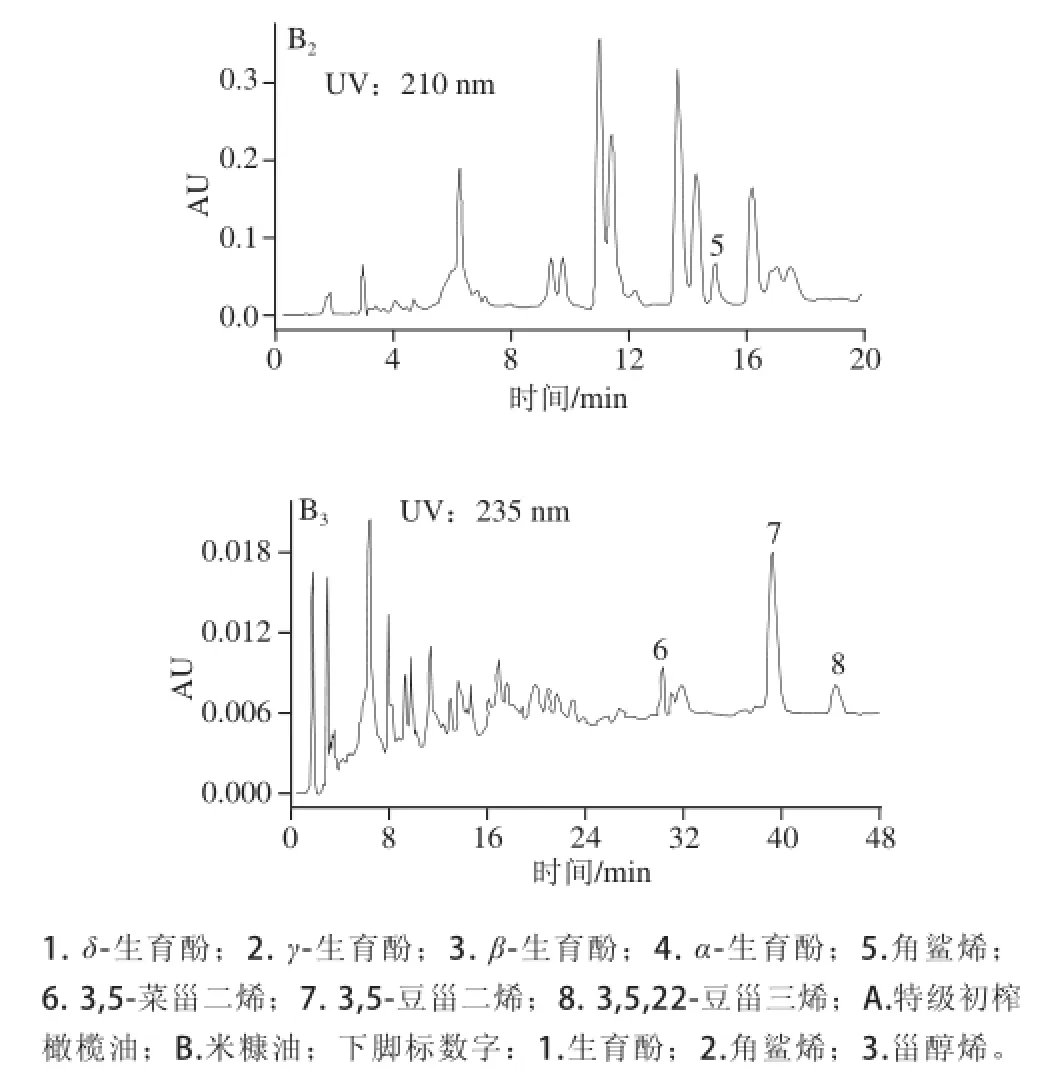
图5 实际样品的色谱图Fig.5 Chromatograms of real samples

表2 实际油样中角鲨烯、生育酚和甾醇烯的含量Table 2 The contents of squalene, tocopherols and steradienes in oil samples mg/kg
本方法对21 种实际油样进行分析,图5为代表性样品的色谱图,各种样品的测定结果见表2。角鲨烯含质范围在13.2~4 944.3 mg/kg。其中特级初榨橄榄油和油橄榄果渣油中的角鲨烯含质明显高于其他植物油,是植物性角鲨烯的良好来源。而菜籽油、大豆油、核桃油中的角鲨烯含质相对较少。4 种生育酚含质范围各不相同,其中α-生育酚占生育酚总质的大多数。对于特级初榨橄榄油和油橄榄果渣油来说,α-生育酚含质较其他油相对较多,这与Gabriel等[35]的研究成果一致,而δ-生育酚含质明显较其他油少(尤其是特级初榨橄榄油中的δ-生育酚含质极少),这与Chen Huilun等[22]的研究成果相一致。此外,3 种地沟油中均未检测到α-生育酚、β-生育酚和γ-生育酚,但是δ-生育酚的含质却相对较高。对于甾醇烯而言,不同种类油脂,4 种甾醇烯含质差别较大,特级初榨橄榄油未检出甾醇烯类物质。冷榨植物油中4 种甾醇烯的含质相对较低,而精炼的油脂甾醇烯含质较高,混合油橄榄果渣油中虽然含有一定比例的特级初榨橄榄油,但其3,5-豆甾二烯含质已远超过了特级初榨橄榄油的限质标准(0.15 mg/kg)[36],品质也远低于特级初榨橄榄油。另外,在地沟油中检出3,5-胆甾二烯,说明地沟油中混有动物性油脂。
3 结 论
本实验建立一种快速有效的HPLC法,结合紫外检测和荧光检测,同时分离测定植物油中9 种脂溶性物质(角鲨烯、4 种生育酚和4 种甾醇烯)。样品经硅胶柱提取,前处处方法简便,快速、样品回收率高。采用C30柱分离,9 种被测组分基本达到基线分离,没有干扰杂质峰的影响。本方法灵敏、准确、重复性好,已用于实际样品的分析。
[1] 官波, 郑文诚. 角鲨烯提取、纯化及其应用[J]. 粮食与油脂,2010(2): 44-46.
[2] 梁新华, 郑彩霞, 张风侠. 甘草中角鲨烯高效液相色谱法测定[J]. 时珍国医国药, 2010, 21(8): 1856-1857.
[3] 张青龄. 橄榄油中角鲨烯含质的气相色谱/质谱法分析[J]. 福建分析测试, 2011, 20(3): 1-4.
[4] SEPPANEN C M, SONG Q, CSALLANY A S. The antioxidant functions of tocopherol and tocotrienol homologues in oils, fats, and food systems[J]. Journal of the American Oil Chemists’ Society, 2010,87(5): 469-481.
[5] CREWS C, CALVET-SARRETT R, BRERETON P. The analysis of sterol degradation products to detect vegetable fats in chocolate[J]. Journal of the American Oil Chemists’ Society, 1997, 74(10):1273-1280.
[6] KOCHHAR S P. Influence of processing on sterols of edible vegetable oils[J]. Lipid Research, 1983, 22(3): 161-188.
[7] DOBARGANES M C, CERT A, DIEFFENBACHER A. The determination of stigmastadienes in vegetable oils[J]. Pure and Applied Chemistry, 1999, 71(2): 349-359.
[8] 于瑞祥, 杨瑞钰, 张欣, 等. 高效液相色谱法同时测定植物油中4 种甾醇烯[J]. 分析化学, 2012, 40(12): 1902-1906.
[9] 廖杰, 赵玉兰, 李宁, 等. 植物油中角鲨 烯的GC/MS分析[J]. 现代仪器, 2008, 14(5): 36-37.
[10] 钟冬莲, 汤富彬, 沈丹玉, 等. 油茶籽油中角鲨烯含质的气相色谱法测定[J]. 分析试验室, 2011, 30(11): 104-106.
[11] 唐小红, 陈华勇, 王永华, 等. 气相色谱质谱联用测定深海鱼油中角鲨烯含质[J]. 农业机械, 2012(3): 50-53.
[12] SAMANIEGO-S☒NCHEZ C, QUESADA-GRANADOS J J, de la L☒PEZ-GARC☒A S H, et al. β-Carotene, squalene and waxes determined by chromatographic method in picual extra virgin olive oil obtained by a new cold extraction system[J]. Journal of Food Composition and Analysis, 2010, 23(7): 671-676.
[13] 陈全斌, 程忠泉, 杨建香, 等. 罗汉果种仁油中角鲨烯的高效液相色谱分析[J]. 广西科学, 2006, 13(2): 118-120.
[14] MURKOVIC M, LECHNER S, PIETZKA A, et al. Analysis of minor components in olive oil[J]. Journal of Biochemical and Biophysical Methods, 2004, 61(1/2): 155-160.
[15] NENADIS N, TSIMIDOU M. Determination of squalene in olive oil using fractional crystallization for sample preparation[J]. Journal of the American Oil Chemists’ Society, 2002, 79(3): 257-259.
[16] SCHWARTZA H, OLLILAINENB V, PIIRONENB V, et al. Tocopherol, tocotrienol and plant sterol contents of vegetable oils and industrial fats[J]. Journal of Food Composition and Analysis, 2008,21(2): 152-161.
[17] ABIDI S L. Chromatographic analysis of tocol-derived lipid antioxidants[J]. Journal of Chromatography A, 2000, 881(1/2):197-216.
[18] RUP☒REZ F J, MART☒N D, HERRERA E, et al. Chromatographic analysis of α-tocopherol and related compounds i n various matrices[J]. Journal of Chromatography A, 2001, 935(1/2): 45-69.
[19] KAMAL-ELDIN A, G☒RGEN S, PETTERSSON J, et al. Normalphase HPLC of tocopherols and tocotrienols. Comparison of different chromatographic columns[J]. Journal of Chromatography A, 2000,881(1/2): 217-227.
[20] TASIOULA-MARGARI M, OKOGERI O. Simultaneous determination of phenolic compounds and tocopherols in virgin olive oil using HPLC and UV detection[J]. Food Chemistry, 2001, 74(3):377-383.
[21] MARGARET S, YU Liangli. A single extraction and HPLC procedure for simultaneous analysis of phytosterols, tocopherols and lutein in soybeans[J]. Food Chemistry, 2012, 135(4): 2789-2795.
[22] CHEN Huilun, MARCO A, CARLO F, et al. Tocopherol speciation as first screening for the assessment of extra virgin olive oil quality by reversed-phase high-performance liquid chromatography/fluorescence detector[J]. Food Chemistry, 2011, 125: 1423-1429.
[23] 陈祎清, 莫文莲. 高效液相色谱测定玉米油生育酚含质研究[J]. 粮食与油脂, 2010(9): 32-34.
[24] GIMENO E, CASTELLOTE A I, LAMUELA-RAVENT☒S R M,et al. Rapid determination of vitamin E in vegetable oils by reversed phase high-performance liquid chromatography[J]. Journal of Chromatography A, 2000, 881: 251-254.
[25] D☒AZ T G, C☒CERES M I R, MURILLO B R. Chemometrics for the resolution of co-eluting peaks of β- and γ-tocopherols in RPHPLC: determination in edible oils and dietary supplements[J]. Food Chemistry, 2007, 105: 1583-1590.
[26] CERT A, MOREDA W. New method of stationary phase preparation for silver ion column chromatography: application to the isolation of steroidal hydrocarbons in vegetable oils[J]. Journal of Chromatography A, 1998, 823: 291-297.
[27] CREWS C, CALVET-SARRETT R, BRERETON P. Identification of steroidal hydrocarbons in refined confectionery fats by gas chromatography-mass spectrometry[J]. Journal of Chromatography A,1999, 847: 179-185.
[28] VERLEYEN T, SZULCEWSKA A, VERHE R, et al. Comparison of steradiene analysis between GC and HPLC[J]. Food Chemistry, 2002,78: 267-272.
[29] SCHULTE E. Determination of edible fat refining by HPLC of a 3,5-steradienes[J]. Fat Science Technology, 1994, 96(4): 124-128.
[30] AMELIO M, RIZZO R, VARAZINI F. Separation of stigmasta-3,5-diene, squalene isomers, and wax esters from olive oils by single highperformance liquid chromatography run[J]. Journal of the American Oil Chemists’ Society, 1998, 75(4): 527-530.
[31] 张欣, 于瑞祥, 杨瑞钰, 等. 植物油中角鲨烯的提取与高效液相色谱法分析[J]. 中国粮油学报, 2013, 28(5): 96-99.
[32] 于瑞祥, 张欣, 张秀芹, 等. 反相高效液相色谱法同时测定植物油中四种生育酚[J]. 分析测定学报, 2013, 32(6): 764-767.
[33] International Standards, ISO 15788-2 Animal and vegetable fats and oils: determination of stigmastadienes in vegetable oils: Part 2[S].
[34] BEATRICE G, MARLENE S, MARC A, et al. Simple and fast HPLC method for simultaneous determination of retinol, tocopherols,coenzyme Q10and carotenoids in complex samples[J]. Food Chemistry,2012, 134: 2560-2564.
[35] GABRIEL B, ANTONIO J, CARMEN D R, et al. Variability of vitamin E in virgin olive oil by agronomical and genetic factors[J]. Journal of Food Composition and Analysis, 2010, 23: 633-639.
[36] 薛益民, 薛雅琳, 张蕊, 等. GB 23347—2009 橄榄油、油橄榄果渣油[S].
Simultaneous Determination of Squalene, Tocopherols and Steradienes in Vegetable Oils by HPLC
XU Xianghua1, ZHANG Xin2, YU Ruixiang3, FANG Xiaoming4,*, DING Zhuoping2
(1. China Certification and Inspection Group, Testing Center of Shanghai Co. Ltd., Shanghai 201201, China;2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;3. Shanghai Institute of Measurement and Testing Technology, Shanghai 201203, China;4. Shanghai Entry-Exit Ins pection and Quarantine Bureau, Shanghai 200135, China)
A method for the simultaneous determination of squalene, four tocopherols and four steradienes in vegetable oils by high-performance liquid chromatography (HPLC) coupled with UV detector and fluorescence detector was developed. The sample was dissolved in n-hexane and cleaned up on a silica gel column. Nine analytes were first separated on a C30column(250 mm × 4.6 mm i.d., 5 μm) by gradient elution, at 25 ℃, with a mobile phase consisting of acetonitrile/methyl-tert-but yl ether (70:30, V/V) and water at a flow rate of 1.0 mL/min. The wavelength of UV detection was set at 210 nm for squalene and 235 nm for steradienes, respectively. The excitation and emission wavelengths of fluorescence detection were set at 290 nm and 340 nm for tocopherols. The method showed linear response for concentrations in the range of 0.05-100.0 mg/L for tocopherols, 5-500 mg/L for squalene, and 0.02-1.0 mg/L for steradienes, and the correlation coefficients (γ) were greater than 0.999. The average recovery rates of nine analytes in vegetable oils ranged from 85.5% to 103.8% at three spiked levels of 1, 100 and 500 mg/kg for tocopherols, 10, 100 and 500 mg/kg for squalene, and 0.075, 0.15 and 0.50 mg/kg for steradienes, and the relative standard deviations (RSDs) were less than 10%. The limits of detection (LOD)were 0.03 mg/kg for tocopherols, 3 mg/kg for squalene, and 0.012 mg/kg for steradienes. The limits of quantification (LOQ)were 0.1 mg/kg for tocopherols, 10 mg/kg for squalene, and 0.04 mg/kg for steradienes. The proposed method is sensitive,accurate and reliable, and has been successfully applied to real sample analysis.
squalene; tocopherols; steradienes; high-performance liquid chromatography (HPLC); vegetable oils
O657.7
A
1002-6630(2015)16-0141-07
10.7506/spkx1002-6630-201516026
2014-12-22
国家质检总局科研项目(2012IK184);上海市科委工程中心建设项目(11DZ2280300);上海市技术性贸易措施应对专项(12TBT010)
徐向华(1984—),男,硕士,研究方向为食品安全与检测。E-mail:xuxianghua@ccicshanghai.com
*通信作者:方晓明(1961—),男,研究员,博士,研究方向为食品安全分析。E-mail:fangxm@shciq.gov.cn

