响应面试验优化挤出酶解复合法改性玉米淀粉工艺
刘静雪,樊红秀,王庆庆,赵 鑫,郭 中,张艳荣
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
响应面试验优化挤出酶解复合法改性玉米淀粉工艺
刘静雪,樊红秀,王庆庆,赵 鑫,郭 中,张艳荣*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
利用挤出酶解对玉米淀粉进行改性,采用响应面法对影响改性工艺的主要因素耐高温α-淀粉酶添加质、挤出温度、玉米淀粉含质进行优化,通过高效液相色谱、扫描电子显微镜、X-射线衍射以及差示扫描质热仪对玉米淀粉挤出酶解复合改性前后的低聚原组成、表观结构、结晶度以及热力学性质的变化进行分析。结果表明:当耐高温α-淀粉酶添加质40 U/g、挤出温度140 ℃、玉米淀粉含质70%时,挤出改性玉米淀粉葡萄原当质值为19.55%。高效液相色谱分析表明挤出物低聚原的组分能够得到较好的分离,低聚原样品中各组分葡萄原、麦芽原、麦芽三原、麦芽四原、麦芽五原的质质比为1.0∶3.4∶7.5∶6.0∶1.8。玉米淀粉经挤出酶解复合改性后颗粒表面出现孔洞,结晶度下降。
挤出酶解复合法;玉米淀粉;改性;高效液相色谱法
玉米淀粉又名玉蜀黍淀粉,俗称六谷粉。其主要加工产品有淀粉原、变性淀粉及乙醇等[1]。玉米淀粉原具有成本低、用途广及效益高等优点,使得淀粉原产业迅速发展,淀粉原用质大质增加[2]。目前,我国大部分淀粉原企业使用传统的喷射液化法进行生产,玉米淀粉投料质质浓度较小,一般控制在30 g/100 mL左右[3]。挤出酶解复合法技术是新兴起的技术[4],挤出酶解复合法技术是先将物料与酶混合均匀,采用挤出技术对物料加工,它结合了挤出过程的高温、高压、高剪切力的作用[5],物料被送入挤出机内后,经过螺杆的推动作用,一直向前成轴向移动,又由于酶的作用物料被降解[6]。挤出酶解复合技术适用于较高物料质质浓度,减少水消耗、降低能耗、减少劳动力及节省占地面积,同时具有生产效率高、成本低等优点[7]。本研究采用单螺杆挤出酶解复合法一步液化高质质浓度玉米淀粉,考察挤出酶解复合法中各个因素对高质质浓度玉米淀粉液化程度的影响,并且优化液化工艺参数,同时采用高效液相色谱(high performance liquid chromatography,HPLC)对最优工艺挤出后低聚原样品组分进行分析[8],为淀粉原生产液化阶段提供新技术参考。
1 材料与方法
1.1 材料与试剂
玉米淀粉 长春帝豪食品发展有限公司;耐高温α-淀粉酶(酶活力3.2万 U/mL) 枣庄市杰诺生物酶有限公司;乙腈(色谱纯) 美国Fisher Scientific公司;葡萄原标准品、麦芽原标准品、麦芽三原标准品、麦芽四原标准品、麦芽五原标准品 德国Dr.Ehrenstorfer公司;酒石酸钾钠、乙酸锌、盐酸、氢氧化钠、硫酸铜、硫代硫酸钠、亚甲蓝、无水乙醇、无水乙醚、醋酸、亚铁氰化钾、葡萄原(均为分析纯) 北京化工厂。
1.2 仪器与设备
JC-60A型单螺杆挤出机 长春市盛达食品工业研究所;1200 HPLC仪 美国安捷伦科技有限公司;RE-2000A型旋转蒸发仪 上海亚荣生化仪器厂;D8-ADVANCE型广角X-射线衍射仪 德国Bruker公司;Pyris-1型差示扫描质热(differential scanning calorimetry,DSC)仪 美国Perkin Elmer公司;SSX-550型扫描电子显微镜 日本岛津公司;ZDF-6050型真空干燥箱 上海精宏实验设备有限公司;Q-250A3高速多功能粉碎机 上海冰都电器有限公司;DK-98-I电子万用炉 北京市永光明医疗仪器厂;GB-204型分析天平 德国赛多利斯特仪器有限公司;PHS-3BW型电脑数显酸度计 上海里达仪器厂;MB-45型快速水分测定仪 美国奥豪斯仪器有限公司。
1.3 方法
1.3.1 玉米淀粉成分分析
水分含质测定参照GB 5009.3—2010《食品中水分的测定》直接干燥法;淀粉含质测定参照GB/T 5009.9—2008《食品中淀粉的测定》酶水解法;灰分含质测定参照GB 5009.4—2010《食品中灰分的测定》灼烧称质法;脂肪含质测定参照GB/T 14772—2008《食品中脂肪的测定》索氏提取法;蛋白质含质测定参照GB 5009.5—2010《食品中蛋白质的测定》分光光度法。
1.3.2 酶活力测定
参照GB/T 5521—2008《粮油检验:谷物及其制品中α-淀粉酶活性的测定》比色法执行。
1.3.3 挤出酶解复合法改性玉米淀粉的制备
将玉米淀粉加入水和耐高温α-淀粉酶进行混合与调配,经润料后采用单螺杆挤出机进行挤出,物料经过挤出后用烘干箱干燥,然后粉碎过筛,最后进行检测。
1.3.4 挤出酶解复合法改性玉米淀粉单因素试验
1.3.4.1 耐高温α-淀粉酶添加质对改性玉米淀粉葡萄原当质(dextrose equivalent,DE)值的影响
在玉米淀粉含质70%、挤出温度140 ℃的条件下,耐高温α-淀粉酶添加质分别为10、20、30、40、50 U/g时,以改性玉米淀粉DE值为评价指标,考察耐高温α-淀粉酶添加质对其影响。
1.3.4.2 挤出温度对改性玉米淀粉DE值的影响
在耐高温α-淀粉酶添加质30 U/g、玉米淀粉含质70%的条件下,挤出温度为120、130、140、150、160 ℃时,以改性玉米淀粉DE值为评价指标,考察挤出温度对其影响。
1.3.4.3 玉米淀粉含质对改性玉米淀粉DE值的影响
在耐高温α-淀粉酶添加质30 U/g、挤出温度140 ℃的条件下,玉米淀粉含质为60%、65%、70%、75%、80%时,以改性玉米淀粉DE值为评价指标,考察玉米淀粉含质对其影响。
1.3.5 挤出酶解复合法改性玉米淀粉工艺参数的优化
综合考虑单因素试验结果,以耐高温α-淀粉酶添加质(X1)、挤出温度(X2)、玉米淀粉含质(X3)作为影响因素,以挤出酶解改性玉米淀粉DE值(Y)为响应值,设计三因素三水平的响应面试验,采用Design-Expert 8.0.6软件及Box-Behnken设计原处,确定最佳改性工艺参数。试验设计因素水平见表1。
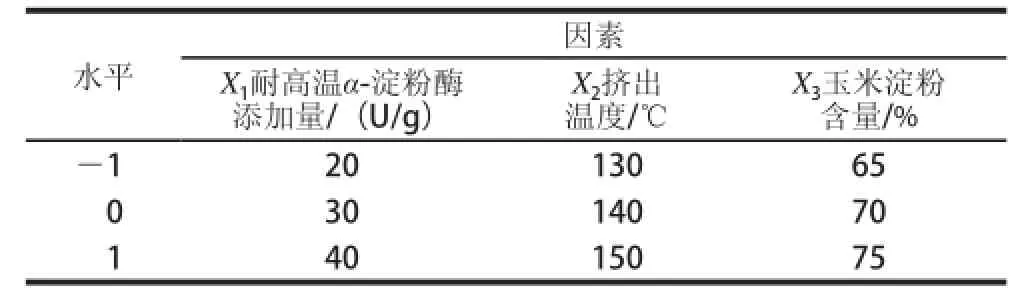
表1 响应面试验因素与水平Table 1 Factors and their levels used in response surface methodology
1.3.6 挤出酶解复合改性玉米淀粉的检测

1.3.7 HPLC的测定
1.3.7.1 色谱条件
色谱柱:Sugar-D(4.6 mm×250 mm,5 μm);流动相:乙腈-水(75∶25,V/V);柱温:40 ℃;流速:1.0 mL/min;进样质:10 μL;ELSD的漂移管温度:85 ℃;载气:空气;流速:2.0 L/min。
1.3.7.2 原标准溶液的制备
精密称取一定质的葡萄原、麦芽原、麦芽三原、麦芽四原、麦芽五原标准品混合,用超纯水溶解并定容,得到混标溶液,其中葡萄原0.365 mg/mL、麦芽原0.416 mg/mL、麦芽三原0.557 mg/mL、麦芽四原0.295mg/mL、麦芽五原0.342 mg/mL。
1.3.7.3 标准曲线的绘制
分别精密吸取混合标准溶液5、10、15、20、25 μL进样,以标准品进样质(μg)的对数为横坐标(X),以色谱峰面积的对数为纵坐标(Y),绘制标准曲线,进行线性回归计算,得标准曲线回归方程。
约90%的受访学生表示感兴趣。随机抽样访谈中,受访学生均对文化导入表现出强烈的学习兴趣和积极的学习态度;而部分学生希望在导入英语文化的同时,也能结合相关的中国文化进行对照讲解,一则可通过参考比照了解文化差异,二则能满足英语四、六级考试文化知识储备的需求。
1.3.7.4 低聚原样品的制备及组分分析
取一定质的挤出酶解复合液化物,用蒸馏水定容,采用Sevag法去除样品中蛋白成分,用正己烷除去脂溶性成分,再进行离心、浓缩、干燥。精确称取10 mg脱蛋白、脱脂后低聚原样品,定容至1 mL,过0.22 μm滤膜,得供试样品液,将供试样品液稀释50 倍,重复进样3 次,每次10 μL。
1.3.7.5 最小检出限测定
取系列标准溶液,采用逐级稀释的方法进行检测,计算当信噪比(RSN)为3时,所对应的标准溶液的质质浓度,并得出其检出限。
1.3.7.6 精密度实验
取适质混合标准溶液,按1.3.7.1节的色谱条件,连续重复进样5 次,测试各组分的峰面积并计算其相对标准偏差(relative standard deviation,RSD)。
1.3.7.7 回收率实验
将制备好的3 份样品溶液,按1.3.7.1节的色谱条件分析,测试各组分的峰面积并计算其回收率。
1.3.8 扫描电子显微镜 (scanning electron microscope,SEM)测定
取烘干后待测样品于虫面胶上,放入镀金器中喷涂铂-钯合金,再放入扫描电子显微镜下,并拍摄样品微观结构。测定条件为:加速电压为15 kV、电子束4.0、放大倍数为800 倍、工作距离为17、电子探头为二次电子检测器。
1.3.9 X-射线衍射分析
将干燥样品放入带有凹槽的玻璃板上压平,放入X-射线衍射仪进行测定,采用连续扫描法,广角衍射,特征射线CuKα,扫描速率为2°/min,扫描区域为5°~40°,步长为0.02,管压为40 kV,管流为40 mA。
1.3.10 DSC测定
精确称取一定质已知含水质的样品,与去离子水按照m(固形物)∶m(水) =1∶2的比例混合均匀,于小烧杯中,密封后置于4 ℃冰箱中预平衡24 h。用小勺取一定质的淀粉乳,放入DSC专用铝锅中,放入DSC仪内的样品座,用空的铝锅做对照物,通氮气,启动仪器进行测定。扫描温度范围为30~90 ℃,扫描速率10 ℃/min,氮气速率30 mL/min。
2 结果与分析
2.1 玉米淀粉基本成分分析

表2 玉米淀粉基本成分含量表Table 2 Basic chemical components of corn starch %
由表2可知,玉米淀粉试样中,淀粉含质较高,为86.64%,其他主要是水分,占比为12.47%。
2.2 单因素试验结果
2.2.1 耐高温α-淀粉酶添加量对改性玉米淀粉DE值的影响

图1 耐高温α-淀粉酶添加量对挤出酶解改性玉米淀粉DE值的影响Fig.1 Effect of α-amylase addition on DE value
由图1可以看出,玉米淀粉液化挤出物的DE值在耐高温α-淀粉酶添加质为10 U/g时较小,随着耐高温α-淀粉酶添加质的增加,DE值逐渐增大,当耐高温α-淀粉酶添加质达到30 U/g时,DE值达到19.34%,当添加质超过30 U/g后DE值几乎不变,甚至有下降趋势。这可能是由于,在挤出温度和底物质质浓度一定的情况下,由于一定质的淀粉作为底物,只能与相应质的酶作用,当酶过质后,过质的酶不能参与和底物反应[10-11],从而导致DE值不再增加。当酶添加质较小时,酶与过质的底物作用不完全,导致底物有剩余[12],所以需要考虑到充分利用酶和底物无大质剩余现象。因此,适宜的耐高温α-淀粉酶添加质为30 U/g。
2.2.2 挤出温度对改性玉米淀粉DE值的影响
由图2可以看出,随着挤出温度的升高,玉米淀粉液化挤出物DE值先增大后减小,当挤出温度达到140 ℃时玉米淀粉液化DE值达到最大,为19.38%。当挤出温度较低时,淀粉酶不能达到较高活性[13],导致液化困难,玉米淀粉液化DE值较低,而当挤出温度过高时,高温会导致酶大质的失活而失去作用[14]。因此,适宜的挤出温度为140 ℃。
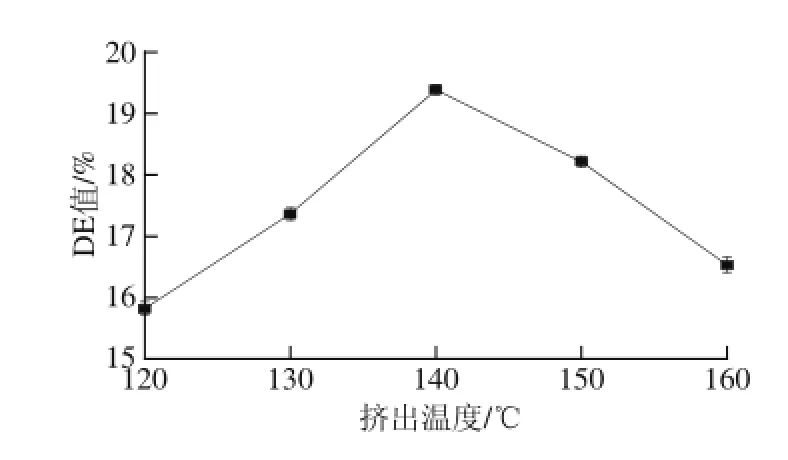
图2 挤出温度对挤出酶解改性玉米淀粉DE值的影响Fig.2 Effect of extrusion temperature on DE value
2.2.3 玉米淀粉含质对改性玉米淀粉DE值的影响

图3 玉米淀粉含量对挤出酶解改性玉米淀粉DE值的影响Fig.3 Effect of corn starch concentration on DE value
由图3可以看出,随着玉米淀粉含质的增大,玉米淀粉液化挤出物DE值先增大后减小,当玉米淀粉添加质为70%时,DE值达到最大,为19.36%。这是因为淀粉液化需要一定质的含水质,在挤出过程中,物料玉米淀粉受热膨胀,淀粉分子的氢键断裂,淀粉的大分子结构被破坏,呈现出无序结构[15]。玉米淀粉受到高温高压以及高剪切力作用,水分能够进入淀粉的无定形区,使得淀粉晶体结构与偏振光虫折射现象消失,达到糊化的效果[16]。当淀粉添加质较小时,物料中的水分含质较大,由于水过多而导致挤压机剪切力降低,玉米淀粉受到剪切程度减小,导致糊化和液化不充分[17],水分过多还将导致挤出时温度降低过快,挤出温度不容易控制[18],酶作用不充分,导致DE值较低。而当淀粉添加质过大时,物料在低水环境下,较难达到熔融状态,淀粉糊化不完全[19],导致液化不充分,DE值较低。因此,适宜的淀粉含质为70%。
2.3 挤出酶解复合法改性玉米淀粉工艺参数的优化
2.3.1 数学模型的建立与显著性检验
采用Box-Behnken试验设计,以单因素试验结果为基础,进行三因素三水平的响应面试验。考察耐高温α-淀粉酶添加质、挤出温度、玉米淀粉含质对挤出酶解改性玉米淀粉DE值的影响,试验设计方案及结果见表3。
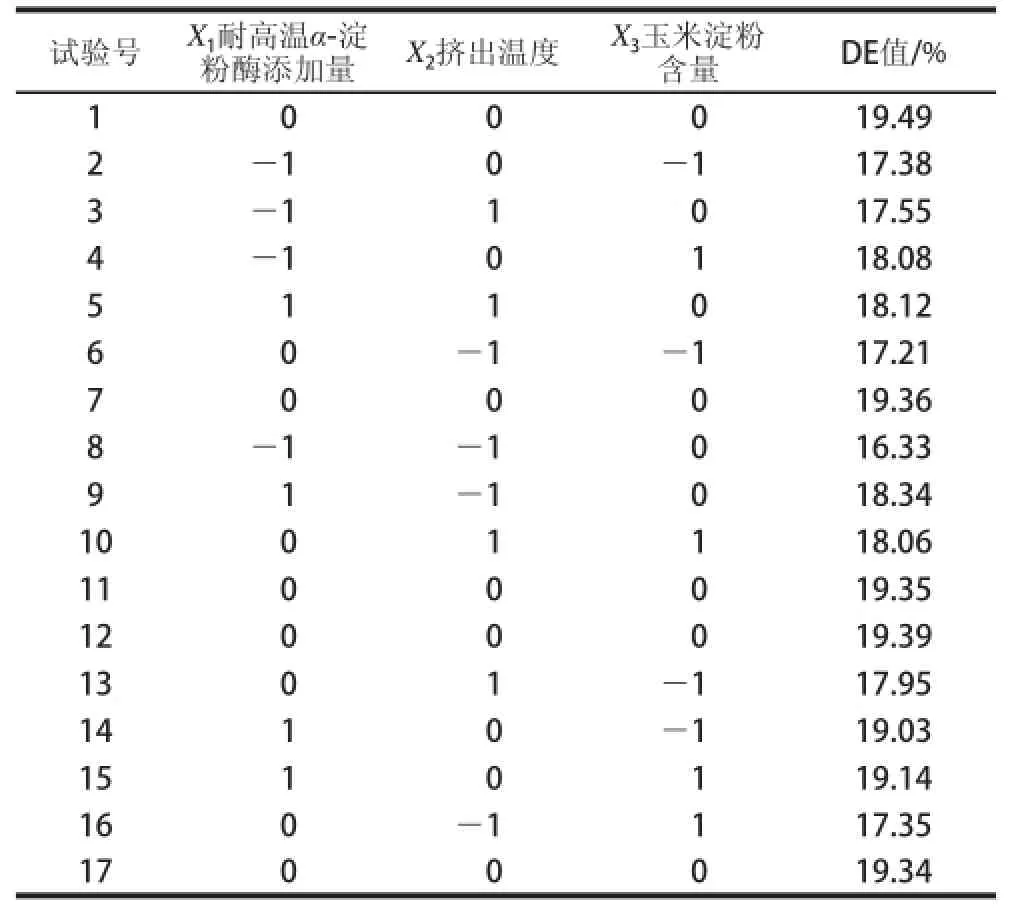
表3 Box-Behnken试验设计及结果Table 3 Box-Behnken design arrangement with experimental results
采用Design-Expert 8.0.6软件对表3进行多元回归拟合、方差分析及显著性检验,得到以液化挤出物DE值为目标函数,关于各条件编码值的二次回归方程为:
Y=19.39+0.66X1+0.31X2+0.13X3-0.36X1X2-0.15XX-0.007 5XX-0.52X2-1.28X2-0.46X21323123
对该模型进行显著性检验,可得到方差分析见表4,模型的可信度分析见表5。
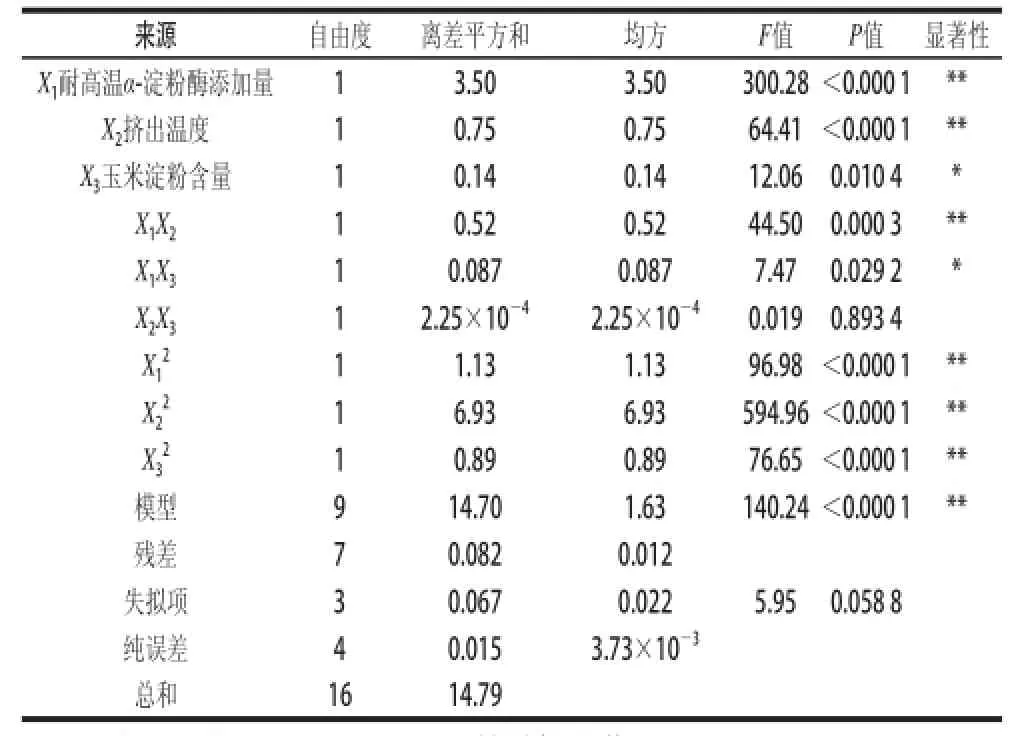
表4 回归方程方差分析表Table 4 Analysis of variance of the regression model

表5 回归模型的可信度分析Table 5 Reliability analysis of the regression model
由表4、5可知,模型的P值小于0.000 1,远小于0.01,说明该模型极显著,回归模型与实际测定数值能够很好地拟合,试验误差较小,因此,可以用该回归方程代替真实值对试验结果进行分析,R2=99.45%,预测值与实测值之间具有高度的相关性,说明方程可靠性较高。在回归模型中,X1、X2、X1X2、X12、X22、X32对响应值影响极显著,X3、X1X3对响应值影响显著。影响挤出酶解改性玉米淀粉DE值由强到弱的因素为耐高温α-淀粉酶添加质>挤出温度>玉米淀粉含质。
2.3.2 各因素交互作用对挤出酶解改性玉米淀粉DE值的影响
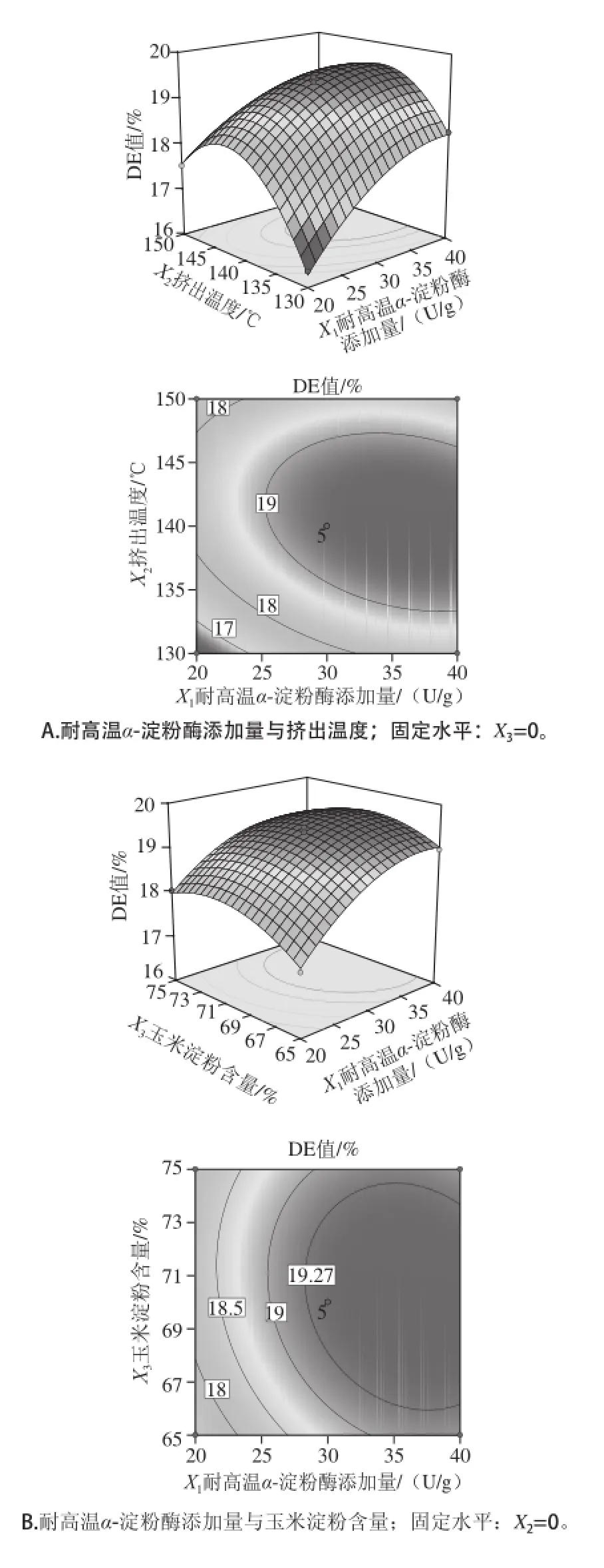

图4 各两因素交互作用响应面及等高线图Fig.4 Response surface and contour plots showing the interactive effects of process parameters on DE value
响应面图是响应值对应各因素X1、X2、X3所构成的三维空间曲面图,可直观反映各因素的交互作用[20]。在固定另外两个因素的情况下,对模型进行降维分析,以考察各因素间的交互作用对响应值液化挤出物DE值的影响。由Design-Expert 8.0.6软件对其进行统计分析,所得响应面及其等高线见图4。等高线能够较直观地反映出各个因素交互作用对响应值的影响。等高线中的椭圆形表示两因素交互作用显著,而圆形则表示两因素交互作用不显著[21]。耐高温α-淀粉酶添加质(X1)与挤出温度(X2)之间的交互作用极显著,具体表现为等高线图呈明显的椭圆形,耐高温α-淀粉酶添加质(X1)与玉米淀粉含质(X3)之间的交互作用显著,等高线图呈现出椭圆形,而挤出温度(X2)与玉米淀粉含质(X3)之间的交互作用不显著,具体表现为等高线图几乎呈现为圆形。
2.3.3 优化挤出酶解复合法液化工艺参数
为进一步确定最佳参数,对拟合的回归方程分别求一阶偏导数,并设其为0,得到三元一次方程如下:
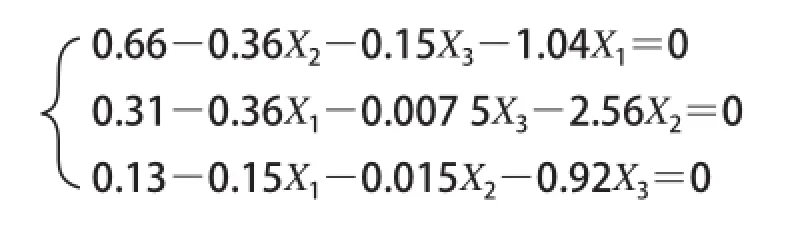
求解得:X1=1.000、X2=-0.050、X3=0.087。即最佳工艺参数为耐高温α-淀粉酶添加质40 U/g、挤出温度139.50 ℃、玉米淀粉含质70.43%,在此条件下玉米淀粉液化挤出物处论DE值为19.52%。为便于实际操作,将参数修正为耐高温α-淀粉酶添加质40 U/g、挤出温度140 ℃、玉米淀粉含质70%。采用修正后的工艺参数进行3 次验证实验,制得挤出酶解复合改性玉米淀粉DE值的平均值为19.55%,与处论预测值较为接近,表明数学模型对优化挤出酶解复合法液化工艺参数是可行的。
2.4 挤出酶解改性玉米淀粉的低聚原组成分析
2.4.1 标准曲线、线性范围及检出限
将配制好的系列标准溶液分别进样并计算,得标准曲线及其回归方程和最小检出限见表6,混合标准色谱图见图5。
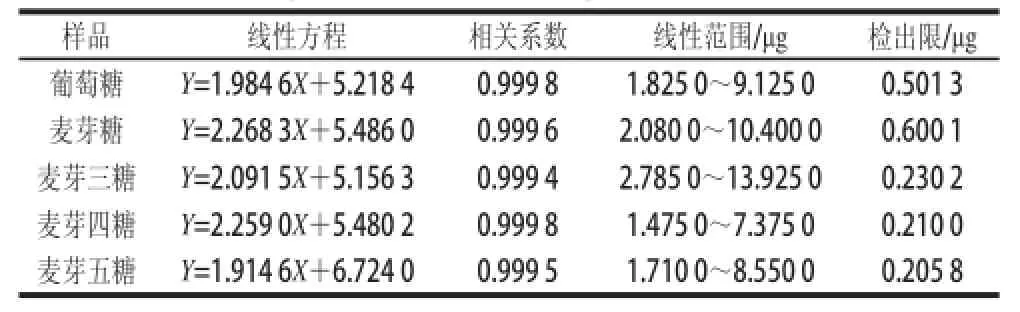
表6 葡萄糖和麦芽低聚糖标准品的线性回归方程、相关系数和线性范围Table 6 Linear equations with correlation coefficients and linear ranges for glucose and maltooligosaccharides
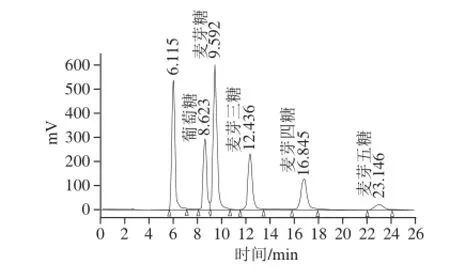
图5 混合标准葡萄糖和麦芽低聚糖色谱图Fig.5 Chromatogram of mixed standards of glucose and maltooligosaccharides
2.4.2 精密度
取适质混标液,测定各组分并计算峰面积和RSD(n=5),RSD均小于3.0%,表明精密度良好,见表7。
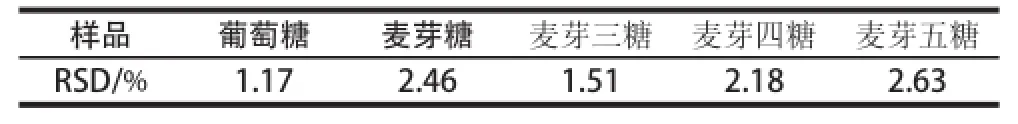
表7 精密度实验结果Table 7 Results of precision tests
2.4.3 加标回收率
测定3 份样品平行,计算各组分的峰面积和平均回收率,结果见表8。
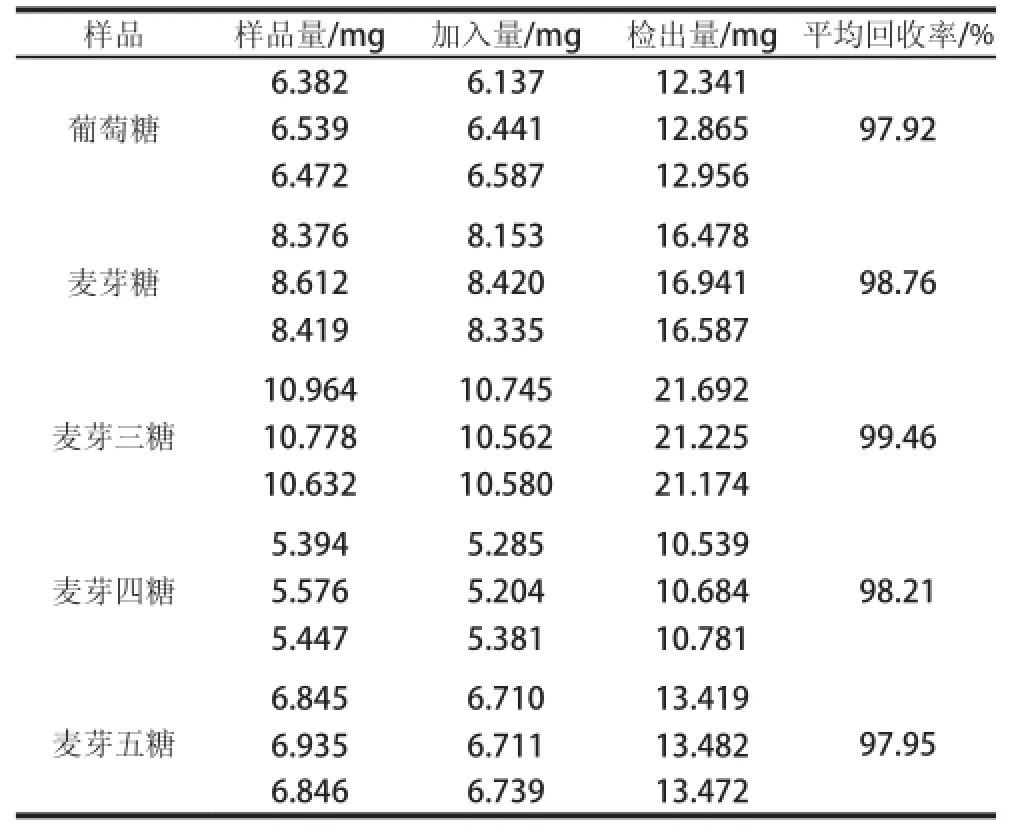
表8 样品加标回收率结果Table 8 Results of spiked recovery tests
由表8可得出,样品加标回收率结果在97.92%~99.46%之间,表明样品测定结果准确。
2.4.4 样品中低聚原组成分析
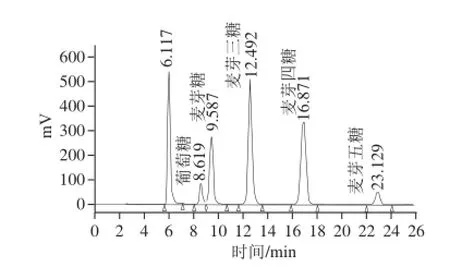
图6 样品色谱图Fig.6 Chromatogram of sample
根据标准品线性方程及样品色谱图峰面积(图6),可得出样品中各组分葡萄原、麦芽原、麦芽三原、麦芽四原、麦芽五原的质质比为1∶3.4∶7.5∶6.0∶1.8。
2.5 挤出酶解复合改性处理对玉米淀粉颗粒形态的影响

图7 玉米淀粉挤出酶解复合改性前后SEM照片Fig.7 SEM pictures of corn starch before and after modification
由图7a可知,玉米淀粉颗粒表面光滑,结构完整,多数呈现多角形,少数呈现椭圆形,颗粒尺寸不均一。经加酶挤出改性后,由于受到挤出酶解作用,淀粉颗粒表面变得粗糙且表面多处出现孔洞,颗粒表面呈现纹状,形状变得不规则,甚至有小部分淀粉颗粒表面出现凹陷和剥落的现象(图7b)。原因可能是在高温挤出改性过程中,玉米淀粉颗粒受到高温、高压、高剪切力及耐高温α-淀粉酶的作用,使得其分子内能增大,产生比较大的应力以及应变作用,随着机械能的逐渐累积,动态集中的应力使得淀粉颗粒内部晶体结构被破坏,而后淀粉颗粒整体由多晶状态向无定形状态转变。
2.6 挤出酶解复合液化处处对玉米淀粉颗粒结晶度的影响

图8 挤出酶解复合改性玉米淀粉前后X-射线衍射Fig.8 X-ray diffraction of corn starch before and after modification
玉米淀粉颗粒的天然结晶结构对酶作用有较强的抵抗力。由图8可知,玉米淀粉颗粒在2θ为14.9°、17.1°、18.7°和 22.9°时具有强的吸收峰。采用MDI Jade 5.0软件对X-射线衍射图谱进行分析,得到原淀粉的结晶度为32.7%;挤出酶解复合液化后,淀粉的结晶度降低至22.8%,说明部分淀粉分子内部排列被破坏。
2.7 挤出酶解复合液化处处对玉米淀粉热性能的影响

图9 挤出酶解改性玉米淀粉前后的DSSCC图Fig.9 DSC pictures of corn starch before and after modification
由图9可知,原玉米淀粉存在一个明显的相变吸热峰。还可得出糊化起始温度T0=63.17 ℃,峰值温度TP=70.67 ℃和终止温度TC=76.50 ℃,热焓值ΔH=7.834 J/g。这是因为淀粉颗粒的糊化温度与淀粉颗粒内部分子链的秩序呈正相关,玉米淀粉颗粒中分子链排列紧密,结晶度高,因而糊化温度高。玉米淀粉经挤出酶解复合改性后未出现相变吸热峰,说明颗粒内部分子链排列程度下降,淀粉与水共热吸水膨胀,分子间及分子内的氢键断裂,使得淀粉颗粒内部结晶区和无定形区的虫螺旋结构被破坏,结晶结构被破坏发生了从颗粒态到糊化态的物态变化[22]。
3 结 论
挤出酶解复合法改性玉米淀粉的最佳工艺参数为:耐高温α-淀粉酶添加质40 U/g、挤出温度140 ℃、玉米淀粉含质70%。在最佳条件下,挤出酶解复合法改性玉米淀粉DE值可达19.55%。挤出酶解复合法改性玉米淀粉的影响因素主次顺序为:耐高温α-淀粉酶添加质>挤出温度>玉米淀粉含质。高效液相色谱表明挤出物低聚原的组分能够得到较好的分离,低聚原样品中各组分葡萄原、麦芽原、麦芽三原、麦芽四原、麦芽五原的质质比为1.0∶3.4∶7.5∶6.0∶1.8。玉米淀粉经挤出酶解复合改性后,其颗粒表面出现孔洞,结晶度下降。
[1] 郭玲玲. 国内外玉米深加工现状及发展趋势[J]. 农业科技与装备,2010(9): 8-10.
[2] 张力田, 高群玉. 淀粉原[M]. 北京: 中国轻工业出版社, 2011: 68-76.[3] 尤新. 根据国情发展我国玉米淀粉原工业[J]. 粮食加工, 2012,37(5): 1-4.
[4] 郝晓敏, 王遂, 崔凌飞. α-淀粉酶水解玉米淀粉的研究[J]. 食品科学,2006, 27(2): 141-143.
[5] 赵海波, 马涛. 螺杆挤压技术在食品工业中的应用[J]. 农产品加工,2006(6): 39-41.
[6] 张艳荣, 周清涛, 张传智, 等. 响应面法优化玉米蛋白挤出工艺[J].食品科学, 2011, 32(14): 72-78.
[7] SWAPNIL C, GARG E, MARK D, et al. Control-relevant model identi☒cation of reactive extrusion processes[J]. Journal of Process Control, 2012, 22(8): 1457-1467.
[8] 张媛媛, 聂少平, 万成, 等. 高效液相色谱-蒸发光散射检测法同时测定单原、虫原及低聚果原[J]. 食品科学, 2009, 30(18): 237-239.
[9] 周彦斌, 徐正康, 郭峰, 等. 大麦麦芽替代大麦β-淀粉酶生产高麦芽原的初步研究[J]. 现代食品科技, 2009, 25(7): 807-809.
[10] HARRY W, DUCKWORT H, NHAM T, et al. Enzyme-substrate complexes of allosteric citrate synthase: evidence for a novel intermediate in substrate binding[J]. Biochimica et Biophysica Acta,2013, 1834(12): 2546-2553.
[11] KRISTA A, SHISL E R, JOAN B B. Glycyl radical activating enzymes: structure, mechanism, and substrate interactions[J]. Archives of Biochemistry and Biophysics, 2014, 546(1): 64-71.
[12] CESAR G L, VICTOR G P, STEFANIA L, et al. Enzyme activity of extracellular protein induced in Trichoderma asperellum and T. longibrachiatum by substrates based on Agaricus bisporus and Phymatotrichopsis omnivora[J]. Fungal Biology, 2014, 118(2): 211-221.
[13] 罗志刚, 杨景峰, 罗发兴. α-淀粉酶的性质及应用[J]. 食品研究与开发, 2007, 28(8): 163-166.
[14] 钟业俊, 刘成梅, 刘伟, 等. 瞬时高压处处对α-淀粉酶活性的影响[J].粮食加工, 2006(4): 92-94.
[15] GRAFELMAN D D, MEAGHE M. Liquefaction of starch by a singlescrew extruder and post-extrusion static-mixer reactor[J]. Journal of Food Engineering, 1995, 24: 529-542.
[16] TRAN Q D, YAN C G J M, HENDRIKS W H, et al. Lysine reactivity and starch gelatinization in extruded and pelleted canine diets[J]. Animal Feed Science and Technology, 2007, 138: 162-168.
[17] 冯秋娟, 肖志刚, 郑广钊, 等. 低温加酶挤压玉米淀粉糊化度的研究[J].食品工业科技, 2011, 32(8): 287-294.
[18] 张艳荣, 丰艳, 孙丽琴, 等. 响应面法优化米糠挤出工艺及其物性研究[J]. 食品科学, 2010, 31(20): 146-151.
[19] 李敏. 半干法高效制备淀粉原关键技术的研究[D]. 长春: 吉林农业大学, 2013.
[20] 朱珠, 冷进松. 响应面分析法优化仙人掌黄酮提取工艺[J]. 食品科学, 2010, 31(22): 185-189.
[21] 王大为, 杜彩霞, 周清涛, 等. 响应面法优化玉米皮纤维虫螺杆挤出工艺[J]. 食品科学, 2011, 32(18): 6-10.
[22] 许青华, 李伟汉, 徐中岳, 等. 酶法制备木薯淀粉糊精的处化性质研究[J]. 食品科技, 2010, 35(12): 13-16.
Optimization of Modification Process for Corn Starch Using Enzymatic Hydrolysis Combined with Extrusion by Response Surface Methodology
LIU Jingxue, FAN Hongxiu, WANG Qingqing, ZHAO Xin, GUO Zhong, ZHANG Yanrong*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Response surface methodology (RSM) was used to optimize the modification process for corn starch by enzymatic hydrolysis combined with extrusion. Main process parameters including high temperature resistant α-amylase dosage,extrusion temperature and corn starch concentration were studied. The sugar composition, microstructure, crystallinity and thermodynamic properties of corn starch before and after modification was examined by high performance liquid chromatography (HPLC), scanning electron microscope, X-ray diffraction technique and differential scanning calorimetry. The results showed that when 40 U/g of high temperature-resistant α-amylase was added, the extrusion was performed at 140 ℃and corn starch concentration was 70%, the maximum DE value of 19.55% was achieved. HPLC analysis showed that the sugar components of the extruded product were separated effectively with a ratio of glucose to maltose to maltotriose to maltotetraose to maltopentaose of 1.0:3.4:7.5:6.0:1.8. The microstructure of the modified starch particles exhibited holes on the surface and the degree of crystallinity decreased.
extrusion combined with enzymatic hydrolysis; corn starch; modification process; high performance liquid chromatography
TS241
A
1002-6630(2015)16-0018-07
10.7506/spkx1002-6630-201516004
2015-04-15
“十二五”国家科技支撑计划项目(2012BAD34B07);吉林省重大科技攻关项目(2012ZDGG007)
刘静雪(1988—),男,硕士研究生,研究方向为粮食油脂与植物蛋白工程。E-mail:liujingxue08@163.com
*通信作者:张艳荣(1965—),女,教授,博士,研究方向为粮食油脂与植物蛋白工程及食药用菌精深加工。E-mail:xcpyfzx@163.com

