蓝莓叶总黄酮的纯化及抗脂质过氧化能力研究
郑洪艳,苏宁,霍彤,赵丹,王昌涛,*,杨丽
(1.中国检验检疫科学研究院,北京100123;2.北京工商大学理学院,北京100048)
蓝莓叶总黄酮的纯化及抗脂质过氧化能力研究
郑洪艳1,苏宁1,霍彤2,赵丹2,王昌涛2,*,杨丽1
(1.中国检验检疫科学研究院,北京100123;2.北京工商大学理学院,北京100048)
以静态吸附量和解析率为评价指标,对5种大孔吸附树脂对蓝莓叶黄酮的纯化效果进行比较。结果表明DM-130吸附树脂效果最好,吸附量达到71.5mg/g,解析率达到74.41%。纯化后的黄酮纯度达到68.8%。以抗坏血酸为对照,考察蓝莓叶黄酮对油脂氧化的抑制能力,结果显示其半数抑制浓度(IC50)为78.46μg/mL,显著强于抗坏血酸(IC50为5.56mg/mL)。
总黄酮;大孔树脂;纯化;抗脂质过氧化
黄酮类化合物的纯化分离主要是通过溶剂萃取法及离子交换树脂法等方式,但这些方法都具有其自身的缺点。溶剂萃取法应用过程中溶剂的残留量大,处理不彻底,会有溶剂残留,严重影响后续的工艺。离子交换树脂法则需引入可进行交换的酸性或碱性基团,处理量小,提取率低。对黄酮类化合物而言,弱极性树脂吸附量大,分离度好,解吸容易,处理量高[1-2]。近年来,提纯黄酮类化合物主要有HP-20系列、DA201、DM103和AB-8等树脂。因为黄酮类化合物本身的极性较小,而且可以和树脂骨架分子形成氢键,其网状结构更适合黄酮类化合物的分离纯化[3]。
抗氧化物质与促氧化物质的平衡遭到破坏而令机体细胞长期处于氧化应激状态,产生有毒性的氧化产物会干扰细胞正常功能,引发炎症(inflammation),加速人体细胞的衰老或各种慢性疾病的发生。黄酮类化合物具有清除人体中超氧离子自由基、抗衰老[4],调节机体免疫及炎症反应等多种生理活性及功效[5-6]。通过抗油脂氧化试验,测定蓝莓叶黄酮的抗氧化活性,同时与其他抗氧化剂(VC)的抗氧化活性进行比较,探讨蓝莓叶黄酮提取物的抗氧化能力。为生产实践中提高蓝莓叶黄酮的附加值提供新思路。
1 仪器、材料与试剂
1.1 仪器
紫外-可见分光光度计:北京普析通用仪器有限公司;旋转蒸发仪(RE-301):上海互佳仪器有限公司;SHZ-CD型循环水真空泵:上海贝伦仪器设备有限公司。
色谱系统:Waters Empower色谱系统由Waters 1525二进制高效液相色谱泵、Waters2707自动进样系统、Waters 2489 UV/VIS检测器和 Empower软件、Windows XP系统进行数据收集处理。
1.2 试剂
蓝莓叶购于江苏沃田农业有限公司。十二烷基硫酸钠(SDS)和Brij-35(聚氧乙烯(23)月桂醚)为分析纯级别,芦丁标准物质纯度98%,以上试剂均购于阿拉丁试剂公司:中国上海。DPPH、卵磷脂溶液、硫酸亚铁、三氯乙酸、硫代巴比妥酸、HCl、六氰合铁酸钾溶液(K3Fe(CN)6)、邻苯三酚、H2O2、水杨酸、亚硝酸钠、氢氧化钠、硝酸铝等,分析纯,上海化学试剂有限公司;AB-8、DM130、DM301、NKA-9和HPD-100树脂:北京迪朗生化科技有限公司。各种树脂物理性能列于表1。

表1 树脂物理性质比较Table1 The physical property of macroporous adsorptive resins
2 方法
2.1 大孔树脂分离纯化方法
2.1.1 树脂的预处理
1)每组取树脂50 g浸渍于500mL 95%乙醇30 h。
2)用75%乙醇洗涤树脂,至流出液加水不呈白色混浊为止,再用去离子水浸泡树脂并洗涤,洗净至无乙醇味儿。
3)用250mL 5%HCl溶液浸泡树脂5 h,而后用去离子水洗至水pH中性。
4)用250mL2%NaOH溶液浸泡树脂5 h,而后用去离子水洗至水pH中性。
2.1.2 蓝莓叶总黄酮提取物的制备
60℃干燥恒重蓝莓叶,粉碎后过50目筛待用。以料液比1∶25(g/mL)60%乙醇溶液,80℃回流提取2次,90min/次,过滤,合并滤液。将滤液进行旋转蒸发或者冷冻干燥,得到蓝莓叶黄酮粗提物。实验过程中按所需加蒸馏水充分搅拌溶解过滤,即得蓝莓叶提取液。
2.1.3 黄酮含量的测定
精密量取芦丁对照品溶液0.0、1.0、2.0、3.0、4.0、5.0mL,分别置于10mL容量瓶中,配制成梯度浓度的标准液。以NaNO2-Al(NO3)3-NaOH法进行测定[7-8]。在510 nm下测其吸光值,并绘制标准曲线。
移取供试品溶液1mL置于10mL容量瓶中,以NaNO2-Al(NO3)3-NaOH法进行测定,80%的乙醇定容作空白参比在510 nm下测吸光值,标准曲线的绘制项下的回归方程计算总黄酮的提取率。
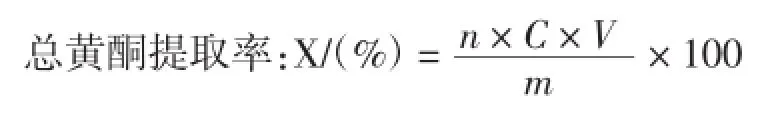
式中:n为稀释的倍数;C为总黄酮的浓度,(mg/mL);V为溶液的体积,mL;m为添加的原料质量,mg;X总黄酮的提取率;样品含量换算成mg/g表示。
2.1.4 树脂的筛选静态吸附
取5种处理好的大孔树脂各10 g,分别加入蓝莓叶提取溶液30mL,放置于室温摇床中,每10分钟分别取各树脂吸附后的溶液于510 nm处测定吸光度,计算室温下各种树脂对蓝莓叶黄酮的吸附量(mg/g)和吸附率(mg/g)[9]。

式中:Q为吸附量,(mg/g);C0为蓝莓叶提取液总黄酮初始浓度,(mg/mL);C1为吸附后溶液中剩余总黄酮浓度,(mg/mL);V为溶液体积,mL;m为树脂质量,g。
2.1.5 树脂的筛选静态解析
蓝莓叶提取溶液于510 nm下测定吸光值,作为初始值。利用大孔吸附树脂对其进行静态吸附,在一定时间内间隔固定时间取样测定。静态吸附后的树脂过滤纸上抽干。用60%乙醇作为解吸液,按照一定的比例添加。将其置于摇床中,在室温条件下进行解析,在间隔一定时间内取解吸液1m L,测定其510 nm处吸光值,计算各种树脂对蓝莓叶黄酮的解析率(%)。
2.2抗脂质过氧化能力的测定
将10mg/mL卵磷脂溶液1mL、0.4mmol/L硫酸亚铁1mL及1mL样品溶液依次加入到试管中并混匀。37℃水浴并进行避光处理60min,加入TCA-TBAHCl 2 mL混合液,95℃水浴15 min后立即冷却,以3 000 r/min的转速离心10m in,弃去沉淀,保留上清液,测定其在535 nm测吸光度(As)。空白管以1mL去离子水作为样品使用,测得空白管的吸光度(Ac),参比管中以1m L去离子水作为卵磷脂使用。并以抗坏血酸作为阳性的对照[10]。

以样品浓度为横坐标,对应的抑制率为纵坐标进行作图,通过得到的拟合方程计算出能够到达50%抑制率时所需要添加的样品浓度,其数值即半抑制浓度IC50值。
3 结果与讨论
3.1 大孔树脂的筛选
对蓝莓叶黄酮的静态吸附量和解析率是筛选大孔树脂的主要指标。表2为5种大孔吸附树脂对蓝莓叶中总黄酮的静态吸附及解吸性能结果。
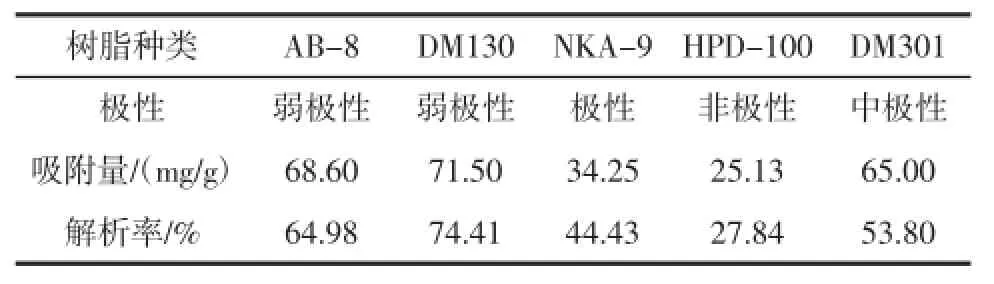
表2 吸附树脂对蓝莓叶黄酮的吸附率及吸附分离处理后黄酮含量(25℃)Table 2 Macroreticular resins absorption rate and flavonoids content in extracts
AB-8,DM130树脂解吸率较高,而DM130树脂解析率和吸附量都大于AB-8树脂。由于吸附是一个可逆的过程,吸附解吸是处于动态平衡当中的。由表2可看出,由于树脂极性不同,解吸的难易也不同。若树脂的静态吸附量大,则分离效果好;但若吸附过强,解析就会很难进行或者需要的条件苛刻,解析时间过长。因此做树脂的类型选择的时候,要结合吸附量和解吸率来选择树脂。因此选用DM130树脂纯化蓝莓叶总黄酮。
3.2 静态吸附动力学特性测定
对DM130大孔树脂的静态吸附动力学进行了研究,结果如图1所示。
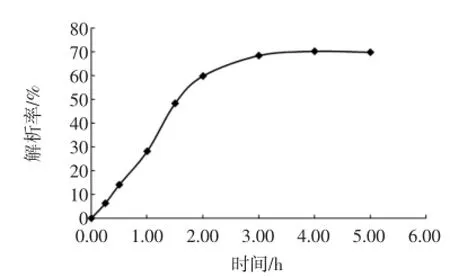
图1 DM 130静态吸附动力学曲线Fig.1 Kinetics curve of static adsorption of DM 130 macroporous resins
DM130树脂对蓝莓叶总黄酮的吸附为快速平衡型,即在起始阶段吸附量比较大,在4 h内基本接近达到平衡。DM130树脂对蓝莓叶总黄酮具有良好的静态吸附动力学特性,较适宜蓝莓叶总黄酮纯化。
3.3 DM130大孔吸附树脂纯化蓝莓叶总黄酮的工艺验证结果
综合以上实验结果,确定蓝莓叶总黄酮纯化工艺条件:取500mL质量浓度为300mg/mL的蓝莓叶黄酮溶液,准确称取经50 g预处理过的DM130树脂,在25℃下恒温振荡吸附4 h。以60%乙醇为洗脱剂,进行静态洗脱。按照此工艺条件,利用DM130大孔吸附树脂对蓝莓叶总黄酮分离纯化,进行重复试验,结果见表3。
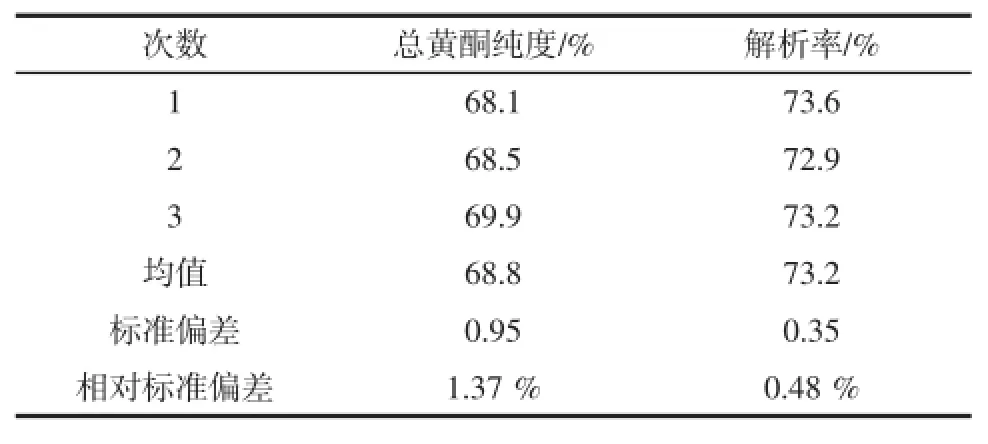
表3 蓝莓叶总黄酮的纯化Table3 Purifiction of total flavonoids
从表3中结果可知,重复实验的蓝莓叶总黄酮纯化纯度与解析率的相对标准偏差(RSD)分别为1.37%,0.48%,说明工艺重复性较好,较稳定,可用于蓝莓叶总黄酮的分离与纯化。
3.4 蓝莓叶总黄酮的抗脂质过氧化能力测定
蓝莓叶黄酮与抗坏血酸的抗脂质过氧化能力曲线如图2、图3所示。
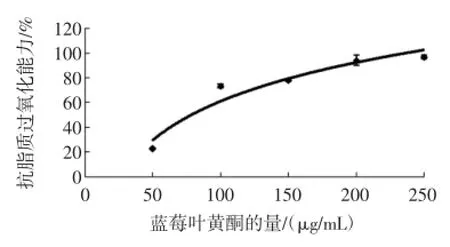
图2 蓝莓叶黄酮的量与其抗脂质过氧化能力关系(%)Fig.2 The capability of flavonoid from blueberry leaveson inhibiting lipid peroxidation

图3 抗血酸抗浓度与其抗脂质过氧化能力(%)Fig.3 The capability of ascorbic acid on inhibiting lip id peroxidation
图2中曲线表示蓝莓叶黄酮添加量与其抗脂质过氧化能力的关系,实验考查可知蓝莓叶黄酮从50μg/mL增加到250μg/mL的过程中,其抗脂质氧化能力不断提高。50μg/mL的蓝莓叶黄酮浓度条件下,其抑制率为22.78%,100μg/mL的蓝莓叶黄酮的浓度条件下,其抑制率增高73.35%,但是当蓝莓叶黄酮的浓度在此基础上继续增加时,其抑制率虽有所增长但很幅度不大。通过曲线拟合方程,算出其抗脂质过氧化能力IC50的值为78.46μg/m L。
图3中可以看出抗坏血酸浓度与其脂质体过氧化的抑制作用关系,通过计算得出抗坏血酸浓度对抗脂质过氧化能力差异显著(P<0.05),抑制率随其浓度的增加而增大。图2和图3比较计算可以得出,蓝莓叶黄酮抗脂质过氧化能力(IC5078.46μg/mL)明显优于抗坏血酸(IC505.56mg/m L)。
4 小结
利用大孔吸附树脂对蓝莓叶黄酮进行分离、纯化时,考察极性不同的树脂对蓝莓叶黄酮吸附性能的区别。实验结果表明DM-130弱极性树脂效果最好,其静态吸附量达到71.5mg/g,解析率达到74.41%。这是由于其静态吸附量为弱极性树脂更有利于对蓝莓叶黄酮的吸附,其具体表现为吸附量大,分离度好,而且解吸容易,得到的总黄酮含量高。蓝莓叶黄酮酚羟基和糖苷链含量较高,极性小,通过与树脂骨架分子形成氢键从而进行吸附和解吸;而DM130型的树脂孔径在0.90μm~1.00μm之间,蓝莓叶黄酮通过其网状结构可以更好的进行分离、纯化。利用DM130型的树脂纯化蓝莓叶黄酮的参数为:蓝莓叶黄酮上样量500m L,上样浓度为300mg/mL,预处理过的DM130树脂50 g,25℃下恒温振荡吸附4 h。以60%乙醇为洗脱剂,进行静态洗脱3 h。纯化后所得黄酮纯度达到68.8%。
以抗坏血酸为对照,测得蓝莓叶黄酮对脂质过氧化的半数抑制浓度(IC50)值为78.46μg/mL,明显高于抗坏血酸(IC50=5.56mg/mL),表明蓝莓叶黄酮具有很强的抗脂质过氧化能力。铁离子可以使脂质体发生氧化作用,其氧化过程中生成的过氧化物、自由基,会造成油脂氧化的进一步的氧化反应。黄酮类物质表现出的抗氧化活性,是通过与铁离子结合对其进行螯合以及对自由基清除的综合表现[11-12],所以表现出抗脂质过氧化能力高于抗坏血酸。
[1] 李春美,钟朝辉,窦宏亮,等.大孔树脂分离纯化柚皮黄酮的研究[J].农业工程学报,2006,22(3):153-157
[2]中国医学科学院药物研究所植化室.大孔吸附树脂在中草药化学成分提取分离中的一些应用[J].中草药,1980(3):138-141
[3]周桃英,罗登宏,李国庆,等.AB-8大孔树脂纯化荷叶总黄酮的工艺研究[J].中国食品添加剂,2009(5):113-119
[4]裴凌鹏,惠伯棣,金宗濂,等.黄酮类化合物的生理活性及其制备技术研究进展[J].食品科学,2004(25):203-207
[5] Skupien K,Oszmianski J,Kostrzewa-Nowak D,et al.In vitro antileukaemic activity of extracts from berry leaves against sensitive and multi-drug resistant HL60 cells[J].Cancer letters,2006(236): 281-291
[6] Chung H S,Chang L C,Lee S K,et al.Flavonoid constituents of Chorizanthediffusa with potential cancerchemopreventive activity[J].J Agric Food Chem,1999,47(1):36-41
[7]李艳提,赵金凤,张卫明,等.罗布麻茶总黄酮含量测定方法研究[J].食品安全与检测,2010,35(6):274-278
[8] 杨方明,韦史利,邬文力.蜜炙桑白皮总黄酮的含量测定方法[J].亚太传统医药,2011,7(6):22-24
[9]金莹,孙爱东.大孔树脂纯化苹果多酚的研究[J].食品科学,2007, 28(4):160-163
[10]张尔贤,俞丽君,周意林,等.Fe2+诱发脂蛋白PUFA过氧化体系及对若干天然产物抗氧化作用的评价[J].生物化学与生物物理学报,1996(28):218-292
[11]Leo M D,AbreuM,Pawlowska AM,et al.Profiling the chemical content of Opuntiaficus-indica flowers by HPLC-PDA-ESI-MS and GC/EIMS analyses[J].PhytocheLett,2010,3(1):48-52
[12]Cai WR,Gu XH,Tang J.Extracion,purification,and characerisation of the flavonoids from Opuntiamilpaalta skin[J].Czech J Food Sci, 2010,28(2):108-116
Study on and Anti-Lipid Peroxidation Activity of Total Flavonoids in Blueberry Leaves
ZHENG Hong-yan1,SU Ning1,HUO Tong2,ZHAO Dan2,WANG Chang-tao2,*,YANG Li1
(1.Chinese Academy of Inspection and Quarantine,Beijing 100123,China;2.School of Science,Beijing Technology and Business University,Beijing100048,China)
In this study,five kinds of macroporous adsorption resins was chosen to compare their ability of flavonoids purification.The static adsorption and desorption of flavonoids is the main evaluation index.The result shows that the DM-130 macroporous adsorption resins was the best with an adsorption capability of 71.5 mg/g and a desorption rate of 74.41%.The purity of total flavonoids reach to 68.8%.The anti-lipid peroxidation of total flavonoids in blueberry leaves was tested with vitamin C as reference.The IC50of anti-lipid peroxidation is78.46μg/mL,which is much better than vitamin C(5.56mg/mL).
total flavonoids;macroporous adsorption resins;purification;anti-lipid peroxidation
10.3969/j.issn.1005-6521.2015.03.008
2014-11-03
质检公益性行业科研专项项目(201310132);质检公益性行业科研专项项目(201410019)
郑洪艳(1976—),女(汉),工程师,硕士,研究方向:化妆品安全性、功效性评价研究。
*通信作者:王昌涛(1975—),男,教授,博士,研究方向:植物功效成分开发应用。

