紫苏分离蛋白酶解制备抗菌肽的工艺优化
姜文鑫,王晓飞,崔玲玉,闵伟红,*
(1.阿鲁科尔沁旗天山镇食品药品监督局,内蒙古赤峰025550;2.吉林农业大学食品科学与工程学院,吉林长春130118)
紫苏分离蛋白酶解制备抗菌肽的工艺优化
姜文鑫1,王晓飞2,崔玲玉2,闵伟红2,*
(1.阿鲁科尔沁旗天山镇食品药品监督局,内蒙古赤峰025550;2.吉林农业大学食品科学与工程学院,吉林长春130118)
以紫苏分离蛋白为原料,通过碱性蛋白酶(Alcalase)水解制备紫苏抗菌肽。以大肠杆菌为指示菌,在单因素试验基础上,运用响应面(RSM)法对水解条件进行优化,并研究了紫苏抗肽的广谱抗菌性、热稳定性和水解度与抑菌性的关系。结果显示:在加酶量6.89%、酶解温度52.68℃、底物浓度4.17%、pH 8.98,水解3 h的条件下,酶解产物RSM的理论预测值为19.33mm,实际测量值为19.40mm。广谱抗菌试验表明:紫苏抗菌肽对沙门氏菌、枯草芽孢杆菌和金黄色葡萄球菌均有抑制作用。水解度和抑菌性试验表明:抑菌性随水解度增加而增强,后趋于稳定。
紫苏;抗菌肽;响应面;酶解
抗菌肽是广泛存在于动植物体内一类小分子多肽,具有广谱抗菌性、耐热性、无免疫原性和对人体无毒副作用等特点[1-2],近年来越来越受到人们的重视。自1974年瑞典科学家Boman[3]等首次发现天蚕素,人们逐渐在细菌、真菌、植物、昆虫类、两栖类、禽类、和哺乳动物中相继发现具有类似功能的生物多肽,国内外的研究主要集中在微生物抗菌肽和动物抗菌肽,而对植物来源的抗菌肽则相对较少[1]。通过酶解植物蛋白制备抗菌肽具有成本低廉、来源广泛和工艺简单等特点[4]。
紫苏(Perilla Prutescens Linn,Britton)为生唇形科植物一年草本植物[5],是我国传统的药食两用植物。紫苏籽中的含油率高达45%左右[6],目前对紫苏籽的研究主要集中在紫苏籽油的开发利用,而对油料副产物紫苏籽粕用于饲料或直接丢弃,为提高紫苏资源的利用价值,本研究以脱脂紫苏粕提取的分离蛋白为原料,水解得到具有抑菌活性的多肽,并研究其广谱抗菌性等理化性质、水解度与抗菌性的关系,为紫苏资源的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
紫苏粕:由敦化广晟生物油脂有限公司。菌种:吉林农业大学食品科学与工程学院发酵工程实验室。Alcalase 2.4L蛋白酶:FGNovozymes公司;其余试剂均为国产分析纯。
1.2 仪器与设备
EF-20型实验室pH计:瑞士梅特勒-托利多集团;Z36HK高速冷冻离心机:德国HERMLE公司;CL-32L高压蒸汽灭菌器:日本ALP;GNP-9080培养箱:上海精宏实验设备有限公司;振HZQ-F160荡培养箱:哈尔滨东联电子技术开发有限公司。
1.3 方法
1.3.1 紫苏分离蛋白的制备
紫苏分离蛋白通过碱溶酸沉法制备[6]。
1.3.2 紫苏抑菌肽的制备
取适量蛋白液放入90℃水浴中加热15min,水浴冷却后调节pH,按一定体积质量比加入Alcalase蛋白酶,在一定温度的水浴条件酶解3 h,用NaOH溶液维持初始pH,90℃灭酶15min,水浴冷却,5 000 r/min离心10min,取上清液进行冷冻干燥,4℃保存备用。
1.3.3 抑菌活性的测定
采用琼脂孔穴扩散法[6-7]。
1.3.4 响应面试验设计
根据Box-Behnken中心组合设计原理[8],进行响应面试验,试验设计编码表见表1。
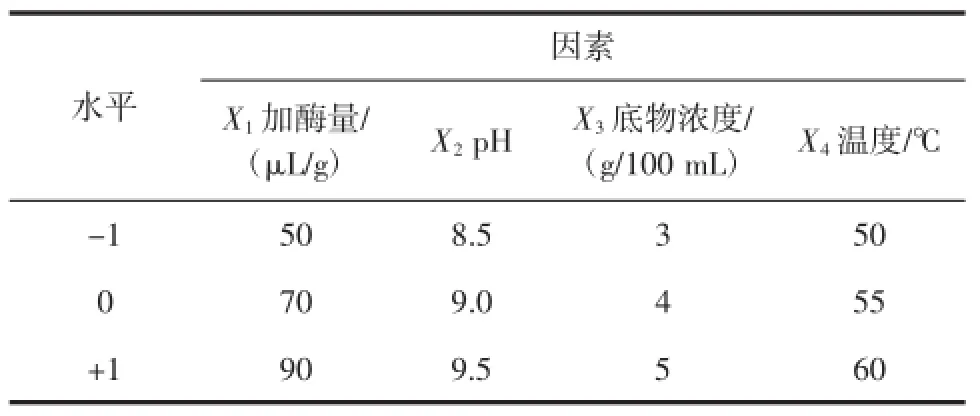
表1 响应面中心设计法各因素编码值和实际值Table1 The factors code value and actual value of center design of the response surface method
1.3.5 水解度与抑菌性的关系
在响应面优化的基础上,采用最佳酶解条件对紫苏分离蛋白进行酶解,研究水解度和抑菌性的关系[9-10]。pH-star法进行测定[11]。
1.3.6 加热时间和冻融次数对紫苏抑菌肽稳定性的影响
参照宋茹[11]方法进行。
1.3.7 紫苏抑菌肽在不同pH条件的抑菌活性
不同pH条件的抑菌活性参照Mason[12]方法进行。
1.3.8 紫苏抑菌肽的广谱抑菌性
参照Das[13]方法进行。
1.4 数据用origin 7.5和Design-Expert8.0进行分析,所有试验为3个平行。
2 结果与分析
2.1 响应面优化试验结果
2.1.1 响应面试验结果及显著性分析
响应面试验结果及显著性分析如表2、表3。

表2 Box-Behnken中心组合设计方案及结果Table2 The Box–Behnken design for optimizing hydrolysis conditions with antibacterial zone length(mm)
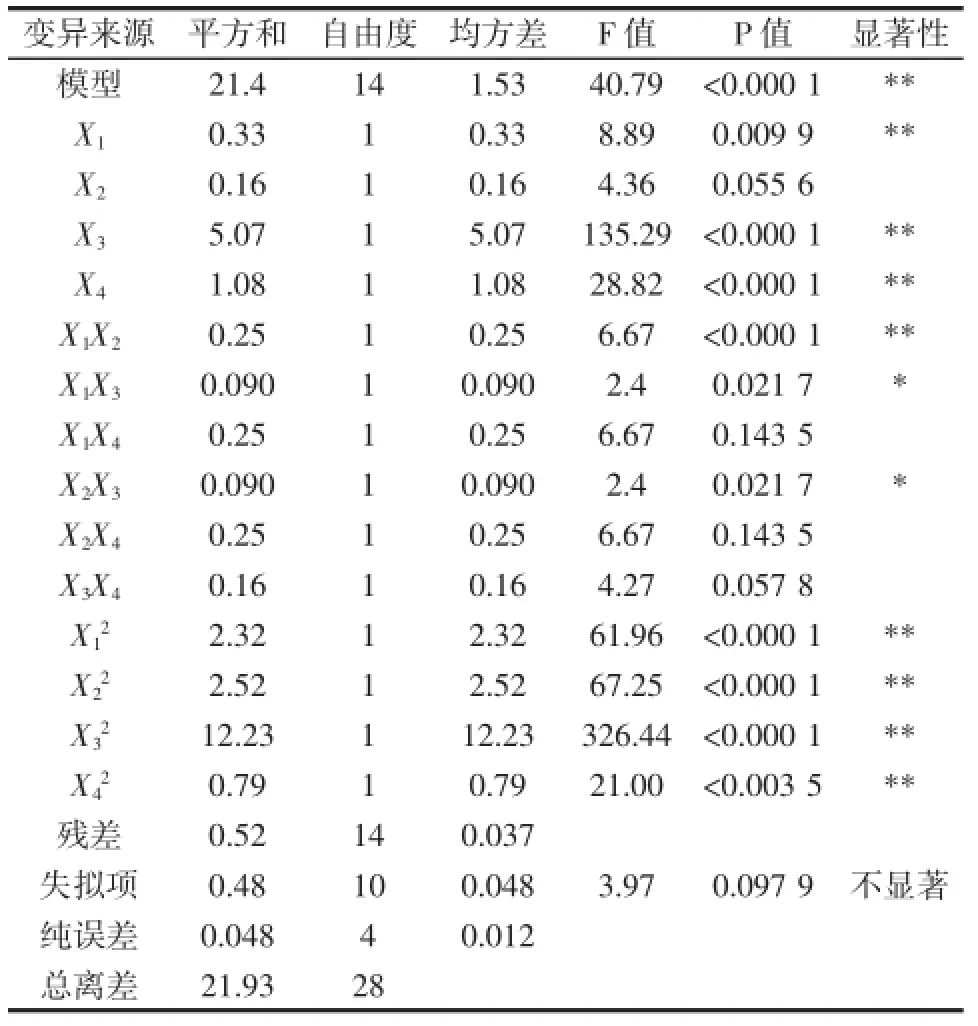
表3 回归模型显著性检验及方差分析Table3 Analysis of variance for the fitted quadratic regression model
运用Design-Expert8.0.6.1软件对结果进行分析,得抗菌肽抑菌直径的二次多元回归方程为:

去掉不显著的一次项X2、和二次项X1X4、X2X4、X3X4后最终为:
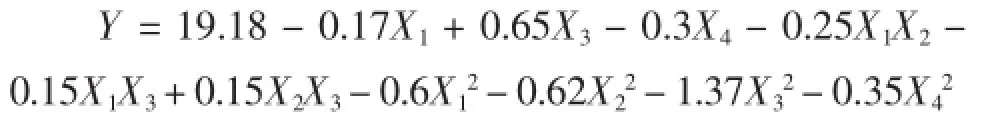
由表3可知,决定系数R2为0.976 1,模型可以预测97.61%的响应值变化,模型显著性检验极显著(P< 0.000 1),模型失拟项不显著(P=0.097 6),说明模型拟合度较好,试验误差较小,可以用此模型对紫苏多肽的抑菌率的响应值进行分析和预测[14]。各因素对抑菌性结果影响大小的顺序为:底物浓度>酶解温度>加酶量>pH。
2.1.2 显著性交互作用影响分析
各因素交互作用影响还原能力结果如图1所示。从图中可以直观地反映各因素对响应值的影响,找出最佳工艺参数以及各参数之间的相互作用。

图1 各因素交互作用影响还原能力的响应面图Fig.1 Response surface of mutual influence on the reducing power ability
2.1.3 验证试验
验证试验效果图见图2。

图2 响应面优化后的紫苏抑菌肽抑菌效果图Fig.2 After the response surface optimization of Perilla antibacterial picture
根据Design-Expert8.0.6.1软件的分析,得出紫苏蛋白水解抑菌肽的最佳工艺条件为:加酶量68.96μL/g、pH 8.93、底物浓度4.2 g/100mL、酶解温度52.98℃,在此条件下得到的抑菌圈直径预测值为19.318 9mm。结合实际条件,选择加酶量为69μL/g、pH 8.93、底物浓度4.2 g/100mL、酶解温度53℃,图2为此条件下的抑菌效果图,得到的抑菌圈直径为(19.6±1.1)mm与理论预测值19.3mm无显著性差异(0.05﹤P),表明试验所得模型可以用于预测实际值。
2.2 水解度与抑菌性的关系
水解度与抑菌性的关系如图3。

图3 水解度与抑菌性的关系Fig.3 The relation between degree of hydrolysis and bacteriostasis
如图3所示,在响应面优化后的最佳工艺条件下,随着水解时间的增加,紫苏蛋白的水解度逐渐增加,抑菌逐渐增大。这一结果表明紫苏抑菌肽至少在水解7 h的时间内,抑菌性和水解度成正相关关系。与水解度趋势不同的是,在水解180min后,紫苏抑菌肽的抑菌性增加速度趋于缓慢,这可能是因为随着酶解反应的进行,蛋白质分子被酶不断水解成较小肽链,而根据以往的报道,抗菌肽一般为12个~100个氨基酸残基的肽链,所以随着酶解的进行,紫苏抑菌肽的抗菌效果逐渐增大,然而当酶解继续进行时,抗菌肽可能被进一步水解成更小的寡肽或氨基酸,抑菌性效果增速降低[15]。
2.3 紫苏抑菌肽在不同pH条件下的抑菌效果
紫苏抑菌肽在不同pH条件下的抑菌效果见图4。
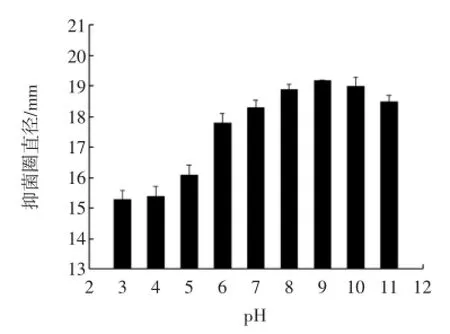
图4 pH条件与抑菌性的关系Fig.4 The relation between degree of hydrolysis and bacteriostasis
图4显示了紫苏抑菌肽在pH 3~11的范围内抑菌效果对比,由图可知无论在大于或小于pH 9.0的条件下,紫苏抑菌肽的抑菌效果都逐渐下降,与之前宋茹报道的有所不同[16],这可能是因为紫苏抑菌肽是在pH 8和9的条件下水解得到的,偏离这pH 8和9时对紫苏抑菌肽的结构和周围电荷都有很大的影响,进而影响了紫苏抑菌肽的抑菌性。值得一提的是在pH 6.0后紫苏抑菌肽的抑菌性急剧下降,这可能是因为紫苏抑菌肽的等电点在pH 5.0左右[4],在等电点时紫苏抑菌肽的溶解性最低,进而导致了抑菌效果的下降。
2.4 紫苏抑菌肽的广谱抑菌性
紫苏抑菌肽的广谱抑菌性效果见图5。
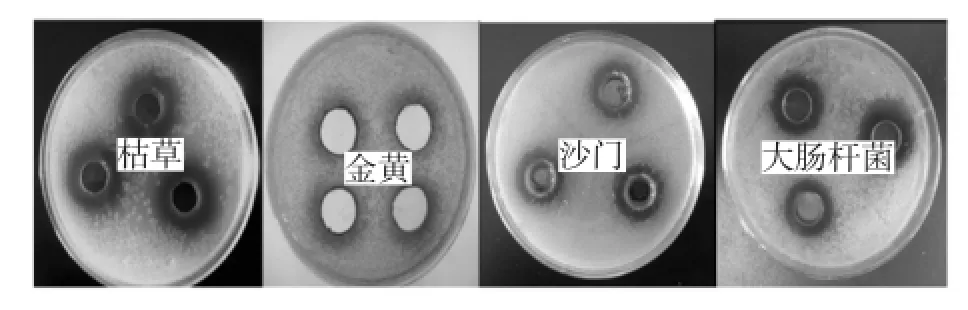
图5 紫苏抑菌肽分别对枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌的抑制效果图Fig.5 Perilla antibacterial peptide of bacillus subtilis,staphylococcus aureus,salmonella inhibitory effect
由图5可知,紫苏对革兰氏阳性菌金黄色葡萄球菌和枯草芽孢杆菌,以及革兰氏阴性菌大肠杆菌和鼠伤寒沙门菌的生长均具有抑制作用,这表明利用Alcalase对紫苏分离蛋白在一定条件下水解所得到的多肽具有广谱抑菌性。
3 结论
在本试验中,以大肠杆菌为指示菌,利用Alcalase对紫苏分离蛋白进行水解,分别对加酶量、酶解pH、底物浓度和酶解温度进行考察,在单因素试验的基础上根据Box-Behnken中心组合设计原理,进一步对酶解条件进行响应面优化,得出最佳工艺为:加酶量69μL/g、pH 8.93、底物浓度4.2 g/100mL、酶解温度53℃,在此条件下的到紫苏抑菌肽抑菌能力和水解度成正相关性关系,对革兰氏阴性菌大肠杆菌和鼠伤寒沙门菌,革兰氏阳性菌金黄色葡萄球菌和枯草芽孢杆菌的生长均具有抑制作用,具有广谱抑菌性,并且在pH9.0左右的抑菌能力最强。紫苏抑菌肽作为一种潜在的抑菌肽来源在未来的实际应用中具有很大的潜力。
[1] Li Y,Xiang Q,Zhang Q,et al.Overview on the recent study of antimicrobial peptides:origins,functions,relative mechanisms and application[J].Peptides,2012,37(2):207-215
[2] Zasloff M.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(6870):389-395
[3]Boman H G,Nilsson-Faye I,Paul K,et al.Insect immunity I.Characteristics of an inducible cell-free antibacterial reaction in hemolymph of Samia cynthia pupae[J].Infection and Immunity, 1974,10(1):136-145
[4] Roy F,Boye J,Simpson B.Bioactive proteins and peptides in pulse crops:Pea,chickpea and lentil[J].Food Research International,2010, 43(2):432-442
[5] 盛彩虹,刘晔,刘大川,等.紫苏分离蛋白功能性研究[J].食品科学,2011,32(17):137-140
[6]孙长江,张建新,汪璇,等.响应面法优化黄粉虫抗菌肽酶解工艺[J].食品科学,2013,34(7):234-239
[7]苏翔,崔敬爱,陈晓平.蚂蚁抗菌肽的分离纯化及其活性[J].食品科学,2013,34(9):70-73
[8] Tan Y,Ayob M,Osman M,et al.Antibacterial activity of different degree of hydrolysis of palm kernel expeller peptides against sporeforming and non-spore-forming bacteria[J].Letters in applied microbiology,2011,53(5):509-517
[9] Tironi V A,Añón M C.Amaranth proteins as a source of antioxidant peptides:Effect of proteolysis[J].Food Research International,2010, 43(1):315-322
[10]李桂峰,赵国建,肖春玲,等.金针菇蛋白酶解制备抑菌肽的工艺优化及功能评价[J].中国食品学报,2012,12(10):107-112
[11]宋茹.黄鲫(Setipinnataty)蛋白抗菌肽的制备及抗菌作用等生物活性研究[D].青岛:中国海洋大学,2011
[12]Mason A J,Gasnier C,Kichler A,et al.Enhanced membrane disruption and antibiotic action against pathogenic bacteria by designed histidine-rich peptides at acidic pH[J].Antimicrobial agents and chemotherapy,2006,50(10):3305-3311
[13]Das R,Dutta A,BhattacharjeeC.Preparation ofsesame peptide and evaluation of antibacterial activity on typical pathogens[J].Food Chemistry,2012,131(4):1504-1509
[14]黄群,杨万根,余佶,等.杜仲籽粕蛋白酶解制备抗氧化肽工艺优化[J].食品科学,2013,34(17):205-209
[15]龚吉军,李振华,李忠海,等.响应曲面法优化油茶粕抗菌肽制备条件[J].中国食品学报,2012,12(9):137-143
[16]aštagŽ,Popovic L,Popovic S,et al.Hydrolysis of pumpkin oil cake protein isolate and free radical scavenging activity of hydrolysates: Influence of temperature,enzyme/substrate ratio and time[J].Food and Bioproducts Processing,2010,88(2):277-282
Enzymatic Preparation Optimization of Antimicrobial Peptides from Perilla Protein Isolate
JIANG Wen-xin1,WANG Xiao-fei2,CUI Ling-yu2,MIN Wei-hong2,*
(1.Food and Drug Administration of Tian Shan Town Ar Horqin Banner,Chifeng025550,Inner Mongolia,China;2.College of Food Science and Engineering,Jilin Agricultural University,Changchun 130118,Jilin,China)
In this experiment,perilla seed protein isolate as raw material,through alkaline protease(Alcalase)was prepared by hydrolysis of Perilla antibacterial peptide.Using Escherichia colias indicator bacteria,based on single factor experiments,using response surface (RSM)to optimize the hydrolysis method,we study the relationship between the Perilla antipeptide antibacterial property,thermal stability and hydrolytic degree and bacteriostasis.Results:in 6.89%of the amount of enzyme,hydrolysis temperature 52.68℃,substrate concentration 4.17%,pH 8.98,3h hydrolysis conditions,prediction theory of enzymatic hydrolysate of RSM valuewas19.33mm,the actual measured value is19.40mm.Antibacterial tests showed that:perilla inhibition effects of antibacterial peptides on Salmonella,bacillus and Staphylococcus aureus were.Show that the degree of hydrolysis and the Bacteriostatic Experiment:the antibacterial activity was increased with the increasing degree of hydrolysis,then tended to be stable.
Perilla;antibacterial peptide;response surface;enzymatic hydrolysis
10.3969/j.issn.1005-6521.2015.03.035
2014-11-16
姜文鑫(1988—),男(汉),硕士研究生,研究方向:发酵工程。
*通信作者:闵伟红(1971—),女,教授,博士,研究方向:发酵工程、粮油科学与深加工技术。

