工业微生物酸胁迫的耐受机制及改造途径
郝小明,陈博,安泰
工业微生物酸胁迫的耐受机制及改造途径
郝小明1,2,陈博1,2,安泰1,2
1 中粮营养健康研究院有限公司,北京 102209 2 国家能源生物液体燃料研发 (实验) 中心,北京 100020

郝小明, 陈博, 安泰. 工业微生物酸胁迫的耐受机制及改造途径. 生物工程学报, 2015, 31(8): 1151–1161.Hao XM, Chen B, An T. Pathway modification of industrial microorganisms to improve acid-stress tolerance. Chin J Biotech, 2015, 31(8): 1151–1161.
工业微生物在发酵生产过程中会面对发酵环境和自身产生的各类酸性物质,而这些酸性物质会影响工业微生物的生长和代谢,即产生酸胁迫。微生物通过调控胞内质子浓度、保护和修复生物大分子、改变细胞膜组分以及整体水平调控等耐受机制来应对酸胁迫。结合酸胁迫的各种耐受机制,利用自然筛选和人工改造的方法提高工业微生物的抗酸胁迫能力,为构建出更能适应工业生产条件的菌株提供理论依据。
工业微生物,酸胁迫,耐受机制,改造途径,菌株改造
随着科学技术的发展,利用可再生的生物质资源进行生物燃料以及各种化学和材料产品的生产已经成为生物产业的重要组成部分。生物发酵产业2013年全年的产品总产量2 424万t,2013年总产值接近3 000亿元。其中,氨基酸产量400万t,有机酸产量158万t,淀粉糖产量1 225万t,多元醇产量157万t,酶制剂产量110万t,酵母产量29.4万t,功能发酵产品 310万t[1]。当今中国以氨基酸、有机酸为代表的大宗发酵产品产能位列世界前茅,同时,生物发酵产业面临着产能过剩、能耗高、产出低等一些亟待解决的问题。
在工业发酵条件下,微生物面临着诸多生理或非生理逆境胁迫,如高温胁迫[2-4]、酸环境胁迫[5-7]、抑制物胁迫[8]、高渗胁迫[8]和氧化胁迫[9]等。为了维持适应微生物发酵的生产环境,常通过添加中和剂、冷却等手段进行调节,因此在生产过程中会产生高渗环境或增加能耗。例如,有机酸、氨基酸在生产过程中会引起不利于细胞生长与维持正常代谢活性的酸性环境,为了维持生产条件的稳定性,通常需要应用外源中和剂实施pH干预,工业生产中会通过补加氨水、液氨等碱性物质将pH控制在适合的范围。发酵结束后,为了便于提取氨基酸、有机酸产品,又会加入浓硫酸等使发酵液pH降低至pH 3.5甚至更低。若将氨基酸或有机酸生产菌株的耐酸胁迫能力提高,使得发酵过程在酸性环境下进行,则能显著降低发酵过程和产品分离过程中酸和碱的使用,同时由于生产菌株酸耐受性的增加,最终产量还有可能得到进一步提高。以丁二酸发酵为例,若将pH由中性7.0降低为5.5左右,则可节约1/3碱使用量,在分离过程中进一步节约1/3酸使用量[10]。此外,维持发酵pH在较低的值还有助于抑制杂菌污染。因此,通过提高工业微生物自身的环境胁迫耐受性,可保证在胁迫条件下良好的细胞活性,可在提高生产效率的同时降低能耗,减少污染物的排放,实现建设资源节约型和环境友好型的产业目标。
各类酸性物质会影响工业微生物的生长和代谢,引起细胞膜解偶联,抑制细胞内酶的活性水平,并且会影响核糖体RNA和DNA的功能[5]。因此利用微生物对酸胁迫产生的各种耐受机制来提高微生物的酸耐受水平则显得尤为重要。本文在综述工业微生物酸胁迫的各种耐受机制的基础上,从自然筛选和人工改造的角度出发,阐述提高微生物菌株抗酸胁迫的一些改造方法,探讨工业微生物抗逆改造的发展方向。
1 酸胁迫的种类和影响
各种类型的酸类物质通过被动运输或主动运输的方式在细胞内外进行转运。当酸积累量超过一定限度时,即会产生酸胁迫。酸胁迫通过影响胞内外质子和阴离子的浓度对细胞膜、核糖体RNA和DNA、活性酶类产生破坏作用,从而影响微生物正常的生长和代谢过程。
1.1 酸胁迫的种类及转运方式
1.1.1 酸胁迫的种类
工业微生物在有氧和厌氧发酵生产过程中会面对各种类型的酸类物质,包括发酵环境和自身产生的一些酸类物质,有乙酸、甲酸、乳酸、酪酸、柠檬酸、苹果酸、延胡索酸、琥珀酸、氨基酸 (例如天冬氨酸和谷氨酸)、丙酸,还包括外部添加的一些酸类物质,如作为防腐剂的苯甲酸、山梨酸等。
1.1.2 酸类物质转运方式
酸类物质的转运一般有两种方式:非能量依赖的被动运输和能量依赖的主动运输[11]。在被动运输过程中,主要通过自由扩散或者在转运蛋白的帮助下运输未解离的酸类物质。在主动运输过程中,细胞会利用分子泵和通透酶对酸类物质进行运输。分子泵一般用于酸根离子在应激反应条件下进行外排,而通透酶用于将酸类物质在代谢过程中转运至胞内。
1.2 酸胁迫对微生物细胞的影响
1.2.1 酸胁迫产生的原因
在生物发酵过程中,酸性物质的过量积累会导致胞内质子和阴离子的积累,从而产生毒性作用[12]。酸性物质以未解离的分子形式通过扩散作用进入胞内,当其进入细胞后会迅速发生解离,释放出质子。在细胞膜表面的腺苷三磷酸酶ATPase帮助下,消耗ATP的同时利用质子泵将质子泵出胞外,同时通过主动运输将酸根离子泵出胞外。随着酸性物质的逐渐积累达到高浓度时,质子泵达到最大限度,导致胞内质子积累。同时,ATP被消耗殆尽,扩散进细胞内的酸根离子因无法主动运输至胞外,导致在细胞内的积累。
1.2.2 酸胁迫的危害
酸胁迫在细胞层面通过以下3个方面对微生物产生影响。首先,由于跨膜ΔpH的减少导致跨膜质子动力势ΔP的降低,从而使细胞膜发生解偶联[13];其次,胞内过多质子的积累所引起的脱嘌呤作用会导致DNA损伤,从低pH条件下培养的大肠杆菌提取的基因组中发现有更多链的断裂[14];此外,由于胞内pH的降低,细胞内在正常pH条件下才具有活性的酶会受到严重的影响。因此,酸胁迫会导致微生物生长和代谢受到抑制。
2 酸胁迫的耐受机制
不同的微生物在长期的进化过程中形成了自身面对酸胁迫的各种耐受机制,主要包括利用F1F0-ATP酶和分子外排泵将质子或酸类物质排出细胞外、通过消耗质子和生成氨类物质来减少胞内质子、修复和防止酸类物质对生物大分子的伤害、改变细胞壁和细胞膜对质子的通透性以及在整体水平上的系统调控等方法。对主要工业微生物耐酸机制的举例如表1[5-7]所示。
面对不同的酸类物质,微生物也会采用不同的耐受机制。当面对强酸时,微生物会通过内部的缓冲作用和离子流快速调整胞内pH,一些在转录水平的调控在强酸环境下无法作出快速响应。而微生物面对弱酸时,由于弱酸的解离速度低于强酸,其耐受机制更为复杂。不同的弱酸的特定理化性质及周围环境的pH会对不同的微生物产生复杂的效果[6]。例如对于氨基酸产生的酸胁迫,大肠杆菌一般通过脱羧或脱氨基的方法降低胞内质子浓度[17-20]。在乳酸菌中利用乳酸-苹果酸反向转运蛋白可以将乳酸从胞内泵出胞外[34]。而对酵母乙酸耐受的机制研究发现,其在乙酸转运、细胞壁重构、转录因子调控等方面均有相应的调控机制[35]。
总体而言,微生物通常会通过以下几种方式对酸胁迫产生一定的耐受效果。
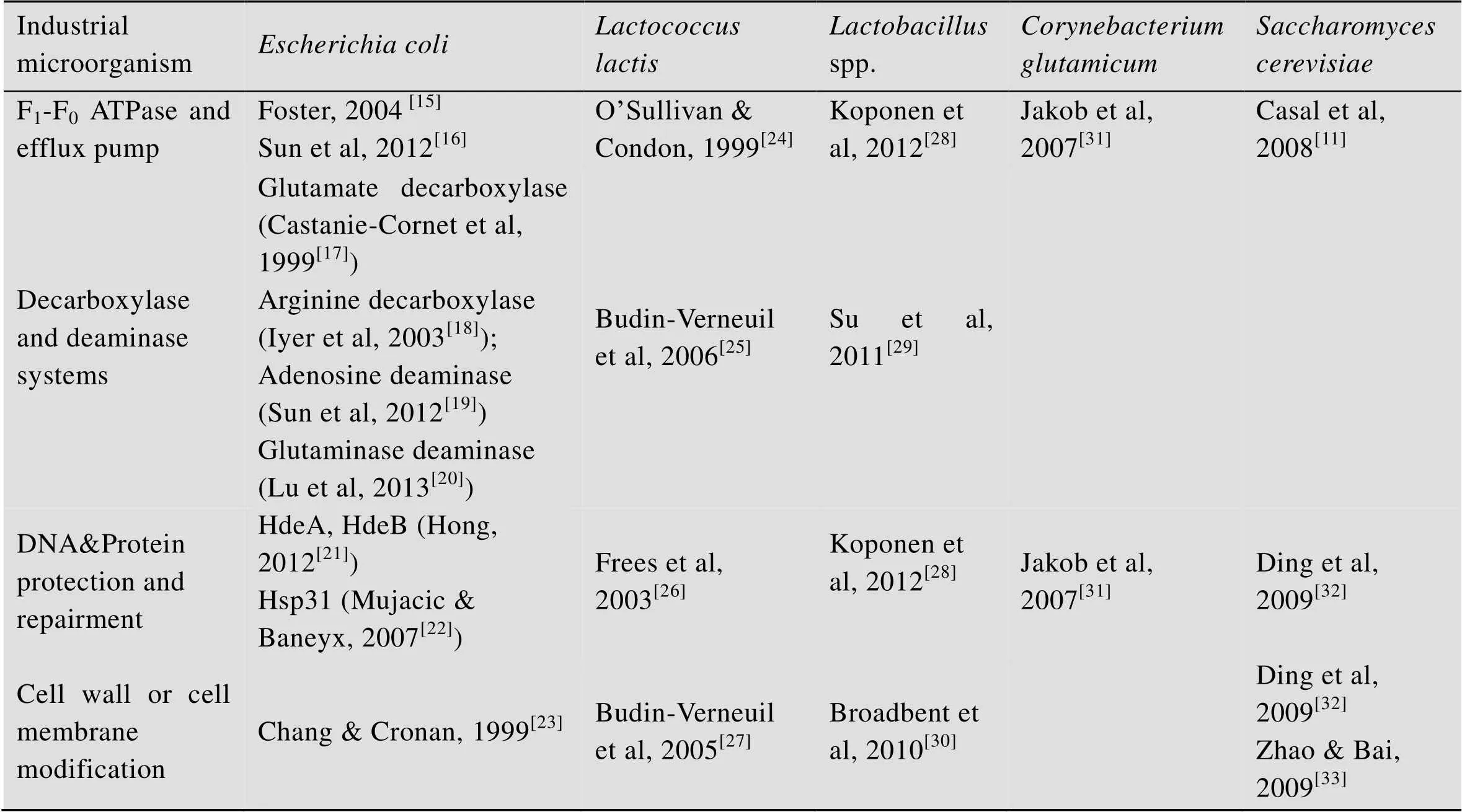
表1 主要工业微生物的耐酸机制[5-7]
2.1 F1F0-ATP酶和分子外排泵
催化ATP生成和水解的酶是一种多蛋白复合体,称为ATP合成酶。ATP合成酶包含2个不同的部分:球状的F1头部和包埋在内膜中的F0基部。F1F0-ATP酶能通过水解ATP提供的能量将细胞内的质子泵出胞外,以维持pH平衡。研究发现,在pH 2.5的酸性环境中,敲除F1F0-ATP基因会降低大肠杆菌的生存水平[16]。
微生物通过分子外排泵可以将胞内的化学物质排至胞外空间并保护细胞免受这些化学物质的影响。各种类型的分子外排泵需要来自ATP提供的能量和离子产生的电化学梯度作为外排动力。分子外排泵一般由膜外排蛋白、膜融合蛋白 (Membrane fusion protein,MFP) 和外膜通道蛋白(Outer membrane protein,OMP) 三部分组成[36]。分子外排泵在维持微生物胞内pH的稳定中发挥重要作用。例如,大肠杆菌中的四碳二羧酸转运蛋白DctA和Dcu可以协助对琥珀酸和柠檬酸进行摄入和外排作用[37-38]。在酿酒酵母中,羧酸分子外排泵Pdr12p对一元羧酸具有耐受作用。此外,Pdr12p还对亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸和色氨酸这些代谢得到的酸类物质具有耐受作用[39]。
2.2 脱羧反应和脱氨基反应
氨基酸脱羧酶在消耗质子的同时,使谷氨酸、赖氨酸、精氨酸和鸟氨酸进行脱羧反应。每一种氨基酸脱羧酶会与识别它的反向转运体相结合,在外界pH降低到阈值以下被激活,不同的氨基酸底物在不同的pH条件下会产生不同的脱羧后产物[40]。
微生物通过脱氨基产生的氨与质子结合形成铵离子来提高胞内的pH水平。精氨酸脱亚胺酶系统一般由精氨酸脱亚胺酶(ADI)、鸟氨酸氨甲酰转移酶 (OTC)、氨甲酰磷酸激酶 (CK) 所组成,这些酶均在pH 3.1或更低的pH条件下具有活性。该系统能催化精氨酸转化为鸟氨酸、二氧化碳和氨,并且产生的ATP还可以用于F1F0-ATP酶对胞浆质子的外排。此外,谷氨酰胺酶和腺苷脱氨酶也在大肠杆菌的酸胁迫过程中利用类似的机制发挥耐酸作用[19-20]。
2.3 保护和修复大分子
蛋白质大分子暴露在酸性环境下会导致细胞内受损蛋白质的积累,微生物会利用热休克蛋白进行应对。热休克蛋白是帮助蛋白正确折叠和修复损伤蛋白的分子伴侣。在革兰氏阴性菌大肠杆菌中,热休克蛋白可以分为DnaK (Hsp70)、DnaJ (Hsp40)、GrpE、GroEL (Hsp60)、GroES (Hsp10)和Clp (Hsp100)[41]。而在革兰氏阳性菌枯草芽胞杆菌中,热休克蛋白主要包括和操纵子编码的基因、σB因子调控的基因[42]等。
在正常条件下,热休克蛋白可以对蛋白进行折叠、跨膜转运蛋白、组装和分解寡聚蛋白或者帮助降解不稳定的蛋白防止蛋白聚集。然而在压力刺激下,热休克蛋白也可防止蛋白聚集并协助修复受损蛋白[43]。面对酸性刺激,微生物会通过胞浆中DnaK和GroEL进行应 对[44-45]。此外,一些微生物会通过介导Clp蛋白酶复合物来去除受损的蛋白质[46]。
2.4 改变细胞壁和细胞膜组分
微生物通过改变细胞壁和细胞膜组成来调控细胞的通透性或流动性从而抵抗酸胁迫。在酿酒酵母中,构成细胞壁组分和影响其相关功能的基因如和,如果敲除会分别影响酵母菌株对乙酸和乳酸的耐受能力,说明细胞对不同有机酸的响应存在一定差异。细胞壁的合成能阻止一些酸性物质扩散进入细胞,推测在酸胁迫条件下细胞壁出现重构,与细胞壁合成的相关基因及结构蛋白会发生改变[35]。大肠杆菌通过降低不饱和脂肪酸的浓度并提高环丙烷脂肪酸的浓度来改变细胞膜的组分。此外,结合在外膜孔道蛋白的多磷酸盐或五甲烯二胺也可以降低质子流的形成[40]。而乳酸菌一般会通过增加膜脂的不饱和度和碳链长度来应对酸胁迫[7]。
2.5 整体水平调控
目前,通过“组学”技术 (基因组学、转录组学、蛋白质组学、代谢组学) 对酸胁迫的响应机制的研究越来越多,其在表型表征中发挥的作用也越来越重要[47]。通过整体水平调控的研究,可以全面了解菌株整体上协同的耐酸机制,同时也可以深入了解酸胁迫对于菌株转录与调控的影响及对应表型发生的变化。
在大肠杆菌对乙酸和丙酸耐受反应的基因芯片分析中发现,一些介导趋化现象和鞭毛运动相关的基因表达水平上调,而对碳源摄取和利用的相关基因表达水平下降,说明正常代谢受到酸胁迫影响,此外一些应对压力反应的相关基因表达水平也有所提高。对丙酸的耐受反应中还发现,苏氨酸和异亮氨酸生物合成途径中的相关基因表达水平也有所上调[48]。在另外一个对于大肠杆菌酸耐受的研究中还发现,氨基酸脱羧、甘油转运子、渗透压反应、铁调控子、氧化胁迫反应、琥珀酸脱氢酶等相关基因表达水平均有所提高[49]。
对于谷氨酸棒杆菌耐受乳酸的基因芯片和基因敲除实验发现在酸胁迫过程中σB因子和σE因子的重要作用:σB因子基因敲除后降低了菌株的酸耐受性,而σE因子基因敲除后可以提高酸耐受性。此外,通过基因芯片数据还发现铁转运蛋白、碳代谢和呼吸代谢通路以及DNA损伤修复的重要基因的表达水平均有所上调[31]。
3 微生物酸胁迫的改造途径
3.1 自然菌株的筛选
目前,工业用发酵菌株仅占自然界中菌株的一小部分。因此,从自然界中筛选到可应用于工业生产的菌株仍然是一种潜在的途径与手段。在酸胁迫方面,一种途径是寻找可以利用于工业生产的嗜酸性菌株[50]。另一种途径是从“污染的”菌株中寻找具有较强抗酸性能的菌株。在特定发酵环境周围的“杂菌”具有更强的环境胁迫抵抗能力。例如,在巴西的一项长达12年对350种不同酿酒酵母菌株筛选实验中发现,一些来自发酵环境的菌株具有更好的生长优势和耐受效果,在以甘蔗为原料进行乙醇生产的工厂中分离的一株酿酒酵母PE-2与一株商业化酵母菌株CEN.PK113-7D相比,可以在含有 105 mmol/L 乙酸的pH小于3的培养条件下具有更好的酸耐受效果[51-52]。
3.2 菌株的改造途径
3.2.1 传统菌株改造途径
传统的菌株改造途径包括诱变育种、驯化、杂交、原生质体融合等[53]。这些传统育种手段共同的特点是通过基因组的随机突变或随机重组,以酸胁迫作为筛选手段,最终获得酸耐受性提高的菌株。运用传统菌株改造方法,虽然改造过程的随机性较大,筛选过程费时费力,但是菌株一般是通过提升了酸胁迫的某种耐受机制而达到抗酸水平提高的效果。例如Almario等利用驯化逐步提高乙酸、糠醛等抑制剂的浓度,使菌株在乙酸中的存活率提高12%[54],通过进一步分析发现细胞壁、脂类代谢和ATP酶相关基因表达水平均有所提高,说明参与ATP合成的相关酶类以及构建细胞壁、细胞膜组成的蛋白在驯化的过程中发生了改变。
3.2.2 基因工程和代谢工程改造
近年来,随着对各类微生物耐酸胁迫机制研究的深入,通过基因工程、代谢工程等技术手段改造工业微生物得到了快速的发展,结合微生物的酸胁迫的耐受机制,通过过表达或敲除与酸耐受机制相关的关键基因,使菌株的耐酸水平得到一定水平的提高。如表2所示,例如Abdullah等利用热休克蛋白对蛋白保护和修复的机制,在乳酸菌NZ9000中异源表达大肠杆菌的dnaK蛋白,提高了其对乳酸的耐受水 平[56]。又如,Zhang等利用细胞膜组分改变对酸胁迫的影响,通过插入基因破坏水-甘油跨膜通道蛋白编码的基因,使改造菌株与对照菌株相比,在乙酸耐受水平和乙醇产量上均有所提高[57]。Wei等通过在酿酒酵母SR8菌株中引入乙酸降解通路和木糖还原酶-木酮糖脱氢酶通路,使酿酒酵母可以同时利用木糖和乙酸代谢产生乙醇,从代谢通路和整体水平调控的角度降低乙酸对酿酒酵母的毒性[59]。

表2 利用工业微生物耐酸机制进行的人工改造
3.2.3 系统生物学和合成生物学改造
利用简单的基因工程和代谢工程操作对于多基因决定的性状难以实现理想的效果,此外仅过表达或敲除某几个基因可能引起代谢网络的紊乱[60]。因此,利用系统生物学和合成生物学的方法,从整体水平对生物系统进行系统的定量和定性分析,以序列模块化和元件化进行组装的设计思路,并且结合耐酸胁迫的几种耐受机制入手,从整体水平对工业微生物进行系统而程序化的改造将是未来发展的方向与重点。
目前国内外有多个研究小组已着手将来源于不同微生物的、能够响应酸胁迫的调控元件和能够提高抗酸性能的功能元件加以整理归纳,通过人工设计构建成抗酸器件,利用系统生物学的技术方法在模式底盘微生物和工业底盘微生物中进行抗酸性能、底盘适应性等评估,最终形成标准化的抗酸元器件库,从而为研究菌株的抗酸性能及改造途径提供重要指导[10]。
4 展望
经济与社会的可持续发展对于生物发酵产业提出了越来越高的环保与能耗要求,提高包括耐酸性能在内的工业菌株逆境耐受能力,对于发酵行业的节能减排降耗、生产水平提升与工艺革新具有重大意义。
一方面,传统的菌株改造技术将继续为工业界提供相对简单易行的工业菌株抗逆性能改造手段。另一方面,更精细化的各种改造方法的不断发展与普遍运用,使得对于各种类型菌株的抗逆机制的研究与改造越来越深入,而基于抗逆机制的生物信息学预测、基于宏基因组技术的功能基因获取、基于自动化平台的高通量筛选和快速发展的合成生物学技术为自然抗逆元器件的大规模挖掘与评估、人工抗逆元器件的设计、组装与优化奠定了技术基础,必将促使工业菌株得到更高效的抗逆改造。
在我国,有关工业微生物菌株酸胁迫改造正在进行,并随着精细化改造的应用而快速发展。运用系统生物学和合成生物学技术手段对菌株酸胁迫抗性进行改造,还需重点研究抗逆元器件与底盘微生物的适配性,抗逆元器件对于逆境胁迫问题的精确与可控响应,以及抗逆性能与生产性能的协调与平衡等课题,这些研究对于标准抗逆元器件在工业菌株中的应用具有重要意义。
可以预期,随着研究的深入,将会更有效地探明菌株酸胁迫关键基因信息及酸胁迫过程菌株调控的整体动态变化,为构建出更能适应工业生产条件的菌株提供理论依据和实践指导。
[1] 石维忱. 生物发酵产业2013年产值接近3000亿元[EB/OL]. [2014-04-28]. http://unn.people.com. cn/n/2014/0428/c82452-24951188.html.
[2] Abdel-Banat BM, Hoshida H, Ano A, et al. High-temperature fermentation: how can processes for ethanol production at high temperatures become superior to the traditional process using mesophilic yeast? Appl Microbiol Biotechnol, 2010, 85(4): 861–867.
[3] Taylor MP, Eley KL, Martin S, et al. Thermophilic ethanologenesis: future prospects for second–generation bioethanol production. Trends Biotechnol, 2009, 27(7): 398–405.
[4] Cheng C, Kao KC. How to survive being hot and inebriated. Science, 2014, 346(6205): 35–36.
[5] Nicolaou SA, Gaida SM, Papoutsakis ET. A comparative view of metabolite and substrate stress and tolerance in microbial bioprocessing: From biofuels and chemicals, to biocatalysis and bioremediation. Metab Eng, 2010, 12(4): 307–331.
[6] Lund P, Tramonti A, de Biase D. Coping with low pH: molecular strategies in neutralophilic bacteria. FEMS Microbiol Rev, 2014, 1091–1125.
[7] Wu C, Huang J, Zhou R. Progress in engineering acid stress resistance of lactic acid bacteria. Appl Microbiol Biotechnol, 2014, 98(3): 1055–1063.
[8] Doğan A, Demirci S, Aytekin AÖ, et al. Improvements of tolerance to stress conditions by genetic engineering induring ethanol production. Appl Biochem Biotechnol, 2014, 174(1): 28–42.
[9] de la Torre-Ruiz MA, Mozo-Villarías A, Pujol N, et al. How budding yeast sense and transduce the oxidative stress signal and the impact in cell growth and morphogenesis. Curr Protein Pept Sci, 2010, 11(8): 669–679.
[10] 林章凛. 抗逆元器件的构建和机理研究[EB/OL]. [2013-12-31]. http://www.nstrs.cn/xiangxiBG. aspx?id=51681.
[11] Casal M, Paiva S, Queirós O, et al. Transport of carboxylic acids in yeasts. FEMS Microbiol Rev, 2008, 32(6): 974–994.
[12] Russell JB, Diez-Gonzalez F. The effects of fermentation acids on bacterial growth. Adv Microb Physiol, 1998, 39: 205–234.
[13] Russell JB. The energy spilling reactions of bacteria and other organisms. J Mol Microbiol Biotechnol, 2007, 13(1/3): 1–11.
[14] Jeong KC, Hung KF, Baumler DJ, et al. Acid stress damage of DNA is prevented by Dps binding inO157: H7. BMC Microbiol, 2008, 8: 181.
[15] Foster JW.acid resistance: tales of an amateur acidophile. Nat Rev Microbiol, 2004, 2(11): 898–907.
[16] Sun Y, Fukamachi T, Saito H, et al. Respiration and the F₁Fo-ATPase enhance survival under acidic conditions in. PLoS ONE, 2012, 7(12): e52577.
[17] Castanie-Cornet MP, Penfound TA, Smith D, et al. Control of acid resistance in. J Bacteriol, 1999, 181(11): 3525–3535.
[18] Iyer R, Williams C, Miller C. Arginine-agmatine antiporter in extreme acid resistance in. J Bacteriol, 2003, 185(22): 6556–6561.
[19] Sun Y, Fukamachi T, Saito H, et al. Adenosine deamination increases the survival under acidic conditions in. J Appl Microbiol, 2012, 112(4): 775–781.
[20] Lu P, Ma D, Chen Y, et al. L-glutamine provides acid resistance forthrough enzymatic release of ammonia. Cell Res, 2013, 23(5): 635–644.
[21] Hong W, Wu YE, Fu X, et al. Chaperone-dependent mechanisms for acid resistance in enteric bacteria. Trends Microbiol, 2012, 20(7): 328–335.
[22] Mujacic M, Baneyx F. Chaperone Hsp31 contributes to acid resistance in stationary-phase. Appl Environ Microbiol, 2007, 73(3): 1014–1018.
[23] Chang YY, Cronan JE Jr. Membrane cyclopropane fatty acid content is a major factor in acid resistance of. Mol Microbiol, 1999, 33(2): 249–259.
[24] O'Sullivan E, Condon S. Relationship between acid tolerance, cytoplasmic pH, and ATP and H+-ATPase levels in chemostat cultures of. Appl Environ Microbiol, 1999, 65(6): 2287–2293.
[25] Budin-Verneuil A, Maguin E, Auffray Y, et al. Genetic structure and transcriptional analysis of the arginine deiminase (ADI) cluster inMG1363. Can J Microbiol, 2006, 52(7): 617–622.
[26] Frees D, Vogensen FK, Ingmer H. Identification of proteins induced at low pH in. Int J Food Microbiol, 2003, 87(3): 293–300.
[27] Budin-Verneuil A, Maguin E, Auffray Y, et al. Transcriptional analysis of the cyclopropane fatty acid synthase gene ofMG1363 at low pH. FEMS Microbiol Lett, 2005, 250(2): 189–194.
[28] Koponen J, Laakso K, Koskenniemi K, et al. Effect of acid stress on protein expression and phosphorylation inGG. J Proteomics, 2012, 75(4): 1357–1374.
[29] Su MS, Schlicht S, Gänzle MG. Contribution of glutamate decarboxylase into acid resistance and persistence in sourdough fermentation. Microb Cell Fact, 2011, 10 (Suppl 1): S8.
[30] Broadbent JR, Larsen RL, Deibel V, et al. Physiological and transcriptional response ofATCC 334 to acid stress. J Bacteriol, 2010, 192(9): 2445–2458.
[31] Jakob K, Satorhelyi P, Lange C, et al. Gene expression analysis ofsubjected to long-term lactic acid adaptation. J Bacteriol, 2007, 189(15): 5582–5590.
[32] Ding J, Huang X, Zhang L, et al. Tolerance and stress response to ethanol in the yeast. Appl Microbiol Biotechnol, 2009, 85(2): 253–263.
[33] Zhao XQ, Bai FW. Mechanisms of yeast stress tolerance and its manipulation for efficient fuel ethanol production. J Biotechnol, 2009, 144(1): 23–30.
[34] Poolman B, Molenaar D, Smid EJ, et al. Malolactic fermentation: electrogenic malate uptake and malate/lactate antiport generate metabolic energy. J Bacteriol, 1991, 173(19): 6030–6037.
[35] Zhao XQ, Zhang MM, Xu GH, et al. Advances in functional genomics studies underlying acetic acid tolerance of. Chin J Biotech, 2014, 30(3): 368–380 (in Chinese).赵心清, 张明明, 徐桂红, 等. 酿酒酵母乙酸耐性分子机制的功能基因组进展. 生物工程学报, 2014, 30(3): 368–380.
[36] Ramos JL, Duque E, Gallegos MT, et al. Mechanisms of solvent tolerance in gram-negative bacteria. Annu Rev Microbiol, 2002, 56: 743–768.
[37] Janausch IG, Zientz E, Tran QH, et al. C4-dicarboxylate carriers and sensors in bacteria. Biochim Biophys Acta, 2002, 1553(1/2): 39–56.
[38] Scheu PD, Kim OB, Griesinger C, et al. Sensing by the membrane-bound sensor kinase DcuS: exogenous versus endogenous sensing of C(4)-dicarboxylates in bacteria. Future Microbiol, 2010, 5(9): 1383–1402.
[39] Hazelwood LA, Tai SL, Boer VM, et al. A new physiological role for Pdr12p in: export of aromatic and branched-chain organic acids produced in amino acid catabolism. FEMS Yeast Res, 2006, 6(6): 937–945.
[40] Kanjee U, Houry WA. Mechanisms of acid resistance in. Annu Rev Microbiol, 2013, 67: 65–81.
[41] Lund PA. Multiple chaperonins in bacteria--why so many? FEMS Microbiol Rev, 2009, 33(4): 785–800.
[42] Helmann JD, Wu MF, Kobel PA, et al. Global transcriptional response ofto heat shock. J Bacteriol, 2001 , 183(24): 7318–7328.
[43] Tomas CA, Welker NE, Papoutsakis ET. Overexpression of groESL inresults in increased solvent production and tolerance, prolonged metabolism, and changes in the cell's transcriptional program. Appl Environ Microbiol, 2003, 69(8): 4951–4965.
[44] Bearson SM, Bearson BL, Rasmussen MA. Identification ofserovar Typhimurium genes important for survival in the swine gastric environment, Appl Environ Microbiol, 2006, 72(4): 2829–2836.
[45] Zanotti G, Cendron L. Functional and structural aspects ofacidic stress response factors. IUBMB Life, 2010, 62(10): 715–723.
[46] Mols M, van Kranenburg R, van Melis CC, et al. Analysis of acid-stressedreveals a major oxidative response and inactivation-associated radical formation. Environ Microbiol, 2010, 12(4): 873–885.
[47] Fu RY, Li Y. Improving industrial microbial stress resistance by metabolic engineering: a review. Chin J Biotech, 2010, 26(9): 1209–1217 (in Chinese).付瑞燕, 李寅. 利用代谢工程技术提高工业微生物对胁迫的抗性. 生物工程学报, 2010, 26(9): 1209–1217.
[48] Polen T, Rittmann D, Wendisch VF, et al. DNA microarray analyses of the long-term adaptive response ofto acetate and propionate. Appl Environ Microbiol, 2003, 69(3): 1759–1774.
[49] Kannan G, Wilks JC, Fitzgerald DM, et al. Rapid acid treatment of: transcriptomic response and recovery. BMC Microbiol, 2008, 8: 37.
[50] Sengun IY, Karabiyikli S. Importance of acetic acid bacteria in food industry. Food Control, 2011, 22: 647–656.
[51] Basso LC, de Amorim HV, de Oliveira AJ, et al. Yeast selection for fuel ethanol production in Brazil. FEMS Yeast Res, 2008, 8(7): 1155–1163.
[52] Della-Bianca BE, de Hulster E, Pronk JT, et al. Physiology of the fuel ethanol strainPE-2 at low pH indicates a context-dependent performance relevant for industrial applications. FEMS Yeast Res, 2014, 14(8): 1196–1205.
[53] Steensels J, Snoek T, Meersman E, et al. Improving industrial yeast strains: exploiting natural and artificial diversity. FEMS Microbiol Rev, 2014, 38(5): 947–995.
[54] Almario MP, Reyes LH, Kao KC. Evolutionary engineering offor enhanced tolerance to hydrolysates of lignocellulosic biomass. Biotechnol Bioeng, 2013, 110(10): 2616–2623.
[55] Zhang X, Liu S, Takano T. Overexpression of a mitochondrial ATP synthase small subunit gene (AtMtATP6) confers tolerance to several abiotic stresses inand. Biotechnol Lett, 2008, 30(7): 1289–1294.
[56] Abdullah-Al-Mahin, Sugimoto S, Higashi C, et al. Improvement of multiple-stress tolerance and lactic acid production inNZ9000 under conditions of thermal stress by heterologous expression ofDnaK. Appl Environ Microbiol, 2010, 76(13): 4277–4285.
[57] Zhang JG, Liu XY, He XP, et al. Improvement of acetic acid tolerance and fermentation performance ofby disruption of the FPS1 aquaglyceroporin gene. Biotechnol Lett, 2011, 33(2): 277–284.
[58] Zhang J, Fu RY, Hugenholtz J, et al. Glutathione protectsagainst acid stress. Appl Environ Microbiol, 2007, 73(16): 5268–5275.
[59] Wei N, Quarterman J, Kim SR, et al. Enhanced biofuel production through coupled acetic acid and xylose consumption by engineered yeast. Nat Commun, 2013, 4: 2580.
[60] Zhao XQ, Bai FW, Li Y. Application of systems biology and synthetic biology in strain improvement for biofuel production. Chin J Biotech, 2010, 26(7): 880–887 (in Chinese).赵心清, 白凤武, 李寅. 系统生物学和合成生物学研究在生物燃料生产菌株改造中的应用. 生物工程学报, 2010, 26(7): 880–887.
(本文责编 郝丽芳)
Pathway modification of industrial microorganisms to improve acid-stress tolerance
Xiaoming Hao1,2, Bo Chen1,2, and Tai An1,2
1 Nutrition & Health Research Institute, COFCO Corporation, Beijing 102209, China 2 National Energy Research Center of Liquid Biofuels, Beijing 100020, China
Different types of acids from fermentation environment or industrial microorganisms exist during fermentation process. Acids may inhibit growth and metabolism of industrial strains, namely acid stress. The tolerance mechanisms of acid stress include regulation of intracellular proton concentration, protection and restoration of intracellular macromolecules, changes in cell membrane composition and acid stress response at whole cell level. Screening and modification methods have been applied to improve acid-stress tolerance of industrial strains for decades. In this review, we provide insights into acid-stress tolerance of industrial microorganisms and address the modification of microbial pathways to improve acid-stress tolerance.
industrial strain, acid stress, tolerance mechanism, modification method, strains modification
10.13345/j.cjb.140496
October 21, 2014; Accepted: March 23, 2015
National Basic Research Program of China (973 Program) (No. 2013CB733900), Beijing Nova Program (No. Z141105001814031), COFCO Technological Development Project (No. 2013-C2-T010).
Tai An. Tel: +86-10-56989581; Fax: +86-10-56989555; E-mail: antai@cofco.com
国家重点基础研究发展计划 (973计划) (No. 2013CB733900),北京市科技新星计划 (No. Z141105001814031),中粮集团技术开发项目 (No. 2013-C2-T010) 资助。

