基于响应面法的红色西洋菜色素的提取及其稳定性研究
叶少曼,黄俊生
(韩山师范学院化学与环境工程学院,广东潮州 521041)
基于响应面法的红色西洋菜色素的提取及其稳定性研究
叶少曼,黄俊生
(韩山师范学院化学与环境工程学院,广东潮州 521041)
以红色西洋菜为原料,利用Design-Expert软件,基于响应面法研究红色西洋菜色素的提取工艺,以A*V作为实验的响应值,利用回归分析响应值与各工艺参数之间的关系,最后对西洋菜红色色素的稳定性进行研究.结果表明:最佳提取溶剂为蒸馏水,最大吸收波长为529 nm.红色西洋菜的最佳提取工艺条件为:液料比280∶1(mL/g)、提取时间87 min、温度38℃.经过实验验证,该色素稳定性良好.
响应面法;红色西洋菜;色素;提取;稳定性
西洋菜的颜色主要以绿色为多,近年来新栽培出了一种红色西洋菜.红色西洋菜属于十字花科植物,又称红色豆瓣菜,其营养价值丰富[1],食疗药用价值很高.其红色色素的提取及其稳定性还未被研究过.本文利用响应面法研究了红色西洋菜色素的提取及其稳定性分析,希望对红色西洋菜色素的提取投入工业生产提供一定的帮助.
1 色素提取工艺
1.1 实验原料与试剂
红色西洋菜(购自汕头市潮阳区市场),蒸馏水、氢氧化钠、37%盐酸、无水乙醇、无水乙醚、乙酸乙酯丙酮、三氯甲烷、氯化钠、硫酸铜、硫酸钙、硫酸锌、氯化铁、氢氧化钾、镁粉、氯化铝、30%过氧化氢、无水亚硫酸钠等分析纯,以及蔗糖、柠檬酸、葡萄糖、抗坏血酸、苯甲酸钠、山梨酸钾等食品添加剂.
1.2 实验设备
冷冻干燥机(LGJ-10)、可见分光光度计(722SP型)、双光束紫外-可见分光光度计(TU-1900型)
1.3 实验方法
1.3.1 实验材料预处理
将红色西洋菜洗干净,晾干,粉碎,避光密封保存[2].
提取溶剂及最大波长的确定,准确称量10份0.20 g的红色西洋菜粉末,分别置于10 mL 70%乙醇、蒸馏水、1%氢氧化钠溶液、1%盐酸、丙酮、石油醚、无水乙醇、无水乙醚、乙酸乙酯、三氯甲烷中,室温下,浸提3 h,过滤,定容,测定各溶液在200~800 nm的吸收光谱,确定红色西洋菜色素的最佳提取溶剂及最大吸收波长.
1.3.2 单因素试验[3]
1.3.2.1 最佳提取时间的选取
准确称取8份0.10 g的红色西洋菜粉末,各加入10 mL蒸馏水,在室温下分别浸提0.5h、1h、1.5h、2h、2.5h、3h、3.5h、4h后,过滤后定容,在529 nm处测定各溶液的吸光度.
1.3.2.2 最佳提取温度的选取
准确称取7份0.10 g的红色西洋菜粉末,各加入10 mL蒸馏水,在室温、40℃、50℃、60℃、70℃、80℃、90℃下浸提1.5 h,过滤后定容,在529 nm处测定各溶液的吸光度.
1.3.2.3 最佳液料比的选取
准确称取7份0.10 g的红色西洋菜粉末,各加入10 mL、14 mL、18 mL、22 mL、26 mL、30 mL、40 mL蒸馏水,在40℃下恒温水浴,浸提1.5 h,过滤后定容,在529 nm处测定各溶液的吸光度与体积的乘积(AV).
1.3.3 响应面试验
基于单因素的试验,根据Box-Behnken的中心组合试验设计原理,选取提取时间、提取温度、液料比作为自变量,529 nm波长下的吸光值作为响应值设计响应面试验,其因素和水平见表1[4].

表1 水平表(响应面试验因素)
1.3.4 红色西洋菜色素的稳定性研究
1.3.4.1 影响因素研究——光照
可见光:把7份10 mL浓度相同的稀释液,在太阳光下分别放置0h、0.5h、1h、1.5h、2h、2.5h、3h,考察其溶液颜色的变化并在200~800 nm测定其吸收光谱.同时考察在529 nm处,灯光、室内光对色素吸光度的影响.
紫外光:把12份10 mL浓度相同的稀释液,置于254 nm、365 nm处的紫外光分别照射0 min、5 min、10 min、20 min、40 min、60 min,考察其溶液颜色的变化并在最大吸收波长529nm处测定各色素稀释液的吸光度.
1.3.4.2 影响因素研究——温度
把5份10 mL浓度相同的稀释液,在室温、30℃、50℃、70℃、90℃的恒温水浴锅中静置1 h,等溶液温度恢复到室温后定容,在200~800 nm处范围内测定各溶液的吸收光谱以及在最大吸收波长529 nm处测定其吸光度.
1.3.4.3 影响因素研究——pH值
把6份10 mL浓度相同的稀释液,常温下调溶液的pH为2、4、6、8、10、12,静置1.5 h,观察各溶液的颜色变化,并在200~800 nm处测定各溶液的吸收光谱图和在波长529 nm处各溶液的吸光度.
1.3.4.4 影响因素研究——氧化还原剂[5]
氧化剂:常温下,分别往6份10 mL浓度相同的稀释液加入5 mL浓度为0、0.01%、0.02%、0.03%、0.04%和0.05%的过氧化氢,静置1.5h并观察溶液颜色变化,在200~800 nm处测定范围内各溶液的吸收光谱.
还原剂:常温下,分别往6份10 mL浓度相同的稀释液加入5 mL浓度为0、0.01%、0.02%、0.03%、0.04%和0.05%的无水亚硫酸钠,静置1.5 h并观察溶液颜色变化,在200~800 nm范围内测定各溶液的吸收光谱.
1.3.4.5 影响因素研究——金属离子
在常温下,往24份10 mL浓度相同的稀释液中分别加入5 mL 2×10-5、10×10-5、50×10-5mol/L的各种金属离子(Cu2+、Na+、Ca2+、Zn2+、Fe3+、K+、Mg2+、Al3+),静置22 h,考察各溶液颜色的变化,测定在波长529 nm处各溶液的吸光度[6].
1.3.4.6 影响因素研究——食品添加剂
蔗糖和葡萄糖:常温下,往10份10 mL浓度相同的稀释液中分别加入5 mL浓度为0、1%、5%、10%、20%的蔗糖、葡萄糖溶液,避光静置一天,考察各溶液颜色的变化,在波长529 nm处测定各溶液的吸光度.
其他食品添加剂:常温下,往16份10 mL浓度相同的稀释液中分别加入5 mL浓度为0、0.01%、0.05%、0.1%的柠檬酸、抗坏血酸、山梨酸钾、苯甲酸钠中,避光静置一天,考察各溶液颜色的变化,在波长529 nm处测定各溶液的吸光度[6].
2 结果与分析
2.1 色素提取最佳工艺参数的确定
2.1.1 提取溶剂的选择和最大波长的确定
采用蒸馏水提取的红色西洋菜色素溶液的吸收光谱图见图1.
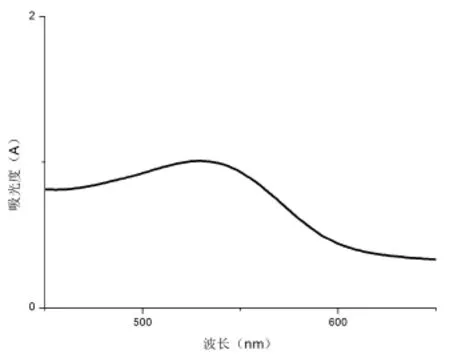
图1 蒸馏水提取的红色西洋菜色素溶液的吸收光谱图
由结果分析可得,色素易溶于蒸馏水,微溶于70%乙醇、1%氢氧化钠溶液、1%盐酸、丙酮、无水乙醇、无水乙醚、乙酸乙酯中,难溶于石油醚、三氯甲烷,并且四种溶剂蒸馏水、70%乙醇、1%氢氧化钠溶液和1%盐酸在529 nm有较明显的吸收峰,蒸馏水最高,因此确定该色素的最佳提取剂为蒸馏水,红色西洋菜色素的颜色为红色,色泽鲜艳,其最大吸收波长为529 nm.
2.1.2 选取最佳提取时间
图2为不同时间的提取效果.
由图2可见,随着时间的增加,红色西洋菜色素的吸光度的趋势先升后降,故最佳提取时间1.5 h.
2.1.3 选取最佳提取温度
图3为不同温度的提取效果.
由图3可得,随着温度的升高,红色西洋菜色素的吸光度先升后降,所以选择40℃为最佳提取温度.
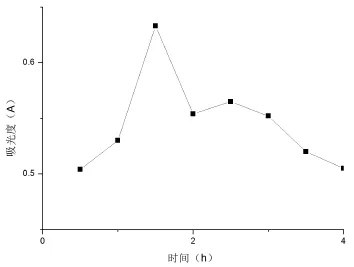
图2 不同提取时间的吸光度
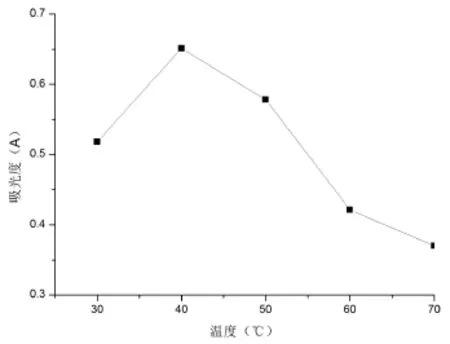
图3 不同提取温度的吸光度
2.1.4 选取最佳液料比
图4为不同液料比的提取效果.
由图4可见,随着液料比浓度的下降,吸光度在液料比为260∶1时达到一个最大值,所以选择最佳液料比为260∶1.
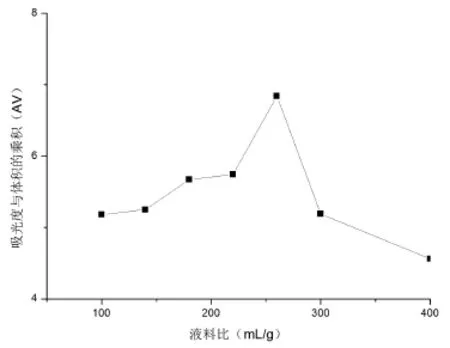
图4 不同液料比的AV
2.1.5 响应面试验结果及分析
2.1.5.1 响应面试验结果
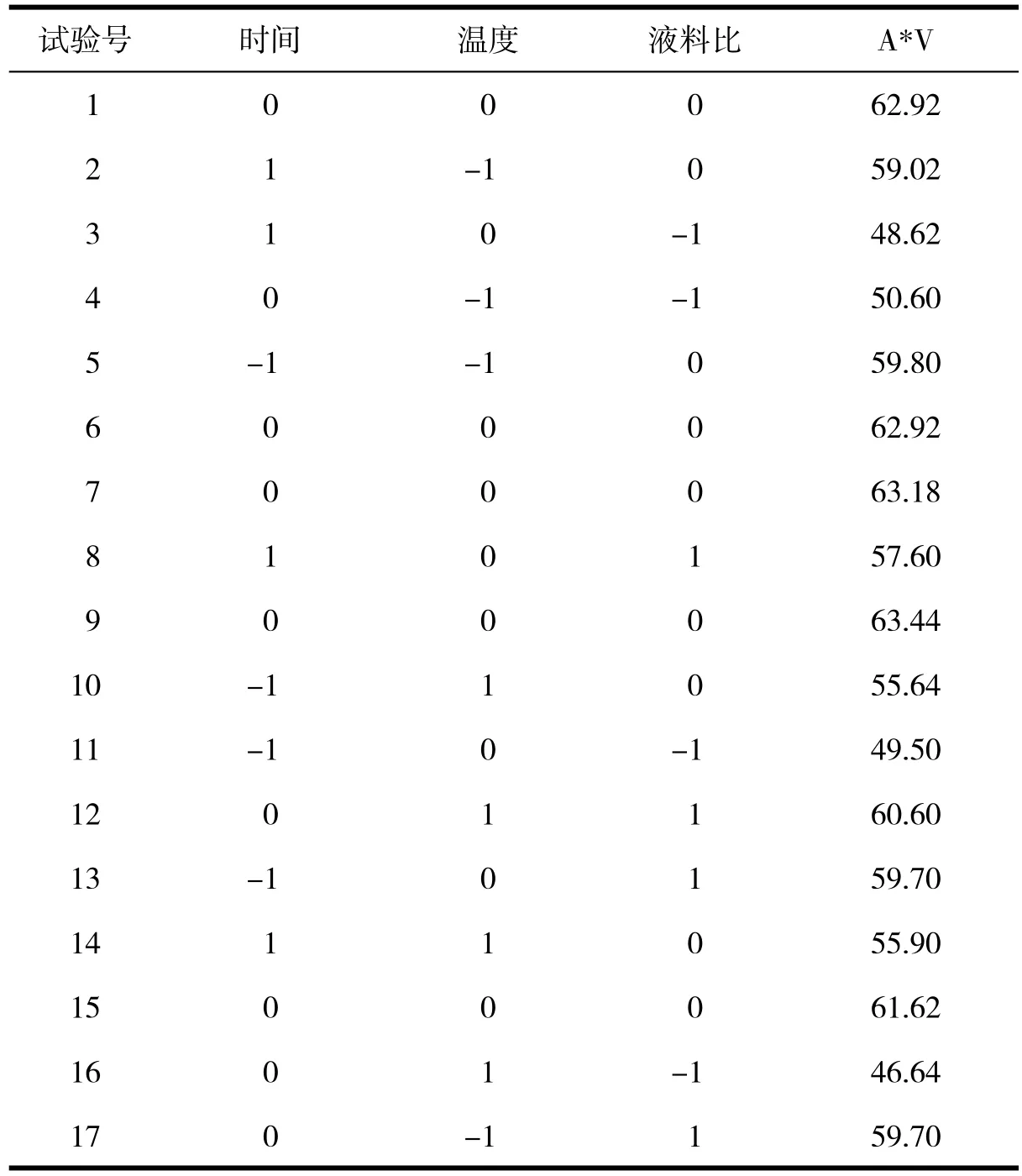
表2 响应面试验方案及结果
2.1.5.2 模型评价
利用Design-Expert软件对表3试验数据进行二次多项式逐步回归拟合,得到的数学模型为:AV=+62.82-0.44A-1.29B+5.28C+0.26AB-0.30AC+1.21BC-2.88A2-2.35B2-6.08C2.
模型方差分析结果和各项系数显著性检验结果列于表3.
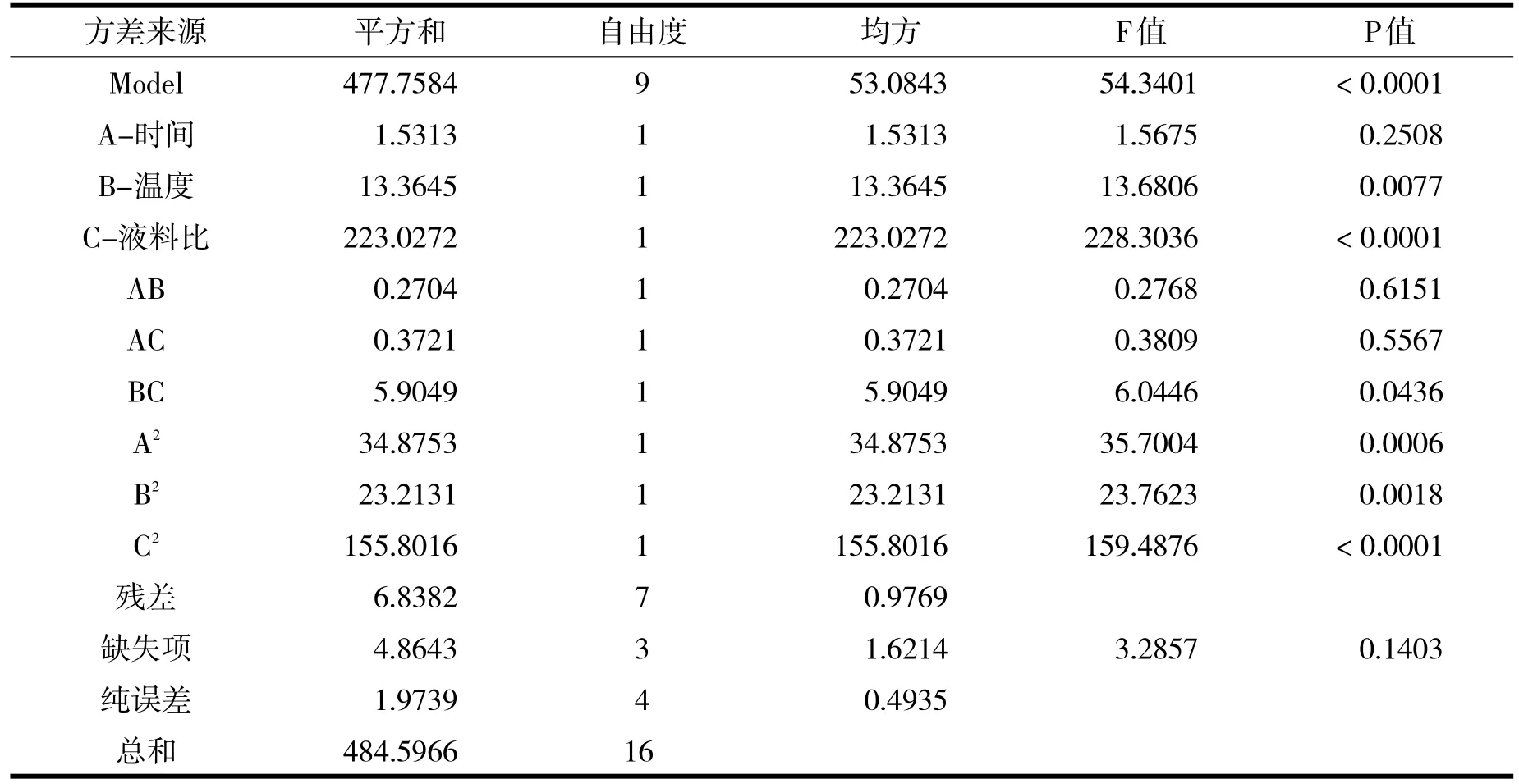
表3 回归模型各项方差分析
根据表3可得,该模型的F=54.34014、P<0.0001,该实验所采用的二次模型比较显著.P(B)、P(C)、P(BC)、P(A2)、P(B2)、P(C2)均小于0.05,可以看出提取液料比、温度及液料比与温度的交互以及3个因素的二次项都具有显著影响;而时间及缺失项显著性较差,三者的交互作用不大.决定因素R2= 0.9859,即模型能够很好的反应响应值的变化,拟合度好.各因素的效应关系为液料比>温度>时间.
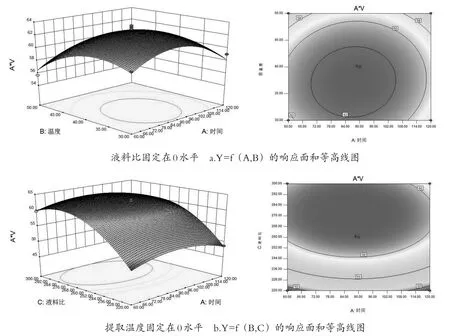
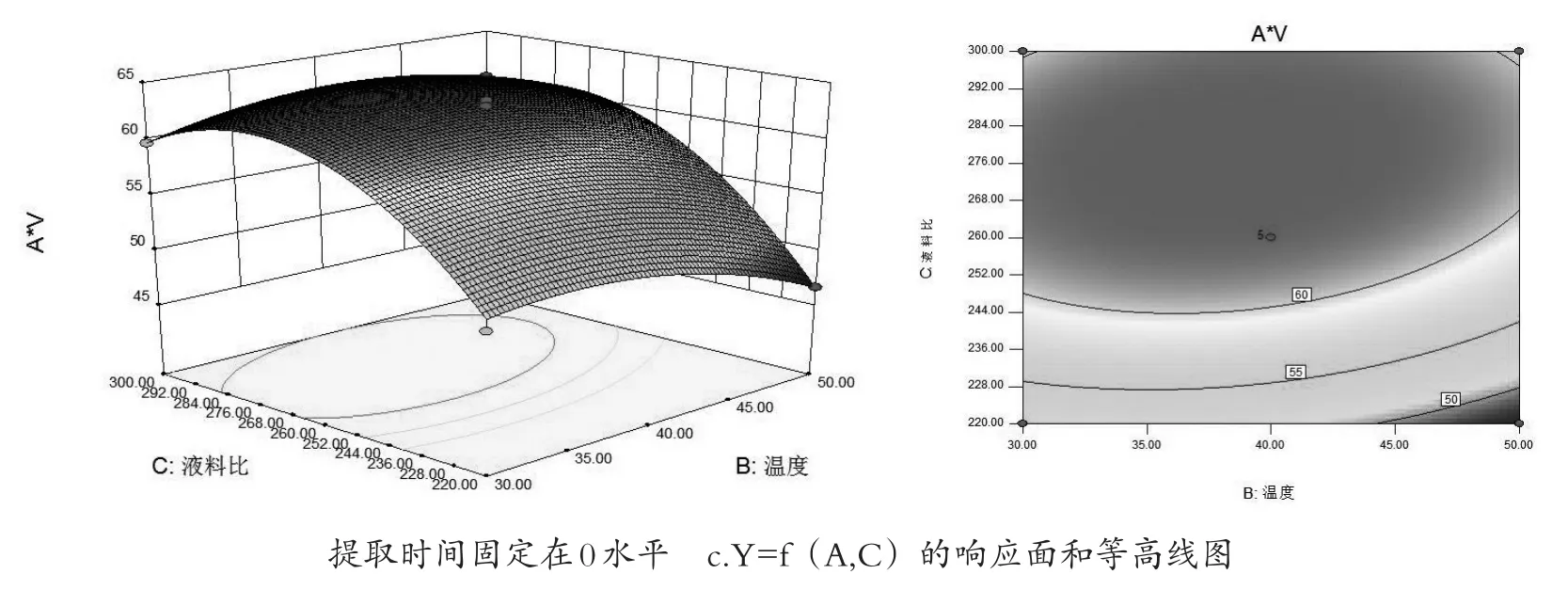
图5 各两个因素的响应面和等高线图
2.1.5.3 响应面分析
如图5,当时间和温度都固定时,A*V值随提取液料比的变化幅度较大,而提取率随时间和温度的变化幅度较小,因此,料液比对A*V的影响较为显著.通过最优化分析,最佳的提取条件为提取时间为86.79 min,最佳提取温度为38.28℃,料液比为276.8(mL/g).预测A*V值为64.058.最后将红色西洋菜的最佳提取工艺修正为提取时间为87 min,最佳提取温度为38℃,料液比为280(mL/g).

表4 最佳工艺条件及其验证
经过3次实验,该实验的A*V值为63.96,与预测值基本相符.
2.2 红色西洋菜色素的稳定性
经过实验验证,分析所得吸收光谱,得出以下结论.
2.2.1 光照
可见光:随着光照时间的延长,吸光度逐渐下降,最大吸收峰发生位移,并且颜色由红色变为微红色甚至无色,可见太阳光照对该色素的影响较大,色素耐光性差,因此该色素应避免阳光直晒.室内光和灯光对色素的稳定性也有一定的影响,色素耐光性较差.
紫外光:随着紫外灯照射的时间的延长,两种不同波长的紫外灯照射对色素的吸光度为上升的趋势,色素受紫外光照射的影响比较大,其中波长为254 nm的紫外灯照射的吸光度的波动幅度较大,而波长为365 nm的紫外灯照射的波动较小.
2.2.2 耐热性
随着温度的升高,最大吸收峰的吸光度变化较大,提取液的颜色由红色变为浅红色,可见该色素的耐热性比较差.
2.2.3 耐酸碱性[7]
当pH等于2、4、6、8、10时,颜色变化不大,并且吸光度的变化幅度非常小.pH=12时,红色西洋菜色素受到较大影响,并且颜色变为浅黄色,说明该色素的耐酸碱性良好.
2.2.4 耐氧化性
提取液的颜色随着过氧化氢浓度的增加由红色变为淡红色,最大吸收峰的吸光度变化较大,实验得出该色素的耐氧化性较差.
2.2.5 耐还原性
提取液的颜色随着亚硫酸钠浓度的增加由红色变为淡红色,最大吸收峰的吸光度变化较大,实验得出该色素的耐还原性较差.
2.2.6 金属离子
Ca2+、Na+、Zn2+、Fe3+、K+、Mg2+、Al3+溶液颜色都很接近原液颜色,但是Cu2+很不稳定,溶液吸光度随Cu2+浓度增加而受到的波动较大.因此,该色素在保存的过程中应该避免与铜器接触.
2.2.7 食品添加剂
蔗糖和葡萄糖:蔗糖对该色素影响不大,但是葡萄糖对其影响较大,总的看来,该色素的耐糖性较好.
其他食品添加剂:苯甲酸钠、山梨酸钾对色素溶液的稳定性影响不大,而柠檬酸、抗坏血酸对色素的稳定性影响较大,因此在使用抗坏血酸和柠檬酸等食品添加剂时用量不宜过高.
根据实验结果可得,红色西洋菜提取的最佳试剂为蒸馏水.经单因素实验结果确定红色西洋菜的提取工艺条件为:液料比260∶1(mL/g)、提取时间1.5 h、温度40℃.通过回归分析建立相关性良好的方程,红色西洋菜的最佳提取工艺条件为:液料比280∶1(mL/g)、提取时间87 min、温度38℃,实验值与预测值相符[8].
稳定性研究表明,色素在储存的过程中应避免阳光直晒.该色素对热、氧化剂和还原性的稳定性较差.常用的食品添加剂如蔗糖、苯甲酸钠和山梨酸钾对色素溶液的稳定性影响不大,而柠檬酸、抗坏血酸对色素的稳定性影响较大,因此在使用葡萄糖、抗坏血酸和柠檬酸等食品添加剂时要注意用量.金属离子如Na+、Ca2+、Zn2+、Fe3+、K+、Mg2+、Al3+无不良影响,而Cu2+对该色素有较大影响.该色素的耐酸碱性较好,当pH等于2、4、6、8、10时,颜色变化不大,pH=12时,红色西洋菜色素受到较大影响,并且颜色变为浅红色.
红色西洋菜色素为红色,作为一种红色西洋菜十字花科植物,营养物质比较全面,其中超氧化物歧化酶(即SOD)的含量很高,红色西洋菜色素色泽鲜艳,稳定性良好,作为一种纯天然色素,该色素有着广泛的应用前景.
[1]豆瓣菜的营养价值[J].吉林蔬菜,2014(6):53.
[2]王振宇,郝秀梅.响应面法优化微波辅助提取红甜菜色素的工艺[J].中国调味品,2011,01:85-89.
[3]王芳,张庆庆,乔璐,等.响应面法优化乌饭叶色素提取工艺[J].山西农业科学,2014,42(8):917-920.
[4]苏艳玲,巫东堂,杨艳君.响应面法优化茄子皮色素的浸提工艺及稳定性研究[J].中国调味品,2013,07:24-30.
[5]胡喜兰,刘存瑞,曾宪佳,江发寿,王鲁石.红苋菜色素的提取及稳定性研究[J].食品科技,2002,03:49-50.
[6]张凤秀,张光先.大枣红色素的提取及稳定性研究[J].西南农业大学学报,1998,20(1):72-75.
[7]刘晓庚,丁悦琴,陈梅梅.南酸枣果皮色素的提取研究[J].江西农业学报,1994,6(2):87-92.
[8]刘振华,丁卓平,董洛文,等.辣椒红色素的提取工艺研究[J].食品科学,2006,27(12):291-295.
The Research of the Extraction Based on Response Surface Method and the Stability of Red Watercress Pigment
YE Shao-man,HUANG Jun-sheng
(School of Chemistry and Environmental Engineering,Hanshan Normal University,Chaozhou,Guangdong,521041)
Used red watercress as raw material,it studies on the extraction of red pigment of watercress by using Design-Expert software which is based on Response surface method.The product of absorbance and volume is the response value.Regression analysis was applied to analyse relationship between response value and process parameters.Finally,it studies on the stability of pigment of red watercress.The findings suggest that the best extracting solvent is distilled water,the maximum absorption wavelength is 529 nm.The optimum condition of extraction process of red watercress is:liquid ratio 280:1(mL/g),extraction time 87 minutes,the temperature of 38℃.After being researched by the experimental verification,the pigment is stable.
response surface method;red watercress;pigment;extraction;stability
O 6-332
A
1007-6883(2015)06-0050-07
责任编辑 朱本华
2015-09-23
叶少曼(1994-),女,广东汕头人,韩山师范学院化学与环境工程学院在读生.黄俊生为通讯作者.

