2型糖尿病小鼠小脑代谢物的1H NMR研究
魏婷婷,郑涌泉,王慧,夏欢欢,许翠翠,叶信健,赵良才,高红昌
(温州医科大学 药学院 代谢组学与医药核磁共振研究所,浙江 温州 325035)
·论 著·
2型糖尿病小鼠小脑代谢物的1H NMR研究
魏婷婷,郑涌泉,王慧,夏欢欢,许翠翠,叶信健,赵良才,高红昌
(温州医科大学 药学院 代谢组学与医药核磁共振研究所,浙江 温州 325035)
目的:通过离体的高分辨核磁共振氢谱(1H NMR)技术研究2型糖尿病db/db小鼠小脑的代谢变化。方法:采用8只15周龄2型糖尿病模型db/db小鼠为实验组,11只15周龄野生正常小鼠为对照组,对其小脑组织进行离体的1H NMR检测分析。结果:实验组与对照组相比小脑的代谢模式明显不同,甘氨酸(Gly)、天冬氨酸(Asp)、谷氨酸(Glu)、γ-氨基丁酸(GABA)、N-乙酰天门冬氨酸(NAA)、丙氨酸(Ala)等代谢物浓度明显下降,差异有统计学意义(P<0.05或P<0.01);谷氨酰胺(Gln)、牛磺酸(Tau)、乳酸(Lac)等代谢物水平显著上升,差异有统计学意义(P<0.05或P<0.01)。结论:代谢组学结果说明2型糖尿病模型db/db小鼠小脑中糖代谢、氨基酸代谢出现了紊乱,这为进一步认识糖尿病脑病的发病机制提供了线索。
代谢组学;糖尿病,2型;代谢物;核磁共振;db/db小鼠
糖尿病作为一个常见的慢性代谢类疾病,已经严重影响了人类的生活。WHO最新的流行病学资料显示全世界已有3.47亿人患有糖尿病[1],这一数字还在不断增长,其中2型糖尿病占90%以上[2]。糖尿病脑病作为糖尿病神经系统并发症开始越来越受到关注[3]。研究显示,糖尿病患者大脑在长期的高血糖状态下代谢发生紊乱,其中包括生化特征改变、神经生理学、形态学变化以及认知功能障碍等[4]。然而此类脑病的发病机制目前还不清楚。
基于核磁共振(NMR)的代谢组学已成功应用于疾病的发病机制、早期诊断以及治疗研究,越来越显示出其在生命科学领域的重要地位[5]。本研究对象db/db小鼠为经典的2型糖尿病小鼠模型,小脑不仅仅与运动有关,而且参与非运动的认知功能[6]。本研究将利用基于核磁共振氢谱(1H NMR)的代谢组学方法分析2型糖尿病模型db/db小鼠小脑的整体代谢特征,这可能为阐明2型糖尿病脑病潜在发病机制提供重要的线索。
1 材料和方法
1.1 实验动物 雄性2型糖尿病模型db/db小鼠(BKS.Cg-m+/+Leprdb/J)8只(15周龄)为实验组,雄性野生型小鼠11只(15周龄)为对照组,购自南京大学模式动物研究所,饲养于温州医科大学实验动物中心SPF级动物房,自早上8∶00开始12 h交替照明。所有小鼠适应性饲养1周再进行实验,实验期间自由饮水、进食,所有的操作程序严格遵守NIH的实验动物饲养和使用手册。饲养至17周断头处死,在冰上分离小脑,迅速置于液氮中猝灭,将收集的样本置于-80 ℃超低温冰箱中储存待测。
1.2 试剂与仪器 三甲硅烷基丙磺酸钠(TSP)购自Sigma-Aldrich公司;D2O(99.9%氘代)购于剑桥同位素实验室;甲醇和氯仿购于上海国药集团化学试剂有限公司;纯水由Milli-Q超纯水系统(Millipore,Billerica,MA,USA)生产。使用Bruker AVANCE I I I 600 MHz NMR波谱仪(Bruker BioSpin International AG)进行分析,低温离心机5415R(eppendorf Inc,Germany)离心。
1.3 方法
1.3.1 组织萃取:将冰冻组织称质量并放入离心管中,应用甲醇-氯仿-水按一定比例萃取,离心后取上清液,冻干24 h,重新溶解于500 mL D2O中进行NMR检测。
1.3.21H NMR检测:于600 MHz NMR波谱仪上进行NMR采集实验,累加采样256次,数据采集点为32 K,谱宽为12 000 Hz,弛豫延迟10 s。进行傅立叶变换前,将采集的FID信号充零至64 K,并加窗函数LB=0.3。使用Topspin 2.1软件对所有的1H NMR谱图都进行相位校正、基线调整,并以乳酸的甲基峰的化学位移为1.33 ppm定标。
1.3.3 NMR波谱数据处理和模式分析:将1H NMR谱从δ-0.2~8.8 ppm按0.01 ppm为单位进行自动分段积分[7],为了消除预饱和压水峰时引起的谱线扭曲,将δ5.85~4.60 ppm区域设为0积分段。对每一段积分值都相对于该谱的所有积分值进行归一化,然后将数据导入SIMCA-P+12.0软件包(瑞典Umetrics 公司),进行多元统计分析。偏最小二乘判别分析(partial least-squares discriminant analysis,PLS-DA)用于代谢模式和重要代谢物的研究。
1.4 统计学处理方法 采用SPSS 13.0软件将归一化后的积分值导入作统计学分析。2组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组小鼠体质量和血糖测定 实验组小鼠“三多一少”糖尿病症状表现明显,且觅食过程比对照组缓慢。13周龄实验组小鼠体质量明显高于对照组,差异有统计学意义(P<0.01)。实验组小鼠空腹血糖值持续≥16.7 mmol/L,见表1。
表1 2组小鼠体质量和空腹血糖值比较(±s)

表1 2组小鼠体质量和空腹血糖值比较(±s)
与对照组比:aP<0.01
2.2 2组小脑组织1H NMR谱图及PLS-DA分析 脑组织提取物的1H NMR波谱可以同时测量多种内源性代谢物,于图中标出丙氨酸(Ala,δ 1.46),乳酸(Lac,δ 1.33),γ-氨基丁酸(GABA,δ 2.29),N-乙酰天门冬氨酸(NAA,δ 2.02),谷氨酸(Glu,δ 2.35),天冬氨酸(Asp,δ 2.82),谷氨酰胺(Gln,δ 2.45),琥珀酸(Suc,δ2.40),肌酸(Cr,δ3.03),胆碱(Cho,δ 3.20),牛磺酸(Tau,δ 3.42),甘氨酸(Gly,δ 3.55)和肌醇(m-Ins,δ 4.06),见图1。2组代谢特征明显不同,Lac、Tau、NAA、Cho等代谢物对2组间分离贡献较大,见图2。
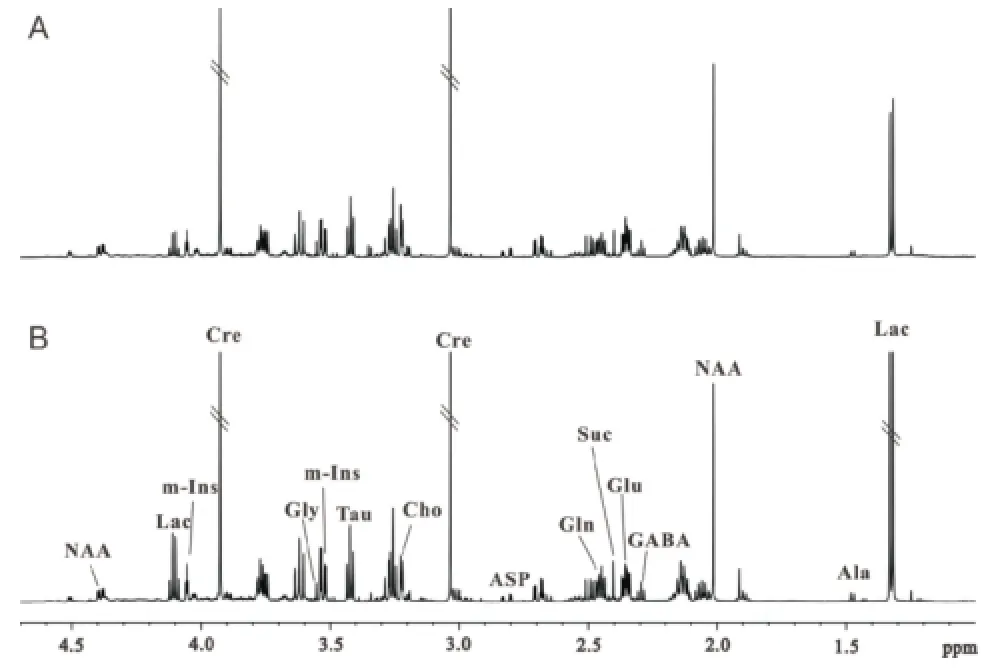
图1 对照组小鼠(A)和实验组小鼠(B)小脑典型的1H NMR波谱图
2.3 2组小鼠代谢物变化情况 与对照组相比,实验组小鼠小脑中Lac、Gln和Tau水平显著增加,差异有统计学意义(P<0.05或P<0.01);Gly、Aap、Glu、GABA、NAA和Ala水平显著降低,差异有统计学意义(P<0.05或P<0.01);m-Ins、Cre、Cho和Suc变化差异没有统计学意义(P>0.05),见图3。
3 讨论
本实验对2型糖尿病模型db/db小鼠小脑的代谢轮廓和代谢变化进行分析,标出的代谢物都基于我们前期已发表的研究成果[6,8],并且经过2D1H-1H COSY和TOCSY谱图验证。我们发现持续的高血糖能够明显影响神经化学物质代谢,包括一些重要的兴奋性和抑制性神经递质如Glu、Gln、GABA、Asp和Gly,表明2型糖尿病模型db/db小鼠小脑内神经元的兴奋性程度发生了改变。除此之外,能量代谢产物Lac和Ala的变化揭示了其小脑能量代谢的改变。
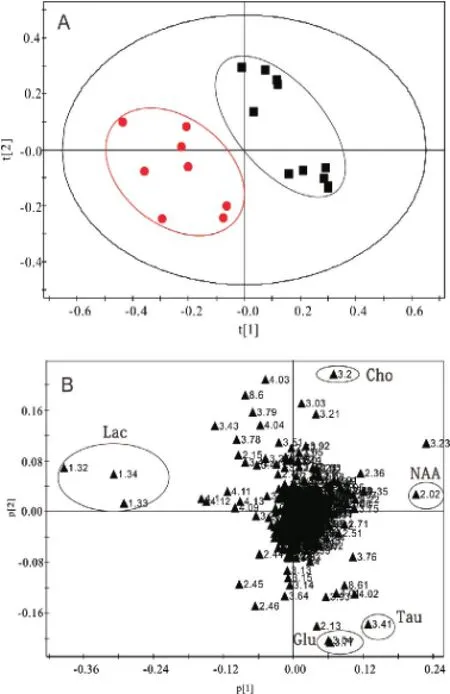
图2 模式识别分析结果

图3 小脑内各代谢物相对浓度柱状图
3.1 氨基酸类神经递质代谢紊乱 Glu是脑中最重要、分布最广的兴奋性神经递质[9],在中枢神经系统生理、病理以及毒理学研究中有着重要的意义[8]。近年来,越来越多的研究证实哺乳动物脑内存在两个代谢区间,其中一个是神经元代谢区间,另一个是神经胶质代谢区间。神经元释放出的Glu被星形胶质细胞摄取转化为Gln,Gln再被送回神经元而转化为Glu,见图4。这种发生在神经元和星形胶质细胞之间的神经递质循环称为Gln-Glu循环[10]。我们发现2型糖尿病模型db/db小鼠小脑内Glu、GABA含量显著性降低,Gln含量显著性升高,可能是Gln在向谷氨酸能神经元和γ-氨基酸能神经元运输过程发生障碍,导致星形胶质细胞Gln含量升高,也有可能是持续的高血糖使得脑内神经胶质细胞过度增生。Gln-Glu循环的紊乱,间接反映小脑中神经元代谢区间和神经胶质代谢区间可能存在紊乱。此外,我们发现小脑兴奋性氨基酸Asp和抑制性氨基酸Gly也出现显著性下降,进一步证实氨基酸类神经递质在2型糖尿病模型db/db小鼠小脑内可能存在代谢紊乱。
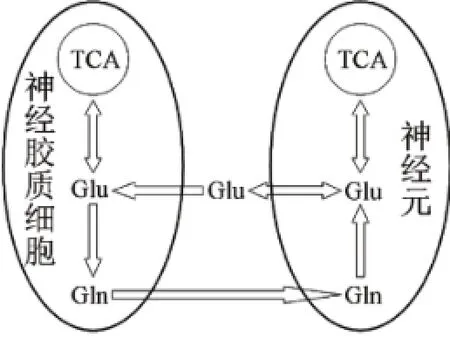
图4 脑中神经元和神经胶质细胞间Gln-Glu循环图
3.2 能量代谢紊乱 脑能量需求几乎全部来自线粒体中葡萄糖的氧化代谢,当神经元对能量的需求超过氧化代谢速率时,Lac就会作为能量底物而被利用[11]。与野生型对照组相比,我们发现2型糖尿病模型db/db小鼠小脑内乳酸含量明显升高,而Ala含量明显降低,这可能是由于能量底物葡萄糖在2型糖尿病模型db/db小鼠小脑内无氧酵解途径增强,能量利用率降低。但是,我们发现三羧酸循环中间产物Suc的含量并没有显著性变化,说明脑内的有氧呼吸途径改变不明显,这很可能是由Glu通过转化为α-酮戊二酸进入到三羧酸循的途径增强,Glu含量下降与上述分析一致。综上所述,我们认为2型糖尿病模型db/db小鼠小脑内能量代谢出现障碍,持续的高血糖导致神经细胞无氧降解途径增强,能量代谢障碍,为了弥补能量的空缺,使得Glu等能量代谢旁路途径代谢增强,这同样与小脑中Glu含量显著降低一致。
3.3 其他代谢产物变化 NAA通常被认为是神经元的标志物,它的升高或降低都与神经元活性息息相关[12],在2型糖尿病模型db/db小鼠小脑内我们发现NAA明显降低。这表明,高血糖状态下2型糖尿病模型db/db小鼠可能发生神经元功能性障碍。Tau被认为是星形胶质细胞活性的标志物,它对调节星形胶质细胞胞内渗透压起到重要作用[13]。小脑中Tau水平显著性升高,这说明持续高血糖会影响星形胶质细胞的活性。Cr是一种氨基酸,经过磷酸化作用,作为能量储存在细胞中[14]。在1H NMR谱中,Cr峰的位置相对稳定,在绝大部分疾病发生时,脑内Cr浓度几乎保持恒定状态[15],这和我们观察到的小脑Cr差异无统计学意义是一致的。Cho是细胞膜的主要成分,它的变化可能与肿瘤和组织炎症的发生有关[16]。小脑中Cho的降低可能暗示了持续高血糖使小鼠小脑内细胞的新陈更替程度降低。
本实验应用1H NMR技术研究2型糖尿病db/db小鼠小脑的代谢变化。基于1H NMR的代谢组学结果表明2型糖尿病db/db小鼠小脑内的代谢轮廓与野生型对照小鼠相比发生了明显改变;代谢物的定量1H NMR分析表明2型糖尿病模型db/db小鼠小脑内氨基酸类神经递质和能量代谢出现异常。这些结果提示2型糖尿病db/db小鼠小脑中Gln-Glu循环平衡被打破,糖酵解途径增强。近年来,越来越多的研究证实小脑与认知、行为及精神疾病密切相关[5,17]。行为学数据表明,与对照组相比,2型糖尿病模型db/db小鼠在水迷宫实验中表现为潜伏时间延长并且穿台次数显著减少,出现了明显的认知功能障碍,Gln-Glu循环和糖酵解途径的紊乱可能参与了高血糖引起的小脑纤维联系与非运动认知功能紊乱的发病过程[18]。本实验从代谢水平初步探讨了糖尿病脑损伤的可能机制,为深入认识糖尿病脑病的分子机制提供了一定的理论依据。
[1]Whiting DR, Guariguata L, Weil C, et al.IDF diabetesatlas: global estimates of the prevalence of diabetes for 2011and 2030[J].Diabetes Res Clin Pract, 2011, 94(3): 311-321.
[2]Chang KH, Chuang TJ, Lyu RK, et al.Identification of gene networks and pathways associated with Guillain-Barre syndrome[J].Plos One, 2012, 7(1): e29506.
[3]吴亮, 刘网网, 焦立卓, 等.棉酚对2型糖尿病大鼠大脑皮层及海马神经元凋亡相关基因表达的影响[J].温州医学院学报, 2013, 43(9): 567-577.
[4]Pop-Busui R, Lu J, Lopes N, et al.Prevalence of diabetic peripheral neuropathy and relation to glycemic control therapies at baseline in the BARI 2D cohort[J].J Peripher Nerv Syst, 2009, 14(1): 1-13.
[5]Psihogios NG, Gazi IF, Elisaf MS, et al.Gender-related and age-related urinalysis of healthy subjects by NMR-based metabonomics[J].NMR Biomed, 2008, 21(3): 195-207.
[6]尹顺雄, 闵连秋.小脑在血管性认知功能障碍中的作用[J].中国卒中杂志, 2013, 8(10): 844-848.
[7]朱环, 管咪咪, 郑涌泉, 等.糖尿病早期大鼠血清代谢轮廓的变化[J].温州医学院学报, 2013, 43(12): 784-787.
[8]吴强恩, 郑力行, 谢芳, 等.反相高效液相色谱荧光法测定大鼠脑组织中氨基酸类神经递质[J].复旦学报(医学版), 2005, 32(3): 355-358.
[9]王杰, 刘青, 姜立红, 等.大脑能量代谢和神经传递动力学的NMR测定方法[J].波谱学杂志, 2010, 27(3): 341-354.
[10] Gao HC, Zhu H, Song CY, et al.Metabolic changes detected by ex vivo high resolution 1H NMR spectroscopy in the striatum of 6-OHDA-induced Parkinson’s rat[J].Mol Neurobiol, 2013, 47(1): 123-130.
[11] 杨东升, 刘晓莉, 乔德才.“乳酸穿梭”背景下的运动性疲劳中枢机制研究新进展[J].中国康复医学杂志, 2012, 27 (3): 285-288.
[12] Zhang X, Liu H, Wu J, et al.Metabonomic alterations in hippocampus, temporal and prefrontal cortex with age in rats[J].Neurochem Int, 2009, 54(8): 481-487.
[13] Isaacks RE, Bender AS, Kim CY, et al.Osmotic regulation of myo-inositol uptake in primary astrocyte cultures[J].Neurochem Res, 1994, 19(3): 331-338.
[14] Sartorius A, Lugenbiel P, Mahlstedt MM, et al.Proton magnetic resonance spectroscopic creatine correlates with creatine transporter protein density in rat brain[J].J Neurosci Methods, 2008, 172(2): 215-219.
[15] 李春霞, 王亚强, 潘文举, 等.长期慢性强迫游泳应激抑郁模型大鼠前额叶脑代谢物的1H NMR研究[J].武汉大学学报(理学版), 2008, 54(4): 451-456.
[16] Govindaraju V, Young K, Maudsley AA.Proton NMR chemical shifts and coupling constants for brain metabolites[J].NMR Biomed, 2000, 13(3): 129-153.
[17] 郭旭, 李云.小脑认知功能的临床研究进展[J].中国医药指南, 2013, 11(20): 492-493.
[18] Zhao Q, Matsumoto K, Tsuneyama K, et al.Diabetesinduced central cholinergic neuronal loss and cognitive defcit are attenuated by tacrine and a Chinese herbal prescription, kangen-karyu: elucidation in type 2 diabetes db/db mice[J].J Pharmacol Sci, 2011, 117(4): 230-242.
(本文编辑:吴彬)
1H NMR-based metabonomic study on cerebellum of type 2 diabetes mellitus model
WEI Tingting,ZHENG Yongquan, WANG Hui, XIA Huanhuan, XU Cuicui, YE Xinjian, ZHAO Liangcai, GAO Hongchang.Institute of Metabonomics & Medical NMR, School of Pharmacy, Wenzhou Medical University, Wenzhou, 325035
Objective:To investigate the diabetes-related metabolic changes in the cerebellum of db/db mice.Methods:Specimens of the cerebellum were dissected from the 17-week db/db mice and the age-matched controls.The cerebellum tissue samples were extracted and analyzed by1H NMR-based metabonomics.Results: Compared to the controls, the db/db mice exhibited markedly different metabolic profles, which included signifcant decrease in the levels of glycine (P<0.01), aspartate (P<0.01), glutamate (P<0.01), GABA (P<0.01), N-acetyl-aspartate (P<0.01) and alanine (P<0.05) and increase in the levels of glutamine (P<0.01), taurine (P<0.05) and lactate (P<0.01).Conclusion:These metabolic changes suggest that glucose metabolism and amino acid metabolism in the cerebellum of db/db mice are disordered, which provides clues for further understanding the pathogenesis of diabetic encephalopathy.
metabonomics; diabetes, type 2; metabolite; NMR; db/db mice
R34
A
10.3969/j.issn.2095-9400.2015.02.009
2014-10-08
温州医科大学2012年国家级大学生创新创业训练计划资助项目(201210343009);浙江省自然科学基金资助项目(LY14H090014,LY13H070005);高等学校博士学科点专项科研基金-新教师类资助项目(20133321120006);温州市科技计划项目(Y20100005)。
魏婷婷(1990-),女,浙江金华人,硕士生。
高红昌,教授,博士生导师,Email:gaohc27@wmu.edu.cn。

