MMP-- 33、MMP-- 9和TIIMP-- 1的动态平衡可作为心肌基质重构的重要标志
吴伟东,侯文进,刘 丹,易永盛,王跃军,林苇嘉,周洋洋暨南大学第四附属医院//广州市红十字会医院心胸外科,广东 广州 500;暨南大学第一临床医学院,广东广州50000
过去认为心脏重构只是由于心肌细胞内源性的变化,现在认识到心肌细胞外基质中胶原的数量、组成和结构的变化也参与了心脏重构,即基质组织修复再生的过程,并且是心室重构的重要原因,又称为心肌基质重构[1]。心室重构是决定心脏病患者心功能及其预后的主要因素之一,是心脏基质成分合成或降解代谢失平衡的结果。心脏基质在维持心脏结构和功能完整性方面起着重要的作用。基质组织修复再生引起心肌纤维化和进行性心室扩张,最终导致心力衰竭[2]。在心肌中存在的能降解所有心脏基质成分的基质金属蛋白酶(matrix metalloproteinase,MMPs),是重构过程中心脏基质降解的主要因素[3]。在衰竭的心脏中,MMPs活性升高导致纤维胶原降解、细胞外基质重构,导致左室进行性扩张、收缩功能逐渐下降,MMPs在转录前和转录后水平都可被调节,而且可以通过底物间的相互作用和通过内源性生理抑制剂即基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMps)来调节[4]。因此MMPS、TIMPS及其调节因子间的相互作用决定了心肌纤维化过程的进展[5]。调节心肌MMPS、TIMPS的表达和活性,成为控制心衰进展中心脏基质的组织修复和再生的重要治疗手段。因此,深入了解心肌基质的降解和重构对于明确基质金属蛋白酶及其抑制剂在重构中的机制非常重要。此次项目我们将利用广州市红十字会医院(暨南大学第四附属医院)的心脏病患者作为研究对象,通过了解心肌损伤以及手术后患者心肌基质重构情况,从MMPs和TIMps的动态平衡着手研究其对心肌基质的组织修复和再生作用,探寻影响心肌基质组织修复和再生的生物制剂和药物,为心肌损伤后基质重构造成的心肌肥大、增厚等引起的心力衰竭提供的有效的生物检测方法、新型检测蛋白、生物制剂以及药物治疗和预防。
1 材料与方法
1.1 临床资料
1.1.1 研究对象及分组 纳入2012年1月~2014年4月广州市红十字会医院行体外循环心脏手术的患者为研究对象。术前心功能分级(NYHA)Ⅱ~Ⅲ级、美国麻醉师协会分级(ASA)Ⅱ~Ⅲ级,术前均无风湿活动及冠心病史,术前1个月未使用激素及非甾体类抗炎镇痛药等。术前血红蛋白、凝血功能、电解质、肝、肾和肺功能均在正常范围,按照随机区组分组的方法根据进行的心脏手术不同,将研究对象分为3个组,第1组为先天性心脏病组(CHD组);第2组为风湿性心脏病组(RHD组);第3组为冠心病组(COR组),且术前经超声心动图检查,未见房室的大小改变,设其为对照组。
1.1.2 标本采集与测定
1.1.2.1 标本采集(ELISA)分别于术前采血。(1)用含有EDTA的真空管对入选病人进行静脉采血4~5 ml;(2)室温静置1 h;(3)离心,3000 r/min,15 min;(4)在垂直超净台内,用移液器将上清液移至1.5 ml离心管,及时盖上管盖。每个离心管移入l ml血浆。吸取液体时切勿过猛,以免引起污染,最后可适当留下一层少量上清液,以保证血浆的纯度,离心管和枪头均经过高温灭菌处理;(5)贴上标签,-80 ℃保存。
1.1.2.2 标本采集(Rt-PCR) 切除右心室内异常肌束,取约3 mm×3mm心肌组织立即置于冻存管内,贴上标签,置于液氮速冻,-80℃冰箱保存,标本经伦理委员会审核并批准。
1.1.2.3 标本采集(免疫组化法) 另取心肌组织,约2 mm×2 mm2与标签一起用纱布包好,大头针固定(固定大头针,避免损伤样本)。放入装有固定液的广口瓶中固定,常温保存。(所取心肌为右室异常肌束,经伦理委员会审核并批准)。
1.2 实验步骤
1.2.1 ELISA(1)确定本次检测所需的已包被抗体的酶标板孔数目;(2)分别设空白孔、标准孔、待测样品孔。空白孔加BSA(2%)0.l ml,余孔分别加标准溶液或待测样品0.l ml,轻轻混匀,酶标板盖上锡箔纸,37℃,120 min;(3)反应后用自动洗板机吸去酶标板内的液体,或甩去酶标板内液体,再对着吸水纸拍几下。洗涤2次;(4)将准备好的生物素抗体工作液按每孔0.l ml依次加入。37 ℃反应60 min;(5)PBS洗涤3次,每次浸泡1 min左右,甩干;(6)将准备好的ABC(底物)工作液按每孔0.l ml依次加入。37 ℃反应30 min;(7)PBS洗涤5次,每次浸泡1~2 min左右,甩干;(8)按每孔0.09 ml依次加入己在37℃平衡30 min的TMB显色液,37℃避光反应,反应过程中,要经常观察,当肉眼可见标准品的前3~4孔有明显的梯度蓝色,后3~4孔差别不明显时,即可加入TMB终止液0.l ml/孔。(显色反应最长不要超过30 min);(9)用酶标仪在 450 nm测定OD值;(10)根据样品的吸光值在坐标上找出对应的浓度。由于样品稀释了N倍,其实际浓度应该×N。
1.2.2 免疫组化方法测定心肌基质的胶原形态和分布(1)对切取心肌组织进行常规石蜡切片的制备;(2)进行HE染色,依次用二甲苯和酒精浸泡后,再依次用Harris苏木素液、伊红进行染色,酒精和二甲苯浸泡后用中性树脂封片;(3)用SP法进行免疫组化染色,常规脱水后,用PBS冲洗3次,每次3 min;根据抗体要求,对组织抗原进行修复;将切片加一滴3%H2O250 μl,室温下孵育10 min,PBS冲洗3次,每次10 min;依次加入抗体、聚合增强剂,PBS冲洗后甩去,加入DAB或者AEC显色液,待显微镜下显色为红色或者棕色时,蒸馏水清洗后,用苏木素复染0.1%盐酸酒精分化,后冲洗,PBS冲洗返蓝,用DAB显色,经梯度酒精脱水干燥后用中性树脂封片。
1.2.3 rt-PCR技术对心肌组织中mmps和timps的mRNA进行检测,查看其mRNA表达情况:(1)采用异硫氢酸胍—氯仿经典法进行RNA的提取;(2)cDNA的合成;(3)常规PCR反应;(4)荧光定量PCR反应,反应体系的配制严格按照试剂盒的操作顺序。
1.3 计算
以标准物的浓度为横坐标(对数坐标),OD值为纵坐标(普通坐标),在半对数坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。再利用SPSS17.0进行数据分析,运用多个实验组和对照组比较的Dunnett法检验,取α=0.05。
2 结果
2.1 CHD、RHD、COR三组的临床资料比较
经过统计学分析,三组患者在年龄、身高、体质量方面的差异无统计学意义(P<0.05)。排除年龄、身高、体质量对结果的影响。三组患者的超声心动图结果显示:经完全随机设计资料的方差分析,采用多个实验组与一个对照组比较的Dunnett法,按α=0.05水准,可认为CHD组的RAD、LVEF与COR组均数的差异有统计学意义,说明CHD组的RAD、LVEF较COR组已经发生了不同程度的改变;而RHD组的LAD、LVED、LVEF、IVS与COR组的均数差异有统计学意义,明RHD组的LAD、LVED、LVEF、IVS较COR组也已发生了不同程度的改变(表1)。
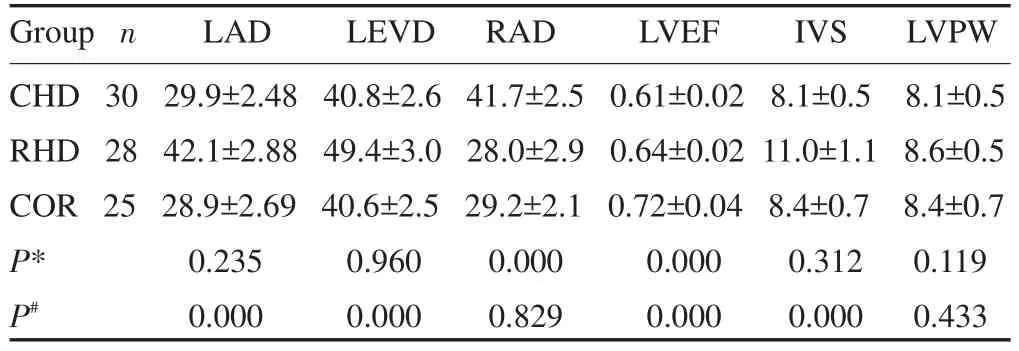
表1 三组患者的临床资料对比Tab.1 The clinical data of three groups patients
2.2 ELISA法对MMP-3、MMP-9、TIMP-1的检验结果(单位:μg/L)
通过对3组患者血液中基质金属蛋白酶的ELISA法检验,采用完全随机设计资料的方差分析,经多个实验组与一个对照组比较的Dunnett检验,按α=0.05水准,CHD组和PHD组血液中的MMP-3、MMP-9、TIMP-1含量较COR组差异有统计学意义(P<0.05,图1),可认为CHD组和PHD组血液中的MMP-3、MMP-9、TIMP-1含量较COR组高,而实验组中CHD组与PHD组间的差异无统计学意义(P>0.05),说明CHD组和PHD组心脏基质已发生了不同程度的改变与重构。
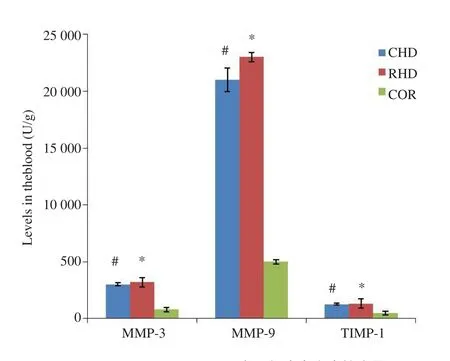
图1 MMP-3、MMP-9、TIMP-1在三组患者血中的含量CHD组与COR组比较,#P<0.05;PHD组与COR组比较,*P<0.05.Fig.1 The levels of MMP-3,MMP-9,TIMP-1 in three groups of patients with blood.
2.3 免疫组化检验结果
显微镜下MMP-3、MMP-9、TIMP-1呈弥漫性棕黄色或黄褐色颗粒。而正常心肌细胞则呈均匀、稀疏的浅褐色或粉红色颗粒。经过Image-proplus图像分析软件定量分析:A1、B1的阳性表达结果较C1高,差异显著,有统计学意义(P<0.05),镜下可见到A1、B1的棕黄色或黄褐色颗粒较C1组明显增多,且弥漫分布;同样A2、B2的阳性表达结果较C2高,差异有统计学意义(P<0.05),镜下弥漫性棕黄色或黄褐色颗粒较C2更加丰富;A3、B3的表达虽然较A1、B1、A2、B2要低,但是其阳性表达结果仍然高于C3,差异显著(P<0.05),镜下棕黄色或黄褐色颗粒仍较丰富,而C3则呈现弥漫浅褐色和粉红色颗粒(图2)。
2.4 PCR反应结果
经过聚合酶链反应定量检测,CHD组和PHD患者MMP-3、MMP-9、TIMP-1的mRNA呈现高表达。经多个实验组和一个对照比较的Dunnett法,Levene齐性检验,按α=0.10水准,3组资料的方差齐。按α=0.05水准,可认为CHD组和PHD组的MMP-3、MMP-9的mRNA表达高于COR组(表2)。
3 讨论
基质金属蛋白酶(MMPs)是一组能特异地降解细胞外基质成分的锌离子依赖的酶家族,在组织重构中起重要作用[6]。基质金属蛋白酶与基质金属蛋白酶抑制剂(TIMPs)是胶原代谢的主要调节物质,两者相互作用共同维持着心血管基质的分解与重构[7]。目前国内外对于心肌损伤后血管重建方面的研究比较深入,Hojo等[8]对急性心肌梗塞中基质金属蛋白酶的表达进行了大量的研究,得出了急性心肌梗塞时很多基质金属蛋白酶时升高的。Creemers等[9]对心衰进行研究时,发现一些金属蛋白酶抑制剂对于阻止心衰的进展、抑制心衰有很大帮助。这对SPinale等[10-14]在前期对于心肌细胞蛋白分子以及基因表达方面的基础研究起着极大的继承和发扬。这就为我们现在的研究给予了巨大的提示。
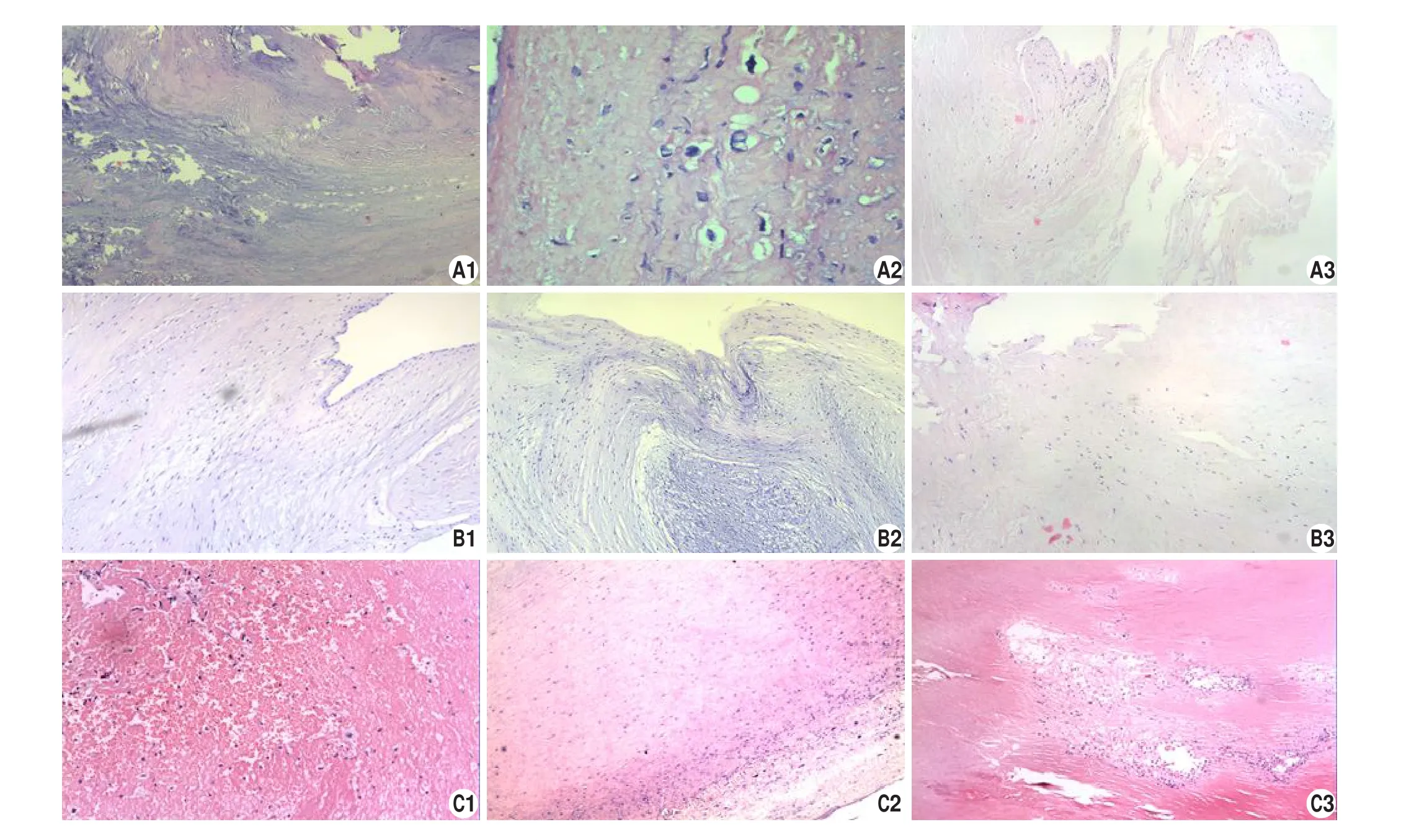
图2 MMP-3、MMP-9、TIMP-1的免疫组化形态分布A(CHD组)、B(PHD组)、C(COR)组,1(MMP-3)、2(MMP-9)、3(TIMP-1).Fig.2 The immunohistochemical species distribution of MMP-1、MMP-9、TIMP-1.
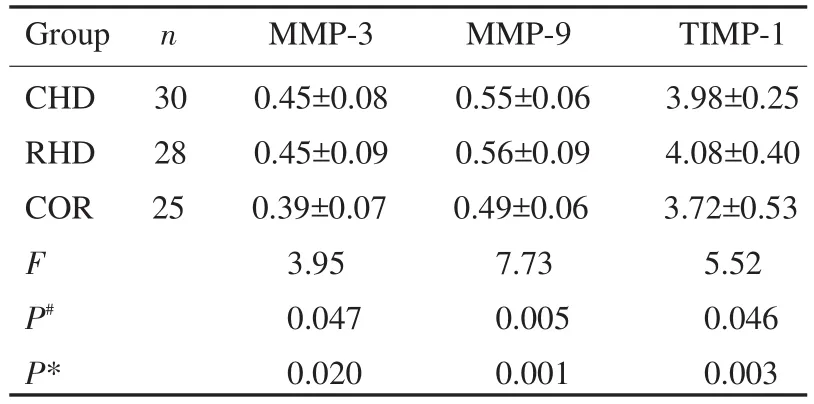
表2 三组患者的mRNA表达情况Tab.2 The mRNAexpression of three group
很多心脏疾病引起的心肌损伤、心脏手术,不可避免地使心肌受到了一定的损伤,虽然近年来心肌保护的研究取得了显著的效果,但是对于心肌损伤引起的各种并发症还是相对较多,检测手段还是相对单一,陈旧,繁杂,必须综合多方面检查和检验结果,而且最终的特异性并不是令人满意。目前对于MMPs和TIMPs的动态平衡在维持心肌细胞组织修复再生中的作用还缺乏前瞻性的研究,国内外对心肌损伤后引起的基质重构研究还处于初级阶段[15],因而对于新型检测手段、新型检测蛋白分子以及生物药物的研究势在必行,我们在前期的研究中,已经获得了满意的成绩。此次项目,我们将对心脏病患者进行MMPs和TIMPs的动态平衡的研究,试图探索MMPs和TIMPs的动态平衡在维持心肌细胞组织修复再生中的作用,从而寻找心肌损伤后基质重构的生物检测方法、新型检测蛋白、生物制剂以及药物治疗和预防。
在本次研究中,我们采用了多种方法对心肌损伤后导致的基质重构进行检测,从定性和定量两方面探讨了心肌基质降解和断裂的MMP-3、MMP-9蛋白在血液、组织中的表达,并且采用PCR技术对其mRNA的表达进行了定量的检测。同时对阻止和抑制心脏基质发生降解和重构的基质金属蛋白酶抑制剂TIMP-1进行定量、定性以及mRNA表达的检测。从全面的角度分析了MMP-1、MMP-9和TIMP-1在整个心肌基质变化过程中引起的量和质的变化。发现发生心脏基质重构的先天性心脏病组(CHD组)、风湿性心脏病组(PHD组)的MMP-3、MMP-9以及TIMP-1的表达都显著高于未发生心脏基质重构的冠心病组(COR组)。这就说明,基质金属蛋白酶及其抑制剂的动态平衡可能影响着心脏基质的降解和胶原的断裂。对维持心肌的形态和胶原的结构有着巨大的作用,如何把握住这一关键点,维持这一动态平衡,阻止心肌损伤后导致的心脏重构,找出基因表达的作用靶点,针对这一靶点或者蛋白分子研制出具有阻止和抑制心肌重构的药物或者类蛋白抑制剂,将成为我们进一步研究的动力和目标。
[1] Castro MM,Tanus-Santos JE.Inhibition of matrix metalloproteinases(MMPs)as a potential strategy to ameliorate hypertensioninduced cardiovascular alterations[J].Curr Drug Targets,2013,14(3):335-43.
[2] Berry E,Bosonea AM,Wang X,et al.Insights into the activity,differential expression,mutual regulation,and functions of matrix metalloproteinases and a disintegrin and metalloproteinases in hypertension and cardiac disease[J].J Vasc Res,2013,50(1):52-68.
[3] Bautista-Lopez NL,Morillo CA,Lopez-Jaramillo P,et al.Matrix metalloproteinases 2 and 9 as diagnostic markers in the progression to Chagas cardiomyopathy[J].Am Heart J,2013,165,4:558-66.
[4] Yabluchanskiy A,Li Y,Chilton RJ.Lindsey ML matrix metalloproteinases:drug targets for myocardial infarction[J].Curr Drug Targets,2013,14,3:276-86.
[5] Seizer P ST,Mt1-Mmp IR.MMP-9 and M-CSF during foam cell formation[J].Atherosclerosis,2010,209(1):51-7.
[6] Shu T,Zeng B,Ren X,et al.HO-1 modified mesenchymal stem cells modulate MMPs/TIMPs system and adverse remodeling in infarcted myocardium[J].Tissue Cell,2010,42(4):217-22.
[7]Tanus-Santos JE.Editorial:matrix metalloproteinases:drug targets in cardiovascular diseases[J].Curr Drug Targets,2013,14(3):275.
[8]Hojo Y,Ikeda U,UenoS,et al.ExPression of matrix metallo-Proteinases in Patients with acute myoeardial infaretion[J].J Pn Cire J,2001,65(3):71-5.
[9]Creemers EE,Cleutjens JP,Smits JF,et al.Matrix metalloproteinase inhibition after myocardial infarction:a new approach to prevent heart failure[J].Circ Res,2001,89(3):201-10.
[10]Spinale FG,Coker ML,Thomas CV,et al.Time-dependent changes in matrix metalloproteinase activity and expression during the progression of congestive heart failure:relation to ventricular and myocyte function[J].Circ Res,1998,82(4):482-95.
[11]Peterson JT,Li H,Dillon L,et al.Evolution of matrix metalloprotease and tissue inhibitor expression during heart failure progression in the infarcted rat[J].Cardiovasc Res,2000,46(2):307-15.
[12]Vineenti MP,White LA,Schroen DJ,et al.Regulation expression of thegene for matrix metallo Proteinase-l(collagenase):mRNA stability[J].Crit Rev Eukaryotic Gene ExPr,1996(6):391-411.
[13]Visse,Robert.Matrix MetalloProteinases and tissue inhibitors of MetalloProteinases:Strueture,Funetion,and Biochemistry[J].J Circ Res,2003(92):827-39.
[14]Wilson EM,Moainie SL,Baskin JM,et al.Region-and typespecific induction of matrix metalloproteinases in post-myocardial infarction remodeling[J].Circulation,2003,107(22):2857-63.
[15]Essa EM,Zile MR,Stroud RE,et al.Changes in plasma profiles of matrix metalloproteinases(MMPs)and tissue inhibitors of MMPs in stress-induced cardiomyopathy[J].J Card Fail,2012,18(6):487-92.