酶法降解坛紫菜多糖及其产物分析
韩莎莎,黄臻颖,沈照鹏,程 晓,王 鹏,江晓路,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.中国海洋大学医药学院,山东 青岛 266003)
酶法降解坛紫菜多糖及其产物分析
韩莎莎1,黄臻颖1,沈照鹏2,程 晓1,王 鹏1,江晓路1,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.中国海洋大学医药学院,山东 青岛 266003)
以单因素试验为基础,通过正交试验确定了坛紫菜多糖的最佳酶解工艺条件为:酶解温度40 ℃、ph 6.0、酶解时间3 h。在此条件下,坛紫菜多糖酶解后的还原糖质量浓度为(1.42±0.12)mg/mL。利用液相色谱和质谱技术对酶解产物进行了组分分析和抗氧化活性检测。结果表明:酶解产物S1和S2均以半乳糖为主,半乳糖在两样品中分别占93.0%、90.5%,S1和S2的单糖组成相差不大。S1和S2都具有抗氧化活性,尤其对·Oh的清除作用明显,且抗氧化活性大小S1>S2。聚合度在10~16内的偶数糖比聚合度为4~6的坛紫菜寡糖清除·Oh和O2-·的能力好,说明酶解产物的抗氧化活性与其聚合度有关,只有处于特定聚合度范围内才具有明显的抗氧化活性。
坛紫菜多糖;正交试验;组分分析;聚合度;抗氧化活性
我国是世界上紫菜第一大生产国和出口国。目前市售紫菜主要以养殖紫菜为主,其中坛紫菜(Porphyra haitanensis)占我国养殖紫菜总量的80%以上[1],主要产于福建、浙江等长江以南地区。目前紫菜主要应用于食品领域,加工方式简单,营养成分难以发挥功能,造成了海洋资源的巨大浪费,因此开发新的加工方式,增加紫菜的附加值成为海洋经济时代的重要课题。已有的研究表明坛紫菜的主要成分为蛋白质(占干质量的34.48%~37.21%)和多糖(占干质量的20%~40%),同时还含有少量的脂肪(0.5%~2.09%)、无机盐、维生素等[2]。紫菜不仅具有食用价值,同时还具有重要的药用价值[3]。坛紫菜多糖(porphyran)具有抗氧化、免疫调节、抗肿瘤等活性[4-6],它是由半乳糖、岩藻糖、木糖、鼠李糖等构成的含硫酸基的大分子多糖[7],由于其黏度高、水溶性低、不易被吸收,且直接注射对机体毒性大[8],使得其在医药保健品等领域的应用受到限制。研究发现通过物理化学等方法将紫菜多糖降解为分子质量较低的紫菜寡糖,增加其溶解性,可大大提高其使用价值和应用范围[9]。
海藻寡糖因其良好的溶解性、抗氧化、抗肿瘤等活性,逐渐成为近代科学研究的热点[10-11]。抗氧化活性是海藻寡糖最重要的性质之一,现代研究表明海藻寡糖可以通过清除自由基保护机体免受氧化损伤,达到预防衰老、癌症、类风湿性关节炎等疾病的目的[12-13]。但目前有关坛紫菜寡糖抗氧化活性的研究尚未见报道,人们对于坛紫菜多糖降解后抗氧化活性的变化还不清楚。王长云等[14]指出多糖的抗病毒活性与其分子质量有关,Sun Liqin等[15]研究了紫球藻多糖的分子质量与免疫调节和抗肿瘤活性的关系,证实了多糖活性和聚合度存在关联。而目前坛紫菜多糖降解物的活性及其与聚合度的关系尚不明确。因此,对坛紫菜多糖降解物结构和活性的研究具有重要的理论和现实意义。本实验采用酶解法对坛紫菜多糖进行降解,以还原糖浓度的高低作为指标,探究紫菜多糖的最佳酶解工艺,然后利用高效液相色谱(high performance liquid chromatography,hPLC)和电喷雾电离质谱(electrospray ionization mass spectrometry,ESI-MS)技术对降解物的结构和聚合度进行研究,并且对不同聚合度的降解物进行抗氧化活性的考察,以期为坛紫菜的开发利用提供技术支持,为新型化妆品、海洋天然药物及功能性食品的开发提供有力依据。
1 材料与方法
1.1 材料与试剂
坛紫菜购于福建泉州,于50 ℃烘干至质量恒定,高速粉碎机粉碎,过80 目筛,保存备用。
琼胶酶,分子质量约35 kD,由本实验室保存的高产琼胶酶菌株Pseudoalteromonas sp.QJ97发酵并经分离纯化制得。
苯酚(分析纯) 天津广成试剂公司;无水乙醇(分析纯) 上海埃彼公司;丙酮(分析纯) 广州才允多化工公司;DNS试剂[16]。
1.2 仪器与设备
hhS21-4电热恒温水浴锅 北京长安科学仪器厂;ShB-Ⅲ循环水式多用途真空泵 郑州长城仪器厂;FD-1A-50真空冷冻干燥机 西安太康生物科技有限公司;布鲁克amaZon SL离子阱电喷雾质谱 德国布鲁克道尔顿公司;UV751GD紫外-可见光分光光度计 上海分析仪器总厂。
1.3 方法
1.3.1 琼胶酶溶液的制备
称取适量冻干的琼胶酶,溶解于20 mmol/L的磷酸盐缓冲液中,即为琼胶酶溶液(酶活力为620 U/mL),保存于4 ℃冰箱备用。
1.3.2 坛紫菜多糖的提取
取烘干后的坛紫菜干粉,按照1∶40(m/V)加入蒸馏水,混匀,100 ℃加热4 h,4 800 r/min离心10 min,加3 倍体积无水乙醇,4 ℃静置,4 800 r/min离心10 min,去上清,将沉淀溶于适量蒸馏水中,加入一定量体积分数70%三氯乙酸溶液(至体积分数达到4%)沉淀蛋白质,4 ℃放置过夜,离心浓缩得坛紫菜多糖溶液。此时,多糖溶液的质量浓度为5.56 mg/mL。
1.3.3 还原糖质量浓度的计算
采用DNS比色法[17]。
1.3.4 坛紫菜多糖得率的计算
总糖质量浓度的测定:采用苯酚-硫酸比色法[18]。

式中:ρ1为样品糖溶液的总糖质量浓度/(mg/mL);ρ2为样品糖溶液的还原糖质量浓度/(mg/mL);V为样品糖溶液的体积/mL;m为坛紫菜干质量/mg。
1.3.5 酶解工艺优化
1.3.5.1 酶添加量对坛紫菜多糖降解效率的影响
取等量的坛紫菜多糖溶液,分别加入体积分数为0、2%、4%、6%、8%、10%的琼胶酶溶液,充分搅拌后于35 ℃反应1 h,立即灭活琼胶酶,测定还原糖的质量浓度。
1.3.5.2 酶解温度对坛紫菜多糖降解效率的影响
取等量的坛紫菜多糖溶液,分别置于30、35、40、45、50 ℃预热10 min,按照最佳添加量加入琼胶酶,反应1 h,立即灭活琼胶酶,测定还原糖的质量浓度。
1.3.5.3 pH值对坛紫菜多糖降解效率的影响
改变坛紫菜多糖溶液的pH值,按照最佳添加量加入琼胶酶,置于最佳酶解温度,反应1 h,立即灭活琼胶酶,测定还原糖的质量浓度。
1.3.5.4 酶解时间对坛紫菜多糖降解效率的影响
取等量的坛紫菜多糖溶液,按照最佳条件处理,分别酶解0、0.5、1、2、3、4 h,立即灭活琼胶酶,测定还原糖的质量浓度。
1.3.5.5 正交试验
在单因素试验的基础上,确定影响酶解液还原糖质量浓度的关键因素,选择较优的水平进行正交试验,以期确定最佳的水平。
1.3.6 坛紫菜多糖酶解产物的制备
取适量坛紫菜多糖,加入体积分数为4%的琼胶酶溶液,40 ℃酶解6 h后,煮沸5 min,冷却,加入1.5 倍无水乙醇,4 ℃静置2 h,4 800 r/min离心10 min,弃去大分子多糖和酶蛋白,上清浓缩再加入3 倍乙醇,静置沉淀离心,上清液浓缩后加4 倍乙醇,离心得沉淀S1,上清浓缩后加入10 倍乙醇,静置,4 800 r/min离心10 min,得沉淀S2,样品透析除盐,冻干备用。
1.3.7 酶解产物的hPLC分析
将坛紫菜多糖的酶解产物S1进行柱前衍生(1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP),然后进行色谱分析。色谱条件:色谱仪:Agilent 1200 Series 高效液相色谱仪;色谱柱为ZORBAX Eclipse XDB-C18(15 cm×4.6 mm,5 µm);流速1.0 mL/min;进样量20 μL;检测器为紫外检测器(VwD),波长254 nm,柱温及检测器温度设定为25 ℃。
1.3.8 酶解产物的ESI-MS分析
分别取少量S1和S2,加乙腈溶解后,取2 µL样品进行高分辨率负离子模式质谱分析。毛细管电压:-140 V;质量扫描范围:m/z 100~2 000。
1.3.9 抗氧化活性的测定
·Oh清除能力采用Smirnoff等[19]的方法测定,略有改进。

式中:A0为蒸馏水代替多糖溶液的空白对照的吸光度;Ai为样品吸光度;Ai0为多糖本底吸光度。

式中:A0为蒸馏水代替多糖溶液的空白对照的吸光度;Ai为样品吸光度;Ai0为多糖本底吸光度。
2 结果与分析
2.1 酶解工艺优化
2.1.1 单因素试验


图1 酶解条件对坛紫菜多糖降解效率的影响Fig.1 Effect of enzymatic hydrolysis conditions on the degradation efficiency of Porpyra haitanensis polysaccharide
由图1a可知,随着琼胶酶添加量的增加(0~4%),坛紫菜多糖降解液中还原糖质量浓度逐渐增加。添加量高于4%时,还原糖质量浓度变化不大。琼胶酶价格昂贵,添加量过大会增加生产的成本,因此选择4%为最适的酶添加量。酶有特定的反应温度,温度过高或过低,酶活力都会有不同程度的损失。由图1b可知,35~45 ℃,还原糖产量较高,酶活性较好,40 ℃时还原糖质量浓度最高。因此,琼胶酶适宜的酶解温度为40 ℃,这与大多数有关琼胶酶的报道一致[21]。图1c显示,ph值低于或高于6.0,还原糖质量浓度都有不同程度的降低。酶解反应适宜的ph值为6.0,并且琼胶酶在中性或碱性环境下酶活损失较大,坛紫菜多糖应调至微酸性。由图1d可知,0~3 h,还原糖质量浓度增长迅速,3 h后几乎不再增加。对于工业生产来说,时间越长,成本越高。因此,酶解坛紫菜多糖的适宜时间为3 h。在最佳工艺条件下酶解坛紫菜多糖所得的酶解液中还原糖的质量浓度达到(1.13±0.18)mg/mL。
2.1.2 正交试验
选择酶解温度、ph值和酶解时间三因素进行L9(34)正交试验设计,试验设计及结果见表1。三因素对还原糖质量浓度的影响大小为ph值>酶解温度>酶解时间,其中,ph值影响较显著。最佳的酶解工艺条件为A2B2C2,即酶解温度40 ℃、ph 6、酶解时间3 h。在该条件下进行酶解反应得到的坛紫菜多糖降解液中还原糖质量浓度为(1.42±0.12) mg/mL。

表1 坛紫菜多糖酶解条件的正交试验设计及结果Table 1 Orthogonal array design with experimental results
2.2 HPLC分析
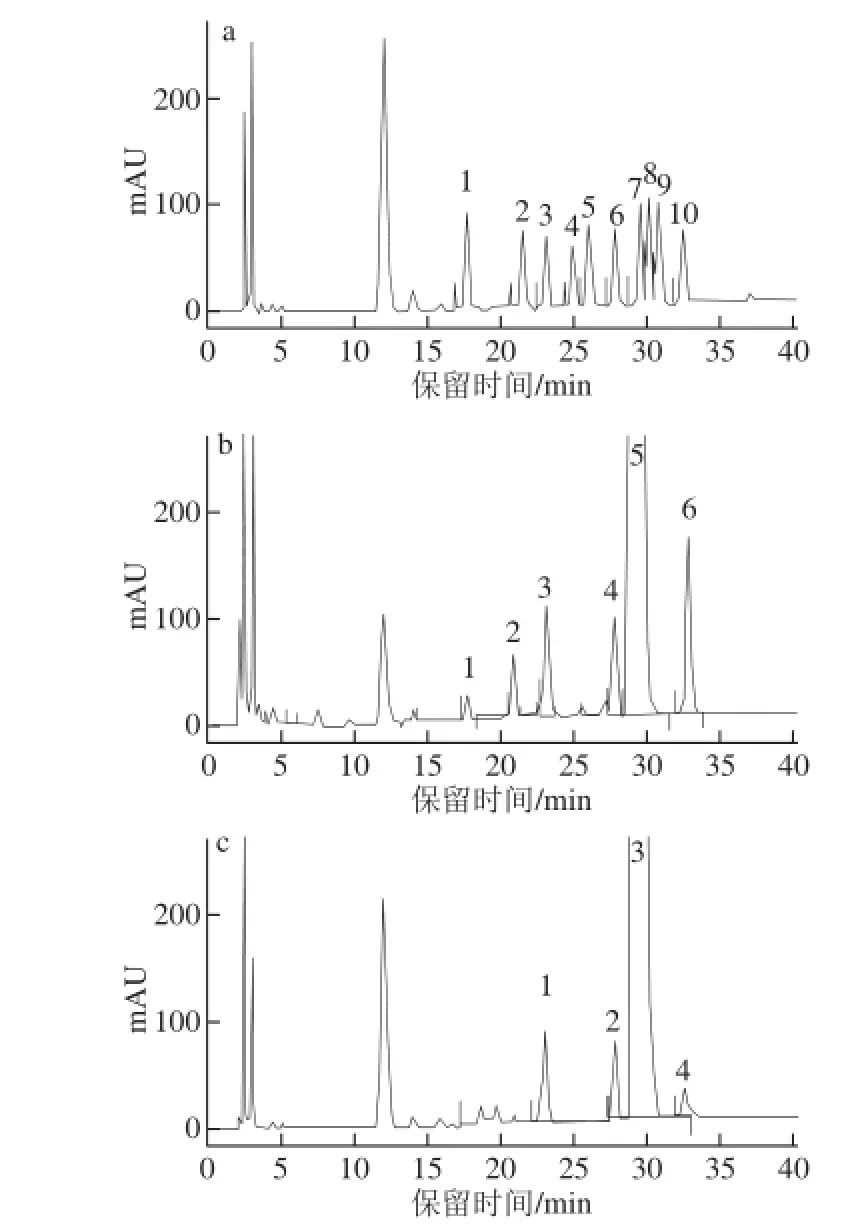
的HPLC图Fig.2 High performance liquid chromatograms of S1and S2图2组分S1和S2
由图2可知,S1中单糖组分甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、岩藻糖物质的量比为0.4∶0.9∶1.7∶1.4∶92.7∶2.9,各组分含量分别为:半乳糖93.0%、岩藻糖2.6%、葡萄糖醛酸1.8%、葡萄糖1.4%、鼠李糖0.8%、甘露糖0.4%。S2中单糖组分葡萄糖醛酸、葡萄糖、半乳糖、岩藻糖物质的量比为4.7∶2.9∶0.9∶1.5,各组分含量分别为:半乳糖90.5%、葡萄糖醛酸5.0%、葡萄糖3.1%、岩藻糖1.4%。由此可知,坛紫菜酶解产物S1和S2主要以半乳糖作为糖结构单元通过糖苷键连接而成,且单糖组成相差不大。
2.3 质谱解析

图3 组分S(b)的ESI-MS图Fig.3 ESI-MS spectra of S11(a)和S2(b)(a) and S2
结合高效液相色谱结果以及紫菜多糖的结构[22],解析ESI-MS图谱(图3a)得知,主要的三电荷峰m/z 511.08、613.11、715.14和817.17分别是十糖、十二糖、十四糖和十六糖的离子峰,主要的双电荷峰m/z 871.19和1 024.23分别是十糖和十二糖的离子峰。综上,S1由十糖、十二糖、十四糖、十六糖组成,琼胶酶以二糖作为酶切单元。由图3b中主峰的荷质比m/z可推知,单电荷峰m/z 727.15和1 033.24分别为带硫酸基的四糖和六糖,双电荷峰有m/z 416.57、427.59和569.62,分别为乙酰化的五糖,硫酸化的五糖和乙酰化的七糖。经ESI-MS分析S2主要是聚合度为4~6的寡糖的离子峰。说明样品S2中主要有四糖、五糖、六糖,另有少量二糖、七糖。
2.4 酶解产物的抗氧化能力
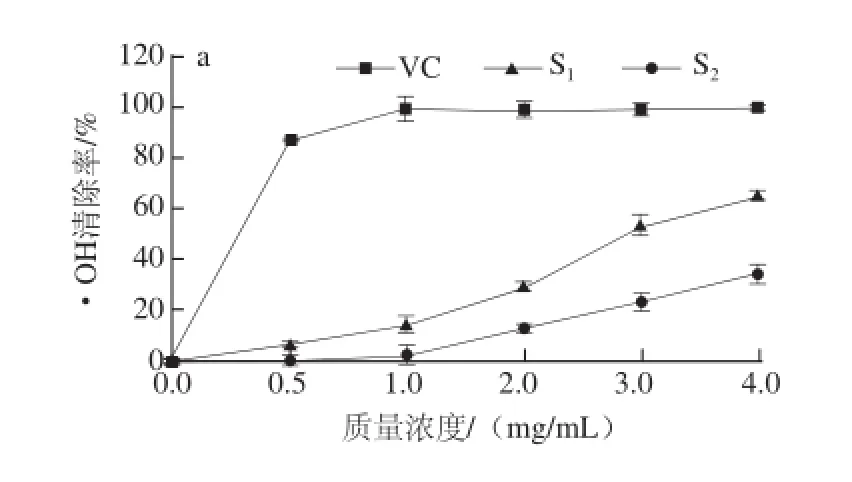
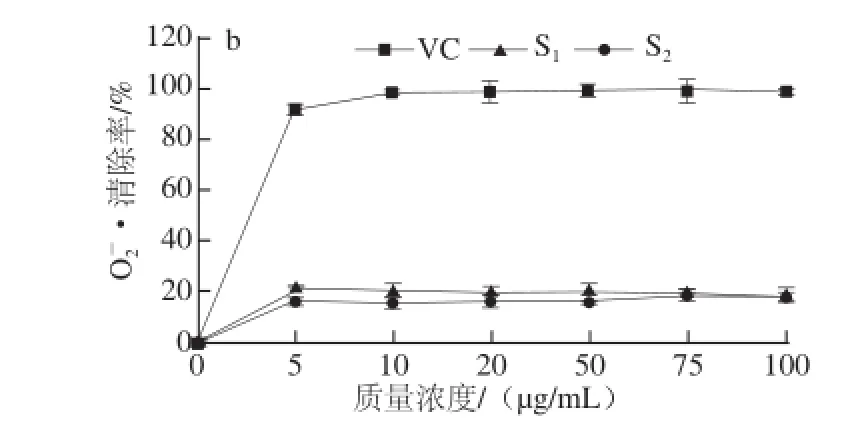
·的清除作用Fig.4 Scavenging effects of S1and S2on hydroxyl and superoxide anion radicals图4S1和S2对·OH和O2
由图4a可知,样品质量浓度低于1 mg/mL,S1和S2对·Oh几乎没有清除作用,质量浓度1~4 mg/mL,两样品对·Oh的清除能力随样品质量浓度的增大显著提高,与S2相比,S1增幅较大。质量浓度达到4 mg/mL,S1的清除率达到65.35%,S2的清除率为34.62%。S1清除·Oh的IC50为2.86 mg/mL。由图4b可知,两样品对O2-·都存在一定的清除作用,质量浓度在0~5 μg/mL时,S1和S2对O2-·的清除能力随样品质量浓度的增加而增加,质量浓度高于5 μg/mL时,两样品对O2-·的清除能力变化不大。S1对O2-·的清除能力比S2更明显。
3 结 论
本研究通过单因素和正交试验确定了紫菜多糖酶解的最佳工艺条件:酶解温度40 ℃、ph 6.0、酶解时间3 h。优化后还原糖产量明显增加,琼胶酶的用量大大降低,并且降低生产成本的同时缩短了生产周期。本研究为坛紫菜深加工提供了一种新的方法,为坛紫菜寡糖的规模化生产提供了理论依据。
通过hPLC对S1和S2进行了单糖组成分析,主要成分都为半乳糖,含量分别为93.0%、90.5%。岩藻糖、葡萄糖、鼠李糖等成分含量很低。该结果与穆凯峰[7]和赵婷婷[23]等对坛紫菜多糖结构的研究结果基本一致。Zhang Zhongshan等[24]测得的坛紫菜多糖的清除·Oh的IC50为2.10 mg/mL,清除O2-·的IC50为18 μg/mL,姚兴存等[25]提取的条斑紫菜蛋白清除·Oh的IC50为1.481 mg/mL。本实验结果表明,酶解产物S1和S2对·Oh和O2-·存在清除作用,尤其对自由基中表现最活跃的·Oh效果明显。结合S1和S2的组分分析,聚合度在10~16范围内的偶数糖比聚合度4~6的坛紫菜寡糖抗氧化能力强,说明坛紫菜多糖经酶解后,只有特定聚合度范围内的坛紫菜降解物才具有明显的自由基清除作用,目前对这一现象的原因还不清楚,尚需进一步探究。对比坛紫菜多糖降解前后的溶解度变化可知,坛紫菜多糖在室温下几乎不溶,S1的溶解度约为10 g/100 g,S2的溶解度远高于10 g/100 g,琼胶酶处理后的坛紫菜多糖溶解性会大幅提高,该特性表明坛紫菜多糖降解物在药品、保健品及化妆品等领域具有的广阔的应用前景。与机体外实验相比,寡糖在生物体内代谢较为复杂,其在生物体内的功效仍需进一步研究。
[1] 杨惠, 茅云翔, 孔凡娜, 等. 紫菜EST-SSR筛选及其在遗传多样性分析中的实用性[J]. 中国海洋大学学报: 自然科学版, 2009, 39(2): 265-270.
[2] 赵国玲, 刘承初, 谢晶, 等. 坛紫菜不同溶剂组分的抗氧化活性[J].食品科学, 2010, 31(17): 186-191.
[3] ISAKA S, CHO K, NAKAZONO S, et al. Antioxidant and antiinflammatory activities of porphyran isolated from discolored nori (Porphyra yezoensis)[J]. International Journal of Biological Macromolecules, 2015, 74: 68-75.
[4] ZHANG Quanbin, LI Ning, ZHOU Gefei, et al. In vivo antioxidant activity of polysaccharide fraction from Porphyra haitanesis (Rhodephyta) in aging mice[J]. Pharmacological Research, 2003, 48(2): 151-155.
[5] BhATIA S, RAThEE P, ShARMA K, et al. Immuno-modulation effect of sulphated polysaccharide (porphyran) from Porphyra vietnamensis[J]. International Journal of Biological Macromolecules, 2013, 57: 50-56.
[6] GUO Tingting, XU Hongli, ZHANG Luxi, et al. In vivo protective effect of Porphyra yezoensis polysaccharide against carbon tetrachloride induced hepatotoxicity in mice[J]. Regulatory Toxicology and Pharmacology, 2007, 49: 101-106.
[7] 穆凯峰, 吴永沛. 坛紫菜多糖的分离纯化及其组成分析[J]. 中国食品学报, 2011, 11(1): 159-164.
[8] YOSHIHIRO Y, NUNOME T, YAMAUCHI R, et al. Structure of an exocellular polysaccharide of Lactobacillus helveticus TN-4, aspontaneous mutant strain of Lactobacillus helveticus TY1-2[J]. Carbohydrate Research, 1995, 275(2): 319-332.
[9] 沈照鹏, 刘蓓, 高笑. 紫菜精素饮料的研制[J]. 食品科技, 2011, 36(12): 103-107.
[10] 袁华茂. 卡拉胶寡糖与衍生物的制备及生物活性研究[D]. 青岛: 中国科学院海洋研究所, 2005.
[11] 高玉杰, 吕海涛. 酸法降解浒苔多糖及其清除羟自由基活性研究[J]. 食品科学, 2013, 34(16): 62-66. doi:10.7506/spkx1002-6630-201316013.
[12] ZHOU Cunshan, YU Xiaojie, ZHANG Youzuo, et al. Ultrasonic degradation, purification and analysis of structure and antioxidant activity of polysaccharide from Porphyra yezoensis Udea[J]. Carbohydrate Polymers, 2002, 87(3): 2046-2051.
[13] SUN Yujiao, YANG Bingying, WU Yanmin, et al. Structural characterization and antioxidant activities activities of κ-carrageenan oligosaccharides degraded by different methods[J]. Food Chemistry, 2015, 178(1): 311-318.
[14] 王长云, 管华诗. 多糖抗病毒作用研究进展I.多糖抗病毒作用[J]. 生物工程进展, 2000, 20(1): 17-21.
[15] SUN Liqin, WANG Ling, ZHOU Yan. Immunomodulation and antitumor activities of different-molecular-weight polysaccharides from Porphyridium cruentum[J]. Carbohydrate Polymers, 2012, 82(2): 1206-1210.
[16] 王俊丽, 聂国兴, 曹香林, 等. 不同DNS试剂测定木糖含量的研究[J].食品研究与开发, 2010, 31(7): 1-4.
[17] 赵凯, 许鹏举, 谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008, 29(8): 534-536.
[18] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1994: 10-12.
[19] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1057-1060.
[20] 杨岚, 李华峰, 刁海鹏, 等. 蒲公英花中总酚酸和总黄酮含量测定及其抗氧化性能研究[J]. 食品科学, 2011, 32(17): 161-163.
[21] FENG Zehua, LI Mengying. Purification and characterization of agarase from Rhodococcus sp. Q5, a novel agarolytic bacterium isolated from printing and dyeing wastewater[J]. Aquaculture, 2013, 372/375: 74-79.
[22] ZHANG Quanbin, LI Ning, LIU Xiuguang, et al. The structure of a sulfated galactan from Porphyra haitanensis and its in vivo antioxidant activity[J]. Carbohydrate Research, 2004, 339(1): 105-111.
[23] 赵婷婷. 不同分子量坛紫菜多糖的制备及抗衰老活性研究[D]. 青岛: 中国科学院海洋研究所, 2007.
[24] ZHANG Zhongshan, WANG Feng, WANG Xiaomei, et al. Extraction of the polysaccharides from pive algae and their potential antioxidant activity in vitro[J]. Carbohydrate Polymers, 2010, 82(1): 118-121.
[25] 姚兴存, 舒留泉, 盘赛昆, 等. 条斑紫菜蛋白提取与抗氧化活性[J].食品科学, 2012, 33(20): 113-118.
Enzymatic Degradation of Polysaccharide from Porphyra haitanensis and Analysis of Its Products
HAN Shasha1, HUANG Zhenying1, SHEN Zhaopeng2, CHENG Xiao1, WANG Peng1, JIANG Xiaolu1,*
(1. College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China; 2. School of Medicine and Pharmacy, Ocean University of China, Qingdao 266003, China)
The optimal enzymatic hydrolysis conditions for Porphyra haitanensis polysaccharide were determined as 40 ℃, 6.0 and 3 h for hydrolysis temperature, pH and hydrolysis time, respectively, by single factor and orthogonal array design. The yield of reducing sugar was (1.42 ± 0.12) mg/mL under these optimized conditions. The saccharide composition of the two hydrolysate fractions S1and S2was analyzed by liquid chromatography and electrospray ionization mass spectrometry and their antioxidant activity was evaluated. The results revealed that S1and S2had similar composition with galactose as the major component (accounting for 93.0% and 90.5%, respectively), and that both of them had good antioxidant activity, especially for hydroxyl radical scavenging activity. In addition, the degradation products with even degree of polymerization (DP) of 10–16 was more effective in scavenging superoxide anion and hydroxyl radicals than the oligosaccharides with a DP of 4–6 suggesting the relevance of their antioxidant activity to DP, and considerable antioxidant activity existed only in a specific range of DP.
polysaccharide from Porphyra haitanensis; orthogonal array design; composition analysis; degree of polymerization; antioxidant activity
TS254.1
A
1002-6630(2015)21-0145-05
10.7506/spkx1002-6630-201521028
2015-01-10
国家海洋局海洋公益性行业科研专项(201105028-4)
韩莎莎(1989—),女,硕士研究生,研究方向为海洋资源微生物及生物工程。E-mail:hanshahanbing@163.com
*通信作者:江晓路(1959—),女,教授,本科,研究方向为应用微生物。E-mail:jiangxl@ouc.edu.cn

