细菌菌群在宿主抗真菌防御机制中的研究进展
张杰 刘维达(北京协和医学院中国医学科学院皮肤病研究所真菌科,南京210042)
细菌菌群在宿主抗真菌防御机制中的研究进展
张杰 刘维达
(北京协和医学院中国医学科学院皮肤病研究所真菌科,南京210042)
【摘要】人类体表及体内存在着共生的丰富多样的大量微生物,即微生物群落。受遗传和免疫因素的影响,每个个体都有其特定的“微生物指纹”[1⁃2]。随着分子技术的发展,这些群落的多样性组成逐渐被揭开。近年来,微生物群落在免疫系统中发挥的作用受到了重视,这其中就包括抗真菌的宿主防御。细菌群落可通过定植抗力、抑制念珠菌毒力、维持上皮完整性、调节黏膜抗真菌免疫应答等方面参与抗真菌宿主防御。
【关键词】抗真菌宿主防御;念珠菌;微生物群落;真菌群落;免疫调节
人体体表及体内(口腔、咽喉、皮肤、胃肠道、泌尿生殖道远端)等部位存在大量与人类长期共栖共生的微生物群落,包括细菌、古菌、真菌和病毒等。狭义的微生物群落是指身体各部位的细菌菌落,目前大多数研究也是针对细菌群落展开的。然而,随着新一代测序技术的不断发展应用,人们对人体各部位微生物群落的多样性及丰度有了新的认识。真菌群落虽然数量较少,但也是微生物群组的重要组成成分。微生物群落不仅在人体代谢过程中起重要作用,对于免疫系统的正常运作也是必不可少的,这其中就包括了抗真菌的宿主防御。本文就真菌群落的组成、细菌菌群在抗真菌宿主防御方面发挥的作用以及细菌⁃宿主⁃真菌间相互作用的研究近况进行综述。
1 人类共生真菌群落
细菌几乎构成了我们人体各部位的全部微生物负荷,相比之下,真菌的数量则小得多,但他们对人体健康也有着非常重要的影响,例如,真菌是人体潜在的病原体(如念珠菌属),并作为某些炎症性疾病的辅助因子发挥作用[3⁃4]。随着更为敏感的检测技术如真菌18S rDNA和(或)ITS序列高通量测序和分析的应用,真菌菌群研究越来越受到了关注。在此,我们总结了口腔、肠道、女性泌尿生殖道、皮肤、呼吸道的主要共生真菌(见表1)。
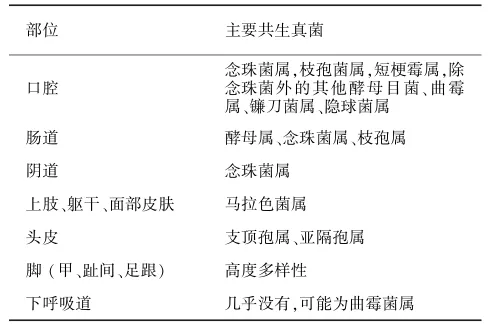
表1 正常人体不同部位的主要共生真菌Tab.1 Dominant fungal species at different sites of normal people
1.1 口腔真菌菌落
一项基于培养的研究表明,来自于同一城市的172名健康志愿者中,25%~60%有口腔真菌的定植(几乎全部为念珠菌菌种),且定植率与年龄呈正相关[5]。而在另一项研究中,研究者分析了不同种族背景的20名健康志愿者的口腔冲洗液,结果发现真菌存在于所有个体中[6]。在这些个体中,共检测到101种真菌,其中,念珠菌最为普遍(75%的参与者均检测到),其次是枝孢菌属(65%),短梗霉属(50%),除念珠菌外的其他酵母菌目(50%)、曲霉属(35%)、镰刀菌属(30%)及隐球菌属(20%)。另一项12名健康志愿者的检测结果与上述类似,其中,毕赤菌属为酵母目中的主要种类[7]。口腔不同部位如牙龈、牙菌斑、腭、舌、喉咙的真菌群落差异仍有待进一步研究。
1.2 肠道真菌群落
关于肠道真菌菌落的最新研究来自于Hoff⁃mann等人[8],他们在98名健康人粪便标本中都检测到了真菌,可归为两个门,即子囊菌门和担子菌门。在属水平,酵母属(89%)、念珠菌属(57%)和枝孢属(42%)最多。真菌负荷量与普氏菌/拟杆菌比例呈正相关。1.3 阴道真菌群落
在494名高加索无症状育龄妇女中,使用焦磷酸测序法共检测到了196个操作分类单元(OTU),在种类繁多的定植真菌物种中,念珠菌属为优势菌。70%的样本中检测到了念珠菌,其中82%为白念珠菌[9]。我国也有学者用类似方法检测了39名健康女性阴道真菌,念珠菌阳性克隆子比例占41.18%[10]。
1.4 皮肤真菌群落
马拉色菌菌种构成了正常人群面部及前臂真菌群落的优势菌(随时间推移相对稳定的菌种,且有宿主特异性)[11⁃12]。非马拉色菌及丝状真菌构
成了面部常驻真菌群落的20%。在头皮部位,枝顶孢属为优势菌,而马拉色菌丰度相对较低[13]。Keisha Findley等人检测了10名健康志愿者的14个部位的真菌群落。其中,11个躯干部位以及上肢基本被马拉色菌属所占据,共检出11个种,在这11个种范围内,不同部位菌种组成互不相同。而在3个足部部位即足跟、趾甲及足趾间则展现出了高度多样性的真菌群落。皮肤的生理特点及部位差异可能塑造了不同的真菌群落[14]。
1.5 呼吸道真菌群落
Carpagnano等[15]分别对平均年龄65岁的健康志愿者和肺癌患者的呼出气体冷凝液及支气管肺泡灌洗液进行培养,结果发现健康志愿者标本无菌生长,而肺癌患者可检测到黑曲霉、褐黄曲霉及部分青霉菌属真菌。同时使用核酸测序法对健康志愿者肺泡灌洗液进行检测,也几乎检测不到真菌定植。
2 微生物群落和免疫系统之间的相互作用
2.1 细菌⁃真菌相互作用
念珠菌是条件致病菌,为人类正常菌群,正常情况下与机体处于共生状态。但在某些因素影响下,如黏膜屏障完整性的破坏、宿主的免疫功能受损、真菌毒力增强等,可转为致病状态,引起皮肤、黏膜感染甚至威胁生命的系统念珠菌感染。
细菌的定植抗力 黏膜表面细菌的竞争性驻留对潜在病原微生物如真菌病原体的入侵具有防御作用。一项国外研究分离了1 000名健康绝经前妇女的3种乳酸杆菌菌株,通过体外研究的方法证实了他们可释放H2O2和杆菌素样物质,共同抑制了病原真菌的生长[16]。
抑制酵母⁃菌丝转换 铜绿假单胞菌和粪肠球菌可抑制菌丝的形态形成,使其维持在共生状态[17]。乳酸杆菌是存在于人类肠道、阴道非常重要的一大类常驻菌,其无氧酵解的副产物短链脂肪酸(SCFAs),已被证明可抑制白念珠菌出芽繁殖及菌丝生长[18]。另外,乳酸杆菌还可降低阴道pH值,从而抑制酵母相向菌丝相的转化,阻止了潜在的念珠菌相关疾病[19]。
维持上皮完整性 SCFAs通过诱导肠道上皮细胞产生抗菌肽LL⁃37,参与维持了上皮屏障的完整性[20⁃21]。一项以小鼠为模型的研究发现,固有层树突状细胞CD103(+)CD11b(+)亚群与细菌鞭毛蛋白相互作用后将大量产生IL⁃23,从而诱导IL⁃22依赖性C型凝集素RegⅢγ的产生,进一步证明了细菌可诱导上皮防御作用增强[22]。此外,小鼠肠道正常细菌可影响肠道黏液层,增强上皮机械防御作用[23]。
免疫缺陷的存在是真菌从共生状态转向病原状态的另一个重要因素。目前认为,免疫系统的完整及细菌的保护作用(定植抗力和维持上皮屏障功能完整)共同影响念珠菌的定植或侵入。例如,在一个胃肠道念珠菌定植的小鼠模型中,只有中性粒细胞减少和黏膜损伤共同作用才能形成真菌血症,两者单方面作用均不能引起真菌的病理学模型[24]。
2.2 微生物群落对于宿主抗真菌免疫防御的影响
最近的一项研究从某种程度上阐明了宿主、细菌群落和抗真菌免疫之间复杂而多向的相互作用。该研究比较了慢性黏膜念珠菌病(CMC)、高IgE综合症(HIES)患者和健康对照组的5个不同部位的皮肤微生物群落,结果表明与正常人相比,CMC 和HIES患者正常菌群数量(如棒状杆菌属)减少,而革兰阴性杆菌,尤其是假单胞菌属数量增多,该菌属在接下来的外周血单核细胞刺激试验中可抑制对抗白念珠菌和金黄色葡萄球菌的细胞因子,而正常棒状杆菌则不会产生上述抑制。这项研究表明了STAT1和STAT3基因突变不只是直接影响Th1和Th17免疫应答,还可造成皮肤菌群的变化,间接地使抗病原微生物免疫缺陷更为严重[25]。另一项在免疫缺陷患者(主要是HIES患者)中进行的研究与上述研究结论类似,该研究证实了免疫缺陷患者皮肤正常菌群如马拉色菌减少,而机会致病菌如念珠菌和曲霉菌增多,这意味着易感人群如原发性免疫缺陷症患者的皮肤为复发性真菌感染提供了潜在的生态源位[26]。
几种共生细菌如乳酸菌、梭状芽胞杆菌、分节丝状菌(SFB)、脆弱类杆菌[27⁃30]已被证明可通过多种途径调节免疫系统,并推断其可能在调控抗真菌免疫应答中发挥作用。目前的研究认为,Th1细胞、Th17细胞、固有淋巴细胞(ILCs)和起到抗炎作用的调节性T细胞(Treg细胞)之间协调而平衡的相互作用不仅是清除病原真菌的重要条件,也是确保自身平衡环境的基础。目前的抗真菌免疫研究大多集中在IL⁃22、IL⁃17和Treg细胞,也有少部分研究IgA的文献。下面将具体阐述。
通过Th17细胞、免疫调节细胞及固有淋巴细胞调节抗真菌细胞免疫 Th17细胞所产生的IL⁃22和IL⁃17以及分布在屏障部位的第三类固有淋巴细胞构成了念珠菌黏膜免疫应答的重要组成部分[31]。IL⁃17作用复杂,既有抵抗真菌感染的作用,又可能在念珠菌感染的病理过程中发挥作用。而IL⁃22则具有独特的抗真菌防御作用[32]。吲哚胺2,3⁃双加氧酶1(IDO1)诱导产生的色氨酸代谢物是有效的抗炎物,能确保黏膜屏障健全并抵抗真菌定植。在IDO1阴性的小鼠模型中,乳酸杆菌可产生色氨酸衍生物(IAId),与固有淋巴细胞表面的芳香烃受体结合后可诱导其产生IL⁃22,在肠道上皮和阴道均可发挥黏膜保护作用并抵抗念珠菌定植[27]。对小鼠系统性给予细菌鞭毛蛋白可诱导产生IL⁃22介导的肠黏膜保护作用[22]。另一方面,以无菌小鼠及抗生素诱导肠道菌群耗竭小鼠为对象的研究都证明了肠道细菌可通过上皮细胞表达IL⁃25来抑制第三类固有淋巴细胞产生的IL⁃22[33]。
SFB可产生芽孢,是与梭状芽胞杆菌相关的革兰氏阳性菌,紧密地贴附于鼠回肠末端的上皮细胞表面,其诱导产生的血清淀粉样蛋白A可诱导树突状细胞产生IL⁃6和IL⁃23,从而可在小肠固有层诱导Th17细胞的分化及产生IL⁃17和IL⁃22[28]。此外,固有层巨噬细胞在肠道共生细菌菌群的影响下,可产生IL⁃1β,直接作用于T细胞,使其分化成肠道稳态Th17细胞[34]。然而,16S rRNA的测序表明SFB仅在年轻人群中定植,因此SFB对人类的免疫调节作用有待进一步确认[35]。
Treg细胞在抗真菌感染免疫中起到保护作用。有研究表明,在小鼠急性口腔念珠菌感染模型及体外实验中,Treg细胞均可协同刺激IL⁃17细胞因子分泌,增强了真菌清除作用,而在感染后期,Treg则起到炎症抑制作用[36]。人类有针对黏膜真菌(烟曲霉和白念珠菌)的大量特异性CD4+CD25+Foxp3+Treg细胞,可抑制促炎症免疫应答,保持肠道稳态(维持共生状态)[37]。脆弱类杆菌产生的分子多糖A(PSA)可通过直接刺激TLR2诱导产生Treg细胞[30]。Atarashi等[29]研究发现,来自于人类粪便的某些梭状芽胞杆菌菌株毒力弱,可通过产生短链脂肪酸、提供非特异细菌抗原来诱导结肠特异性Treg细胞(针对梭状芽胞杆菌)的大量增殖与分化。
黏膜水平的体液免疫 迄今为止大多数研究都集中在抗真菌的细胞免疫上,而关于宿主防御的体液免疫机制方面少之甚少。Geetha等[38]发现人血浆IgA可与酵母菌多糖结合,提示可能在真菌引起的免疫应答中发挥作用。在另一项研究中,Men⁃donca等[39]给予42名健康老年人服用益生菌(干酪乳杆菌和短双歧杆菌)每周3次,共1个月。比较服用前后唾液样本,结果发现62%参与者抗念珠菌IgA水平较之前显著上升,其中,只有2/3参与者同时有念珠菌载量小幅下降,IgA的抗真菌免疫的作用证据尚不足。因此,关于体液免疫在抗真菌感染方面的作用有待进一步研究。
3 细菌微生态研究对真菌感染及治疗方面的启示
早在微生物群落基因测序之前就已经有研究发现了细菌群落的变化对真菌群落的影响以及对真菌疾病易感性的影响。细菌的定植抗力下降有利于念珠菌定植并使组织侵袭的风险增加。
抗癌治疗可诱发人类真菌感染。预防性或治疗性使用抗生素可扰乱正常菌群,而化疗药物对微生物群落的影响近年来受到了关注。Montassier等[40]发现,8名霍奇金淋巴瘤患者在接受骨髓移植前调节性化疗7 d后(期间未予抗菌药物及营养支持),通过大便检测到的肠道菌群数量及多样性均较前显著降低,柔嫩梭菌属显著减少,而埃希菌属增多。虽然没有直接评价与真菌菌群和真菌疾病的关系,但从有抗炎作用的细菌菌种减少,以及厚壁菌门与拟杆菌门比例增加推断,化疗药物可降低微生物菌群定植抗性,增加黏膜炎症及感染患病风险[41]。
在真菌感染治疗方面,利用微生物群落治疗目前仅限于补充有益菌株(益生菌)。在一项小样本非对照试验中,给予30名实验室检查证实的外阴阴道念珠菌病患者由两株益生菌组成的缓释阴道栓剂,即发酵乳杆菌LF10和嗜酸乳杆菌AL02,这两种菌在体外试验中被证实有较强的念珠菌抑菌活性。第1周每晚1片,之后3周每3晚1片,之后每周1片使用1个月。第1个月有87%患者阴道感染治愈,但第2个月结束时12%有轻度复发[42]。该研究为RVVC的治疗提供了新的思路,但若确立其治疗地位,还需大规模随机对照试验以及设立抗真菌治疗对照组,并进行长期随访。相反,也有研究发现,VCC患者和健康对照组阴道菌群组成及多样性并无明显差异,大部分VCC患者含有丰富的乳酸杆菌[43]。这使得宿主与菌群及疾病易感之间的关系更加复杂而难以理解。除调节菌群构成外,细菌群落还可通过影响微生物与宿主之间相互作用时的某些代谢途径来调节免疫系统。口服PSA可阻止小鼠罹患实验性结肠炎[44]。最近的一项研究发现,口腔常驻菌毕赤酵母菌分泌蛋白可在体外通过抑制营养摄入抑制念珠菌生长、黏附及菌膜形成,在口腔念珠菌感染的小鼠模型中显示了很高的治愈率[7]。
4 结论及展望
随着人类微生物群落构成成分的揭示,宿主⁃⁃真菌复杂的相互作用有了进一步的研究。共生细菌群落可影响宿主⁃真菌关系,它们参与构成了宿主免疫系统并通过调节某些免疫细胞、免疫因子来影响宿主的抗真菌防御免疫反应。对于相关细菌菌种及其涉及的代谢和分子机制的更深入的研究可为将来的真菌治疗提供依据。发展病原菌特异性抗生素治疗十分必要,其可避免影响有益的细菌与真菌相互作用,从而避免菌群失调所造成的一系列临床问题。除此之外,利用菌群,如“移植”正常菌群、补充有益菌株、选择性移除有害菌株,或者通过干预细菌⁃免疫系统相互作用的主要途径中的代谢物质,未来可能发展为传统抗真菌治疗的有效辅助方法。
参考文献
[1] Costello EK,Lauber CL,Hamady M,et al.Bacterial community variation in human body habitats across space and time[J].Sci⁃ence,2009,326(5960):1694⁃1697.
[2] Rajilic⁃Stojanovic M,Heilig,HG,Tims S,et al.Long⁃term moni⁃toring of the human intestinal microbiota composition[J].Envi⁃ron Microbiol,2013,15(4):1146⁃1159.
[3] Huffnagle GB,Noverr MC.The emerging world of the fungal mi⁃crobiome[J].Trends Microbiol,2013,21(4):334⁃341.
[4] Hajishengallis G,Liang S,Payne MA,et al.Low⁃abundance bio⁃film species orchestrates inflammatory periodontal disease through the commensal microbiota and complement[J].Cell Host Microbe,2011,10(5):497⁃506.
[5] Kleinegger CL,Lockhart SR,Vargas K,et al.Frequency,intensi⁃ty,species,and strains of oral Candida vary as a function of host age[J].J Clin Microbiol,1996,34(9):2246⁃2254.
[6] Ghannoum MA,Jurevic RJ,Mukherjee PK,et al.Characterization of the oral fungal microbiome(mycobiome)in healthy individu⁃als[J].PLoS Pathog,2010,6(1):e1000713.
[7] Mukherjee PK,Chandra J,Retuerto M,et al.Oral mycobiome a⁃nalysis of HIV⁃infected patients:identification of Pichia as an antagonist of opportunistic fungi[J].PLoS Pathog,2014,10 (3):e1003996.
[8] Hoffmann C,Dollive S,Grunberg S,et al.Archaea and fungi of the human gut microbiome:correlations with diet and bacterial residents[J].PLoS One,2013,8(6):e66019.
[9] Drell T,Lillsaar T,Tummeleht L,et al.Characterization of the va⁃ginal micro⁃and mycobiome in asymptomatic reproductive⁃age Estonian women[J].PLoS One,2013,8(1):e54379.
[10] 郑能能,刘伟,漆丽娅,等.复发性念珠菌性阴道炎患者阴道真菌菌群多样性研究[J].浙江预防医学,2012,2(2):13⁃16.
[11] Paulino LC,Tseng CH,Strober BE,et al.Molecular analysis of fungal microbiota in samples from healthy human skin and psori⁃atic lesions[J].J Clin Microbiol,2006,44(8):2933⁃2941.
[12] Zhang E,Tanaka T,Tajima M,et al.Characterization of the skin fungal microbiota in patients with atopic dermatitis and in healthy subjects[J].Microbiol Immunol,2011,55(9):625⁃632.
[13] Park HK,Ha MH,Park SG,et al.Characterization of the fungal microbiota(mycobiome)in healthy and dandruff⁃afflicted hu⁃man scalps[J].PLoS One,2012,7(2):e32847.
[14] Findley K,Oh J,Yang J,et al.Topographic diversity of fungal and bacterial communities in human skin[J].Nature,2013,498 (7454):367⁃370.
[15] Carpagnano GE,Lacedonia D,Palladino GP,et al.Aspergillus spp.colonization in exhaled breath condensate of lung cancer pa⁃tients from Puglia Region of Italy[J].BMC Pulm Med,2014,14:22.
[16] Kaewsrichan J,Peeyananjarassri K,Kongprasertkit J.Selection and identification of anaerobic lactobacilli producing inhibitory compounds against vaginal pathogens[J].FEMS Immunol Med Microbiol,2006,48(1):75⁃83.
[17] Hogan DA,Vik A,Kolter R.A Pseudomonas aeruginosa quorum⁃sensing molecule influences Candida albicans morphology[J].Mol Microbiol,2004,54(5):1212⁃1223.
[18] Noverr MC,Huffnagle GB.Regulation of Candida albicans mor⁃phogenesis by fatty acid metabolites[J].Infect Immun,2004,72 (11):6206⁃6210.
[19] Buffo J,Herman MA,Soll DR.A characterization of pH⁃regulated dimorphism in Candida albicans[J].Mycopathologia,1984,85 (1⁃2):21⁃30.
[20] Schauber J,Svanholm C,Termen S,et al.Expression of the cathelicidin LL⁃37 is modulated by short chain fatty acids in colonocytes:relevance of signalling pathways[J].Gut,2003,52 (5):735⁃741.
[21] Otte JM,Zdebik AE,Brand S,et al.Effects of the cathelicidin LL⁃37 on intestinal epithelial barrier integrity[J].Regul Pept,2009,156(1⁃3):104⁃117.
[22] Kinnebrew MA,Buffie CG,Diehl GE,et al.Interleukin 23 pro⁃duction by intestinal CD103(+)CD11b(+)dendritic cells in response to bacterial flagellin enhances mucosal innate immune defense[J].Immunity,2012,36(2):276⁃287.
[23] Kandori H,Hirayama K,Takeda M,et al.lectinhistochemical and morphometrical characteristics of intestinal goblet cells of germ⁃free and conventional mice[J].Exp Anim,1996,45(2):155⁃160.
[24] Koh AY,Kohler JR,Coggshall KT,et al.Mucosal damage and neutropenia are required for Candida albicans dissemination[J].PLoS Pathog,2008,4(2):e35.
[25] Smeekens SP,Huttenhower C,Riza A,et al.Skin microbiome imbalance in patients with STAT1/STAT3 defects impairs innate host defense responses[J].J Innate Immun,2014,6(3):253⁃262.
[26] Oh J,Freeman AF,Park M,et al.The altered landscape of the human skin microbiome in patients with primary immunodefi⁃ciencies[J].Genome Res,2013,23(12):2103⁃2114.
[27] Zelante T,Iannitti RG,Cunha C,et al.Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin⁃22[J].Immunity,2013,39 (2):372⁃385.
[28] Ivanov II,Atarashi K,Manel N,et al.Induction of intestinal Th17 cells by segmented filamentous bacteria[J].Cell,2009,139(3):485⁃498.
[29] Atarashi K,Tanoue T,Oshima K,et al.Treg induction by a ra⁃tionally selected mixture of Clostridia strains from the human mi⁃crobiota[J].Nature,2013,500(7461):232⁃236.
[30] Round JL,Lee SM,Li J,et al.The Toll⁃like receptor 2 pathway establishes colonization by a commensal of the human microbiota[J].Science,2011,332(6032):974⁃977.
[31] Romani L.Immunity to fungal infections[J].Nat Rev Immunol,2011,11(4):275⁃288.
[32] De Luca A,Zelante T,D’Angelo C,et al.IL⁃22 defines a novel immune pathway of antifungal resistance[J].Mucosal Immunol,2010,3(4):361⁃373.
[33] Sawa S,Lochner M,Satoh⁃Takayama N,et al.RORgammat+in⁃nate lymphoid cells regulate intestinal homeostasis by integrating negative signals from the symbiotic microbiota[J].Nat Immunol,2011,12(4):320⁃326.
[34] Shaw MH,Kamada N,Kim YG,et al.Microbiota induced IL⁃1 beta,but not IL⁃6,is critical for the development of steady⁃state TH17 cells in the intestine[J].J Exp Med,2012,209(2):251⁃258.
[35] Yin Y,Wang Y,Zhu L,et al.Comparative analysis of the distri⁃bution of segmented filamentous bacteria in humans,mice and chickens[J].ISME J,2013,7(3):615⁃621.
[36] Pandiyan P,Conti HR,Zheng L,et al.CD4(+)CD25(+)Foxp3(+)regulatory T cells promote Th17 cells in vitro and enhance host resistance in mouse Candida albicans Th17 cell infection model[J].Immunity,2011,34(3):422⁃434.
[37] Bacher P,Kniemeyer O,Schonbrunn A,et al.Antigen⁃specific expansion of human regulatory T cells as a major tolerance mechanism against mucosal fungi[J].Mucosal Immunol,2014,7 (4):916⁃928.
[38] Geetha M,Annamma KI,Mathai J,et al.Normal human plasma anti⁃beta⁃glucoside antibody has markedly elevated IgA content and binds fungal and yeast polysaccharides[J].Immunol Invest,2007,36(1):73⁃83.
[39] Mendonca FH,Santos SS,Faria Ida S,et al.Effects of probiotic bacteria on Candida presence and IgA anti⁃Candida in the oral cavity of elderly[J].Braz Dent J,2012,23(5):534⁃538.
[40] Montassier E,Batard E,Massart S,et al.16S rRNA gene pyrose⁃quencing reveals shift in patient faecal microbiota during high⁃dose chemotherapy as conditioning regimen for bone marrow transplantation[J].Microb Ecol,2014,67(3):690⁃699.
[41] van Vliet MJ,Harmsen HJ,de Bont ES,et al.The role of intesti⁃nal microbiota in the development and severity of chemotherapy induced mucositis[J].PLoS Pathog,2010,6(5):e1000879.
[42] Vicariotto F,Del Piano M,Mogna L,et al.Effectiveness of the association of 2 probiotic strains formulated in a slow release va⁃ginal product,in women affected by vulvovaginal candidiasis:a pilot study[J].J Clin Gastroenterol,2012,46(Suppl):S73⁃80.
[43] Zhou X,Westman R,Hickey R,et al.Vaginal microbiota of women with frequent vulvovaginal candidiasis[J].Infect Immun,2009,77(9):4130⁃4135.
[44] Mazmanian SK.Capsular polysaccharides of symbiotic bacteria modulate immune responses during experimental colitis[J].J Pediatr Gastroenterol Nutr,2008,46(Suppl 1):E11⁃E12.
·综述·
[收稿日期]2015⁃04⁃25 [本文编辑] 王 飞
【文章编号】1673⁃3827(2015)10⁃0302⁃05
【文献标识码】B
【中图分类号】R 519
通讯作者:刘维达,E⁃mail:liumyco@hotmail.com
作者简介:张杰,女(汉族),博士研究生在读.E⁃mail:zhangjiesallyl @163.com

