核酸序列依赖性扩增、Real⁃time PCR及GM试验诊断侵袭性曲霉菌感染的临床应用评价
王立朋 鲍翠霞 于丽梅 张晓录 于威娟 张霞 李玮 黄葆华 李杰 孙成铭(青岛大学医学院附属烟台毓璜顶医院检验科,烟台264000)
核酸序列依赖性扩增、Real⁃time PCR及GM试验诊断侵袭性曲霉菌感染的临床应用评价
王立朋 鲍翠霞 于丽梅 张晓录 于威娟 张霞 李玮 黄葆华 李杰 孙成铭
(青岛大学医学院附属烟台毓璜顶医院检验科,烟台264000)
【摘要】目的 核酸序列依赖性扩增(nucleic acid sequence⁃based amplification,NASBA)、Real⁃time PCR及GM试验在侵袭性曲霉菌感染中的诊断价值。方法 收集2013年11月~2014年6月临床上曲霉菌感染高危病患的血液标本80例,并根据EORTC/MSG诊断标准分为确诊组8例,拟诊组26例,非感染组46例,分别利用NASBA、real⁃time PCR及GM试验进行检测,计算3种方法的诊断指标并分析评价。结果 NASBA、real⁃time PCR及GM试验3种方法的灵敏度分别为76.47%、67.65%、52.94%,特异度分别为80.43%、89.13%、80.43%。联合诊断结果显示,NASBA与real⁃time PCR串联方案有最好的特异度(100%)及阳性预测值(100%);NASBA与real⁃time PCR并联方案则最为灵敏(94.12%)。结论 NASBA用于诊断IA最为敏感,而real⁃time PCR则最为特异,GM试验的表现差于前两者。联合应用的诊断策略,在特定情况下提高临床早期诊断IA的准确性。
【关键词】侵袭性曲霉菌感染;核酸序列依赖性扩增;实时PCR;GM试验
[Chin J Mycol,2015,10(5):283⁃287]
侵袭性曲霉菌感染(IA)是一种机会性真菌感染,过去的20 a里,由于肿瘤化疗,造血干细胞及实体器官移植术后应用免疫抑制剂、糖皮质激素等药物,临床上出现越来越多的免疫力低下的患者,使得IA的发病率呈上升趋势,死亡率也一直居高不下[1⁃2]。早期准确的诊断结果是及早开展抗曲霉菌治疗、改善临床预后的关键。尽管传统方法与血清学检测及影像学检查相结合的诊断策略已经取得了巨大进步,但是这些诊断方法目前均不能使临床医师满意。
分子生物学的方法在一系列感染性疾病,包括曲霉菌感染的诊断中展现出良好的前景。核酸序列依赖性扩增(NASBA)是一种特异性地等温扩增RNA的技术。相比较而言,传统的PCR技术每次循环只产生双倍的复制子,而NASBA每次扩增可产生10~100倍的RNA分子,且可在30 min产生多达1012个复制子,扩增效率明显高于普通PCR[3]。目前NASBA技术已经被广泛应用于检测细菌和病毒的感染[4⁃5]。本研究收集临床上曲霉菌感染的高危病患的血液标本,以血液中游离曲霉菌RNA、DNA、半乳甘露聚糖(GM)为靶标,分别利用NASBA、real⁃time PCR及GM试验进行检测,计算3种方法的诊断指标并分析评价,以确立可行性较高的侵袭性曲霉菌感染的实验室诊断策略。
1 材料和方法
1.1 研究对象
收集2013年11月~2014年6月临床曲霉菌感染高危病患的血液标本80例,参照文献设定的纳入标准为[6⁃7]:G试验检测结果阳性(>60 pg/mL);免疫力低下;至少符合以下情况之一,接受造血干细胞移植术治疗,罹患血液疾病,长期应用激素类药物,对于常规抗生素治疗无效的发热或胸部浸润,影像学检查提示真菌感染。根据2008年修订的EORTC/MSG标准[8]及参考临床诊断结论,可分为8例确诊(Proven IA),26例拟诊(Probable IA)及46例非IA病例。血液标本应在抗真菌治疗前进行采集,离心分离出血清后用Ep管分装3管,冻存于⁃80℃冰箱中备用,于3 d内完成RNA提取(NASBA检测)、DNA提取(PCR检测)及GM试验检测。
1.2 仪器与试剂
水浴箱(上海福玛实验设备有限公司),高速离心机(赛默飞世尔科技公司),荧光定量PCR仪(美国ABI 7500),酶标仪(Tecan奥地利有限公司),QIAamp DNA Blood Kit(德国QIAGEN),血液总RNA快速提取试剂盒(北京百泰克生物技术有限公司),曲霉菌半乳甘露聚糖定性检测试剂盒(天津贻诺琦生物工程有限公司),SYBR Premix ExTaqTMII试剂盒、NTP、dNTP、T7 RNA聚合酶、AMV逆转录酶(宝生物工程有限公司),RNasin®Plus RNase Inhibitor、牛血清白蛋白(BSA)(美国Promega),RNase H(加拿大Fermentas公司)。
1.3 引物设计与合成
引物序列均参照相关文献报道[5,9],NASBA扩增片段位于18S rRNA的一段高度保守区域,引物序列为F:AATTCTAATACGACTCACTATAGGG⁃GAGCAAAGGCCTGCTTTGAACA(下划线为T7 RNA聚合酶识别序列),R:GCCGCGGTAATTC⁃CAGCTCCAATA;real⁃time PCR靶片段为曲霉菌28S rRNA基因上的一段保守序列。引物序列为F:GCACGTGAAATTGTTGAAAGG,R:CAGGCTGGC⁃CGCATTG。引物委托Life technologies公司合成。
1.4 血清游离RNA、DNA的提取
将冻存的标本从冰箱取出后复温,利用QIAamp DNA Blood Kit提取血清中的游离DNA,利用血液总RNA快速提取试剂盒提取血清中的游离RNA,主要操作方法按照说明书进行。提取后的DNA、RNA冻存于⁃80℃冰箱中备用。
1.5 NASBA检测曲霉菌方法建立及标本检测
NASBA反应体系主要包括3个部分即反应缓冲液、扩增模板及扩增酶混合物。本研究20 μL反应体系包括反映缓冲液10 μL[40 mmol/L pH8.5 的Tris⁃HCl,70 mmol/L KCl,5 mmol/L二硫苏糖醇(DTT),12 mmol/L MgCl2,0.375 mol/L山梨醇,12U RNasin®Plus RNase Inhibitor,1 μmol/L dNTP,2 μmol/L NTP,0.4 μmol/L引物及10%二甲基亚砜(DMSO)],缓冲液各成分轻轻涡旋混匀后离心,然后加入曲霉菌模板RNA 5 μL。缓冲液和模板的混合物轻轻涡旋混匀后离心,反应管置于65℃、5 min,41℃、5 min,预温后向反应管中加入酶混合物[包括40U T7 RNA聚合酶,8U AMV逆转录酶,0.1U RNA酶H,2 μg牛血清白蛋白],补充无RNA酶水至反应总体积为20 μL。反应混合物轻轻涡旋混匀后离心,41℃、90 min,反应后产物利用1%的电泳进行分析。反应体系设空白对照(模板为无菌双蒸水),阴性对照(模板为健康者血浆循环RNA)及阳性对照(模板为烟曲霉标准株提取的RNA)[3]。
1.6 Real⁃time PCR检测曲霉菌方法建立及标本检测
参照相关文献[9]利用SYBR®Premix Ex TaqTMⅡ建立real⁃time PCR检测曲霉菌感染的方法,主要操作方法按照说明书进行。建立的20 μL反应体系成分包括10 μL SYBR Premix ExTaqⅡ(2×),上下游引物各0.8 μL,0.4 μL ROX reference DyeⅡ(50×),2 μL DNA模板,6 μL无菌蒸馏水。反应体系设空白对照(模板为无菌双蒸水),阴性对照(模板为健康者血浆循环DNA)及阳性对照(模板为烟曲霉提取的DNA)。全部标本检测完毕后,以EORTC/MSG诊断标准为参考方法建立ROC曲线,确立最佳Ct阈值,并以此界值判定荧光定量PCR的结果。
1.7 GM试验
利用曲霉菌半乳甘露聚糖定性检测试剂盒(ELISA法)对血清半乳甘露聚糖进行检测,主要操作方法按照说明书进行。质控、对照及标本的OD值通过Tecan酶标仪进行读取,测定波长为450 nm。待测样本中的半乳甘露聚糖存在与否取决于每个样本检测值的计算指数GMI,GMI=cut⁃off质控OD值/2×样本OD值,若GMI<0.5,则定为阴性;GMI≥0.5,则定为阳性。
1.8 统计学分析
每种诊断试验方法的性能参数(灵敏度、特异度等)通过构建的2×2表格进行计算,以2008年修订的EORTC/MSG标准[8]为“金标准”,IA确诊组及拟诊组被定义为真阳性。利用统计学软件SPSS Statistics 20.0构建ROC曲线,P<0.05认为有统计学意义。Youden指数用来评估每种诊断方法的综合能力。
2 结 果
2.1 高危病患
本研究最终总共纳入80例IA高危病患,根据2008年修订的EORTC/MSG标准及参考临床诊断结论,可分为8例确诊(Proven IA),26例拟诊(Probable IA)及46例非IA病例。人口统计资料如表1所示。
2.2 Real⁃time PCR
Real⁃time PCR以EORTC/MSG标准为金标准建立ROC曲线,确立最佳阈值,并以此判定结果(见图1)。经过分析,real⁃time PCR的最佳Ct阈值设定为39.2。
确立诊断标准后,NASBA、real⁃time PCR及GM试验对80例IA高危病患标本检测结果如图2及表2所示。

表2 NASBA、real⁃time PCR及GM试验的IA诊断结果(n)Tab.2 Results of NASBA,real⁃time PCR and GM test for diagnosis of IA
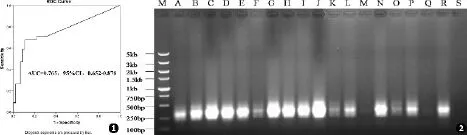
图1 Real⁃time PCR ROC曲线 图2 NASBA检测血液标本曲霉菌电泳结果(部分)Fig.1 ROC curve of real⁃time PCR assay Fig.2 Electrophoresis re⁃sults of blood samples tested by NASBA(part)
2.3 3种IA诊断方法的准确性
为评价3种IA诊断方法的准确性,可计算出每种诊断方法的效能指标,如表3所示。通过比较可以看出,NASBA最为灵敏,在阴性似然比、阴性预测值、Youden指数方面表现最好;real⁃time PCR则是最特异的方法,且在阴性似然比、阴性预测值、Kappa方面表现最好。
2.4 最佳方案
为找出IA实验室诊断的最佳方案,我们对3种方法的两两组合(串联试验与并联试验)进行了比较,并计算出各种联合诊断方案的性能指标(见表4)。从表中可以看出,NASBA与real⁃time PCR串联方案有最好的特异度及阳性预测值;NASBA 与real⁃time PCR并联方案则在灵敏度、阴性似然比、阴性预测值、Youden指数方面表现最好,结果如表4所示。

表3 NASBA、real⁃time PCR及GM试验对IA诊断效能Tab.3 Diagnostic performance of NASBA,qPCR and GM test

表4 NASBA、Real⁃time PCR及GM试验的联合诊断效能Tab.4 Diagnostic performance of combination of NASBA,qPCR and GM test
3 讨 论
IA在免疫力低下患者中的发病率和死亡率很高。但有报道显示:目前仅有6%的IA高危病患能得到一个明确的诊断[10]。传统的诊断方法,比如微生物培养及组织病理学检查,因敏感度太低而可能漏检大部分曲霉菌。尽管有报道显示在体外实验中,1~10 CFU的曲霉菌孢子接种到血培养瓶中可在48 h内可被检测出来,但是实际临床中,曲霉菌培养的阳性结果却很少见,这可能与体内免疫细胞的吞噬作用有关[10]。近年来,通过传统的组织学方法、影像学与抗原检测等联合应用提高了对于IA的诊断[11]。然而,影像学特异性不足,GM试验干扰因素较多,早期而又精确的IA诊断依然存在困难。
过去的几十年里,微生物分子检测方法取得了长足的发展。以核酸检测为基础的方法,包括PCR、NASBA已经在IA诊断上显示出巨大潜力。在本次研究中,我们利用两种核酸检测方法(real⁃time PCR和NASBA)及一种抗原检测方法(GM试验)检测IA高危病患的血液标本并对3种方法进行评估。
研究结果显示,NASBA是最敏感的方法(76.47%),并且有最好的阴性似然比,阴性预测值及尤登系数,这与Torelli R[12]及Zhao Y[13]之前报道的NABSA用于曲霉菌检测的良好表现相一致(见表3)。除此以外,相比于real⁃time PCR及GM试验,NASBA的扩增时间短,检测设备成本低,容易操作,适于IA高危病患的筛查,有应用于临床的潜能。NASBA的缺点在于检测对象为RNA,所以样品采集及检测过程要求较高。在将来进一步的研究中,结合分子信标有望实现进行定量检测。
本次研究中,real⁃time PCR是特异性最高的方法,达到89.13%,与Bernal⁃Martínez等[14]的报道相差不大(93.9%)。Real⁃time PCR有最好的阳性似然比、阳性预测值及Kappa值(见表3),显示此方法适于确诊IA高危者,或是排除可疑病患。但re⁃al⁃time PCR的灵敏度仅有67%,这可能与所检测的标本为血清有关,有报道显示血清中存在的曲霉菌DNA少于全血标本。为了使PCR标准化,提高检测效能,2010年发布的欧洲曲霉菌PCR倡议书推荐使用更大的标本量,更小的DNA洗脱体积[15]。除此以外,自动化的核酸提取系统能够简化提取过程,节省时间,将DNA污染降到最低。
GM试验尽管已被纳入EORTC/MSG的标准,其敏感度较低(52.94%)而特异性(80.43%)尚可接受,表明GM应在1周内进行至少2次检测以提高诊断效能[16]。
此外,半乳甘露聚糖(GM)一般在曲霉菌快速增殖时释放入血,而曲霉菌游离核酸的释放则是菌丝自我分解或是宿主免疫反应的结果。两种靶标的释放时机并不一致[17],故两种方法联用在特定情况下能取得更好效果。我们的结果显示,NASBA 与real⁃time PCR的串联应用有最好的特异度(100%)及阳性预测值(100%)。这种诊断策略对于排除IA可疑者十分有用,从而减少免疫低下患者的误诊。另一方面NASBA与real⁃time PCR的并联使用有最高的灵敏度(94.12%)及尤登系数(0.6292),更适于筛查IA高危病患,有作为常规临床应用的潜能。
我们的研究表明,NASBA用于诊断IA最为敏感,而real⁃time PCR则最为特异,GM的表现差于前两者。联合应用的诊断策略能够提高诊断效能,应根据临床需要进行选择相应的诊断策略,为IA的早期诊断提供可靠依据。
参考文献
[1] Chandrasekar P.Diagnostic challenges and recent advances in the early management of invasive fungalinfections[J].Eur J Haema⁃tol,2010,84(4):281⁃290.
[2] LeventakosK,Lewis RE,Kontoyiannis DP.Fungal infections in leukemia patients:how do we prevent and treat them[J].Clini Infect Dis,2010,50(3):405⁃415.
[3] Zhao Y,Park S,Kreiswirth BN,et al.Rapid real⁃time nucleic acid sequence based amplification⁃molecular beacon platform to detect fungal and bacterial bloodstream infections[J].J Clin Mi⁃crobiol,2009,47(7):2067⁃2078.
[4] Ge Y,Cui L,Qi X,et al.Detection of novel swine origin influenza A virus(H1N1)by real⁃time nucleic acid sequence⁃based am⁃plification[J].J Virol Methods,2010,163(2):495⁃497.
[5] Perlin DS,Zhao Y.Molecular diagnostic platforms for detecting Aspergillus[J].Med Mycol,2009,47(s1):S223⁃232.
[6] Galimberti R,Torre AC,Baztán MC,et al.Emerging systemic fungal infections[J].Clin Dermatol,2012,30(6):633⁃650.
[7] Dimopoulos G,Frantzeskaki F,Poulakou G,et al.Invasive asper⁃gillosis in the intensive care unit[J].Ann N Y Acad Sci,2012,1272:31⁃39.
[8] De Pauw B,Walsh TJ,Donnelly JP,et al.Revised definitions of invasive fungal disease from the European Organization for Re⁃search and Treatment of Cancer/Invasive Fungal Infections Co⁃operative Group and the National Institute of Allergy and Infec⁃tious Diseases Mycoses Study Group(EORTC/MSG)Consensus Group[J].Clin Infect Dis,2008,46(12):1813⁃1821.
[9] 高露娟,鲁巧云,孙毅,等.实时PCR在侵袭性曲霉病中的诊断价值[J].中华检验医学杂志,2013,36(2):173⁃177.
[10] White PL,Linton CJ,Perry MD,et al.The evolution and evalua⁃tion of a whole blood polymerase chain reaction assay for the de⁃tection of invasive aspergillosis in hematology patients in a rou⁃tine clinical setting[J].Clin Infect Dis,2006,42(4):479⁃486.
[11] Denning DW,Kibbler CC,Barnes RA,et al.British society for medical mycology proposed standards of care for patients with invasive fungal infections[J].Lancet Infect Dis,2006,3(4):230⁃240.
[12] Torelli R,Sanguinetti M,Moody A,et al.Diagnosis of invasive aspergillosis by a commercial real⁃time PCR assay for aspergillus DNA in bronchoalveolar lavage fluid samples from high⁃risk pa⁃tients compared to a galactomannan enzyme immunoassay[J].J Clin Microbiol,2011,49(12):4273⁃4278.
[13] Zhao Y,Perlin DS.Quantitative detection of Aspergillus spp.by real⁃time nucleic acid sequence⁃based amplification[J].Methods Mol Biol,2013,968:83⁃92.
[14] Bernal⁃Martínez L,Gago S,Buitrago MJ,et al.Analysis of per⁃formance of a PCR⁃based assay to detect DNA of Aspergillus fu⁃migatus in whole blood and serum:a comparative study with clinical samples[J].J Clin Microbiol,2011,49(10):3596⁃3599.
[15] Mengoli C,Cruciani M,Barnes RA,et al.Use of PCR for diagno⁃sis of invasive aspergillosis:systematic review and meta⁃analysis [J].Lancet Infect Dis,2009,9(2):89⁃96.
[16] Chen SC,Kontoyiannis DP.New molecular and surrogate biomar⁃ker⁃based tests in the diagnosis of bacterial and fungal infection in febrile neutropenic patients[J].Curr Opin Infect Dis,2010,23(6):567⁃577.
[17] Mennink⁃Kersten MA1,Ruegebrink D,Wasei N,et al.In vitro release by Aspergillus fumigatus of galactofuranose antigens,1,3⁃beta⁃D⁃glucan,and DNA,surrogate markers used for diagnosis of invasive aspergillosis[J].J Clin Microbiol,2006,44(5):1711⁃1718.
[本文编辑] 卫凤莲
·短篇论著·The application of nucleic acid sequence⁃based amplification,real⁃time PCR and GM test in invasive aspergillosis diagnosisWANG Li⁃peng,BAO Cui⁃xia,YU Li⁃mei,ZHANG Xiao⁃lu,YU Wei⁃juan,ZHANG Xia,LI Wei,HUANG Bao⁃hua,LI Jie,SUN Cheng⁃ming
(Affiliated Yantai Yuhuangding Hospital,Medical College of Qingdao University,Yantai 264000)
【Abstract】Objective To study the diagnostic performance of nucleic acid sequence⁃based amplification(NASBA)assay,real⁃time PCR and GM test in detecting invasive aspergillosis for clinical diagnosis.Methods Blood samples from 80 patients at a high risk for IA were collected during from November 2013 to June 2014.These patients were categorized as 8 proven IA,26 probable IA,and 46 non⁃IA according to the 2008 revised definitions of EORTC/MSG.Blood samples were tested by NASBA,real⁃time PCR and GM test and their diagnostic parameters were calculated,respectively.Result The sensitivity of NASBA,real⁃time PCR and GM test was 76.47%,67.65%and 52.94%,while their specificity was 80.43%,89.13%,80.43%,respectively.The efficiency of various com⁃binations of tests was also evaluated.Perfect specificity(100%)and positive predictive value(100%)were achieved by combining NASBA and real⁃time PCR as a serial testing.A combination of NASBA and real⁃time PCR as a parallel testing was the most sensitive (94.12%).Conclusion The sensitivity and specificity of NASBA and real⁃time PCR were superior to GM test.Combination of these assays could be particularly useful in specific clinical situations.
【Key words】invasive aspergillosis;nucleic acid sequence⁃based amplification;real⁃time PCR;GM test
[收稿日期]2015⁃06⁃03
【文章编号】1673⁃3827(2015)10⁃0283⁃05
【文献标识码】A
【中图分类号】R 379.6
通讯作者:黄葆华,E⁃mail:huangbaohua2010@126.com
作者简介:王立朋,男(汉族),硕士,检验师.E⁃mail:wlp924577010 @163.com

