高温高压提取甜菜废粕多糖的工艺及其抗氧化性研究
赵亚红,王文侠,张显斌,尚庆,李长娟
(齐齐哈尔大学食品与生物工程学院黑龙江省普通高校农产品加工重点实验室,黑龙江齐齐哈尔,161006)
在甜菜制糖过程中,甜菜充分提取蔗糖后的菜丝称为废粕,甜菜废粕是甜菜制糖的副产物。2011年我国甜菜总产量1 073.1万t,占全球总产量的4.3%左右[1]。我国甜菜种植面积高达25万hm2,主要分布在黑龙江、新疆、内蒙古等北方地区。每吨甜菜制糖后可得到大约0.15 t干渣,我国甜菜废粕资源极其丰富。甜菜废粕主要成分是碳水化合物,其中糖醛酸(果胶类)15.7%,中性非淀粉多糖29.1%,纤维素19.2%[2]。多糖除具有增稠性、胶凝性、乳化性等良好的功能性质[3],还具有多种生理功能,对肥胖病、糖尿病、心血管病、肠道癌症等疾病有预防和抑制作用,被广泛应用于食品、医药、化工、纺织等行业[4-6]。目前我国国内各甜菜糖厂仍以传统方法来处理甜菜粕,主要将甜菜粕经过干燥压榨成小颗粒状作为牲畜的粗饲料销售,产品的附加值较低。甜菜渣中有丰富的果胶等非淀粉多糖,是较为理想的多糖生产原料。
常用的甜菜多糖提取方法有很多种,如水提法,酸法、碱法、酶法、超声法,微波辅助法等[7-10]。水提法是提取多糖的传统方法,虽然设备简单,容易操作,适用范围广泛,但多糖的得率低,提取时间长。木质素是构成植物细胞壁的成分之一,具有使细胞相连的作用。由于有3%左右的木质素与甜菜细胞壁多糖紧密结合[1],常压水提法难以破坏木质素的骨架结构,影响多糖的提取。高压作用可以破坏木质素与纤维素、半纤维素、果胶形成骨架结构,使甜菜粕中的多糖更易于溶出。
本文对甜菜粕多糖提取工艺条件进行研究,确定高压法提取甜菜粕多糖的最佳工艺条件,并对甜菜废粕粗多糖体外抗氧化进行了研究。
1 试剂与仪器
1.1 主要试剂
甜菜粕,博城北方糖业股份有限公司;半乳糖醛酸(生化试剂),沃凯国药集团化学试剂有限公司;系列标准葡聚糖,北京拜尔迪生物公司;阿魏酸(色谱纯),上海生工生物工程(上海)有限公司;其余试剂均为分析纯。
1.2 主要仪器
BFM-6BI型贝利微粉机,济南倍力粉技术工程有限公司;LDZM-40KCS不锈钢压力蒸汽灭菌器,上海申安器械厂;TDL-5-A台式离心机,上海安亭有限公司;722S可见分光亮度计,上海精密科学仪器有限公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;N2000液相色谱仪,戴安中国有限公司;Heal Force超纯水器,力康生物医疗科技控股有限公司。
2 实验方法
2.1 总多糖测定及其得率计算
采用苯酚-硫酸法[13]测定多糖。
采用间羟基联苯法[14]测定酸性糖。
总多糖计算:通常糖醛酸含量较低的多糖(中性多糖)样品采用苯酚-硫酸法即可得到总糖含量。而对于糖醛酸含量较高的样品,糖醛酸在苯酚试剂中虽然有显色,但微弱,且在490nm也不是最大吸收,因此无法准确反映总糖的实际含量。由于采用间羟基联苯法测糖醛酸含量不受中性糖的影响,首先测定糖醛酸含量,然后通过糖醛酸干扰回归方程,计算糖醛酸对测定中性糖含量时的干扰值,将苯酚-硫酸法测定的多糖OD值减去糖醛酸干扰值,再通过回归方程求得的糖含量即为样品的多糖(中性糖)含量,与糖醛酸含量之和即可真实反映样品的总多糖含量[22]。

其中:c,根据标准曲线得出的葡萄糖或半乳糖醛酸浓度,μg/mL;N,样品稀释倍数;V,原样加水体积,mL;m,样品质量,g。
总多糖得率的计算:
多糖得率/%=[提取总多糖质量(g)/甜菜粕质量(g)]×100
2.2 蛋白质含量测定
采用Folin-酚法[15]测定粗多糖中蛋白质的含量;
2.3 阿魏酸含量测定
(1)游离阿魏酸测定:经冷冻干燥后的样品配制成10 mg/mL的溶液,0.45 μm滤膜过滤后进行HPLC分析。色谱条件:色谱柱为SunFireTMC185 μm(4.6 mm×150 mm Column),柱温25℃,流动相为V(甲醇)∶V(1% 乙酸)=40∶60,流速为 1.0 mL/min,进样量20 μL,UV检测器,检测波长320 nm。
(2)结合阿魏酸测定:将样液与0.5 mol/L的NaOH溶液按体积比1∶1混匀后,在暗处室温下反应24 h,加入与样液相同体积的0.5 mol/L的H3PO4终止反应。样液过0.45 μm滤膜后进行HPLC分析。
2.4 多糖相对分子质量分布测定
采用高效液相色谱法测定甜菜粕多糖的相对分子质量分布。
色谱条件为:色谱柱:TSK-GEL G-6000PW xL column(7.8 mm×300 mm)与TSK-GEL G-3000PW xL column(7.8 mm×300 mm)串联,泵:戴安N2000液相泵,检测器:示差检测器,柱温为35℃,以纯水为流动相,流速为0.6 mL/min。
首先将相对分子质量分别为4 000,20 000,50 000,100 000,1 000 000和2 000 000的标准葡聚糖相继进样,HPLC记录各标准样的保留时间,以保留时间为横坐标,LgMr为纵坐标绘制标准曲线,求出回归方程,然后将制得的粗糖样配制成5 mg/mL,过0.45 μm膜,进样量为20 μL,根据所得的保留时间,通过上述回归方程计算出甜菜粕多糖的不同组分的相对分子质量分布。
2.5 多糖的体外抗氧化活性的测定
对DPPH自由基清除能力:采用比色法[17]测定。
对羟自由基清除能力:采用邻二氮菲-Fe2+氧化法[18]测定。
还原能力:采用铁氰化钾法[19]测定。
配制不同浓度的样品溶液,以Vc为对照,对高温高压法提取的甜菜粕粗多糖进行体外抗氧化活性的测定。
2.6 工艺流程
甜菜粕→粉碎(过60目筛)→ 高温高压提取→冷却,离心(5 000 r/min,10 min)→上清液,过滤→滤液→旋转蒸发浓缩10倍→1∶4醇沉,静置1 h→离心(5 000 r/min,10 min),沉淀冷冻干燥→甜菜粕粗多糖
2.7 高温高压法提取甜菜废粕中多糖的方法
取一定量甜菜废粕粉,提取剂水按一定配比加入500 mL锥形瓶中,摇匀。用纱布封住锥形瓶口,放入不锈钢压力蒸汽灭菌器中。在设定的温度、时间下提取菜废粕多糖。冷却,离心(5 000 r/min,10 min),按滤液和乙醇1∶4的体积比加入无水乙醇,醇沉1 h后,离心(5 000 r/min,10 min),弃去上清液,所得沉淀即为粗多糖。
2.8 高温高压法提取甜菜废粕中多糖条件的优化
以多糖得率作为衡量指标,在单因素实验的基础上,采用正交实验设计研究料液比、时间、温度3个因素对多糖得率的影响,确定最优提取工艺条件。
2.9 数据分析
3 结果与分析
3.1 固液比对甜菜粕多糖得率的影响
分别按固液比(g∶mL)为1∶15,1∶20,1∶25,1∶30,1∶35加入甜菜粕和水,在121℃下提取3 h。测定多糖含量,计算得率。实验结果见图1。
由图1可知,随着固液比升高多糖得率先降低后上升,当液料比为1∶30时后多糖得率最高。经单因素方差分析,固液比对多糖提取率影响显著(P<0.05)。因此,初步选择固液比为1∶30。
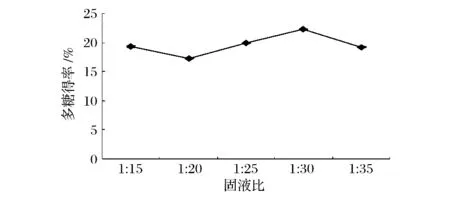
图1 固液比对甜菜粕多糖得率的影响Fig.1 Effects of the ratio of solid on polysaccharides yield
3.2 时间对甜菜粕多糖得率的影响
按液料比为1∶30(g∶mL)加入甜菜粕和水,在121 ℃下分别提取 1,1.5,2,2.5,3,3.5,4 h。测定多糖含量,计算得率。实验结果见图2。
由图2可知,提取时间从1 h增加到3 h时,多糖得率随时间的增加而提高;当提取时间进一步增加至4 h时,提取率下降至17.81%,可能是因为提取出的多糖因为某些作用产生降解,导致多糖提取率降低。经单因素方差分析,提取时间量对多糖提取率影响显著(P<0.05)。在较高压力作用下,细胞内容物与进入细胞内部的溶剂接触,经过一段时间,有效成分溶于这些溶剂中,有效成分的溶解平衡在3 h左右即可完成。初步选定提取时间为3 h。

图2 时间对甜菜粕多糖得率的影响Fig.2 Effects of time on polysaccharides yield
3.3 温度对甜菜粕多糖得率的影响
按液料比为1∶30加入甜菜粕和水,分别在100,105,110,115,121,124 ℃条件下提取 3 h。测定多糖含量,计算得率。实验结果见图3。

图3 温度对甜菜粕总多糖得率的影响Fig.3 Effects of temperature on polysaccharides yield
由图3可知,当温度从100℃增加到121℃时,多糖得率随着温度的升高而增加,达到最高值;当温度超过121℃后,多糖得率下降。经单因素方差分析,提取温度对多糖提取率影响显著(P<0.05)。初步确定提取温度为121℃。
3.4 正交优化试验结果分析
为了优化高温高压法提取甜菜废粕中多糖的工艺条件,在以上单因素实验的基础之上采用三因素进行L9(34)正交试验,以确定最佳提取工艺条件。选用因素及水平见表1。正交试验结果如表2所示。

表1 L9(34)正交因素水平表Table 1 Factors and levels of L9(34)orthogonal
由表2可知,按照极差大小,三因素中影响多糖得率的主次顺序为A>C>B,即时间>固液比>温度。由表3方差分析可知,因素A显著(P<0.05),B,C(P>0.05)不显著。最优组合为A3B1C2,即时间4h,温度115℃,固液比1∶30。经验证该条件下所得多糖的提取率达23.89%。故经优化实验条件确定最佳工艺条件为:时间4 h,温度115℃,固液比1∶30。

表2 正交实验结果Table 2 Results of orthogonal test on extraction conditions

表3 方差分析Table 3 Orthogonal test analysis of variance table
3.5 甜菜粕多糖的化学组成分析
从表4可以看出,高压法提取的甜菜粕粗多糖主要含有中性糖和酸性糖,而酸性糖含量略高于中性糖,表明该粗多糖为弱酸性多糖,同时还含有少量的阿魏酸,蛋白质。
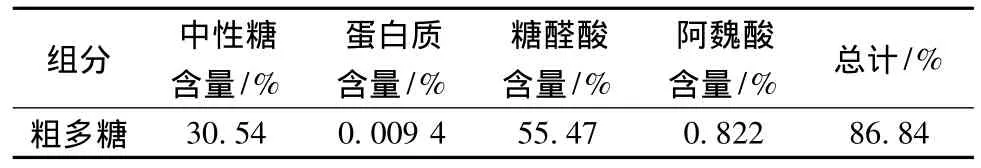
表4 甜菜粕多糖的主要化学组成Table 4 The majorcomponets of polysaccharides
3.6 甜菜粕多糖的相对分子质量分布测定
葡聚糖标准品在分子质量为4~2 000 kDa,LgMw-tR呈较好的线性关系,线性回归方程为:y=-0.331 2x+14.367,R2=0.988 5。甜菜粕粗多糖和酸法提取的甜菜粕粗多糖[22]相对分子质量分布测定结果见图4。

图4 多糖的相对分子质量分布Fig.4 The molecular weight of polysaccharides
图4-(a)为高温高压法提取甜菜粕粗多糖的分子质量分布。从左至右各部分分子质量约为337 224.41、33 484.53 及0.74 kDa
图4-(b)为酸法提取的甜菜粕粗多糖的分子质量分布。从左至右各部分分子质量约为21 254.31及21.55 kDa
根据回归方程计算出高温高压法提取的甜菜粕多糖的主要是相对分子质量为337 224.41、33 484.53 kDa(二者之和占多糖的比例为96.68%)和0.74 kDa(占多糖比例3.32%)。酸法提取的甜菜粕多糖的相对分子质量为21 254.31 kDa(占多糖比例65.71%)和21.55 kDa(占多糖比例34.29%)。高温高压法提取的甜菜粕多糖分子质量大于酸法提取的甜菜粕多糖分子量,可能原因是酸法提取的甜菜粕多糖在酸性条件下发生分解,使分子质量减小。
3.7 高温高压法提取甜菜粕粗多糖的体外抗氧化活性测定
甜菜粕粗多糖的体外抗氧化活性见图5。

图5 甜菜粕粗多糖的体外抗氧化活性Fig.5 The antioxidant activity of polysaccharide
以Vc为对照,比较高温高压法提取的甜菜粕粗多糖的体外抗氧化活性,结果分析见表5。

表5 甜菜粕粗多糖的体外抗氧化活性测定结果Table 5 Results ofthe antioxidant activity of polysaccharide
由图5和表5可知,甜菜粕粗多糖对DPPH、羟自由基和还原能力都有一定的清除作用,并呈现良好的剂量依存关系。其中对DPPH清除能力最强,IC50=601.06 μg/mL,这可能是因为多糖中含有0.82%的阿魏酸,使其具有清除自由基的能力。但甜菜粕粗多糖对DPPH、羟自由基和还原能力的清除能力低于Vc。
4 结论
高温高压法提取甜菜粕多糖的最佳工艺条件为:固液比1∶30(g∶mL),时间 4 h,温度 115 ℃,该条件下,多糖得率为23.89%。高温高压法提取甜菜粕粗多糖对DPPH、羟自由基和还原能力都有一定的清除作用,并呈现良好的剂量依存关系。其中对DPPH清除能力最强,IC50=601.06 μg/mL。多糖含有30.54%的中性糖55.47%糖醛酸和0.82%的阿魏酸及少量的蛋白质。
[1] 彭小燕,木泰华,孙红男,等.甜菜果胶的结构、提取及乳化特性研究进展[J].核农学报,2014,28(6):1 070-1 075.
[2] 杨孝朴,文奋武,张小玲,等.甜菜颗粒干粕与甜菜渣提取果胶的比较研究[J].甘肃农业大学学报,1996,31(4):361-367.
[3] Hoshine,Hiroshi.Skin-lightning cosmetics comprising plant extracts and other actives[J].Kokai Tokkyo Koho Japan,2001,1(2):173.
[4] 宋扬,温兆霞,梁惠,等.果胶对大鼠体内脂质过氧化作用的影响[J].青岛医学学报.1997,33(3):231.
[5] E.ects of alkaline,hydrogen peroxide-treated fibers on nutrient digestibility,blood sugar and lipid profile in rats[J].Food Chemistry.1999,65:213-218.
[6] 张学杰,郭科,苏艳玲.果胶研究新进展[J].中国食品学报,2010,10(1):167-174.
[7] Rombouts F M,Thibault J F.Feruloylated pectic substances from sugar-beet pulp [J].Carbohydrate Research,1986,154(1):177-187.
[8] Oosterveld A,Grabber J H,Beldman G,Ralph J,et al.Formation of ferulic acid dehydrodimers through oxidative crosslinking of sugar beet pectin [J].Carbohydrate Research,1997,300(2):179-181.
[9] 李文德,张礼星.纤维素酶提取甜菜果胶的工艺条件[J].无锡轻工大学学报:食品与生物技术,1999,18(4):42-45.
[10] 马森,王文婷,陈志江,等.超声波-有机酸法提取甜菜废粕中果胶[J].中国甜菜糖业,2012,(2):22-25.
[11] 周林燕,廖红梅,廖小军,等.食品高压技术研究进展和应用现状[J].中国食品学报,2009(8):30.
[12] 朱俊杰.高压技术提取重要有效成分的工艺及机理研究[D].长春:吉林大学,2004.
[13] Yang LQ,Zhang LM.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers,2009,76:349-361.
[14] 许会升,张铁军,赵广荣,等.一种测定酸性多糖中糖醛酸和中性糖含量的改良方法[J].食品工业科技,2007,28(7):197-199.
[15] 宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1997.
[16] 夏荃,文惠玲,李士光,等.高效液相色谱法测定川穹不同炮制品种游离阿魏酸和总阿魏酸的含量[J].广州中医药大学学报,2009,26(4):384-387.
[17] 李根林,马永洁,孙静雅,等.火麻仁甾醇对 DPPH·及亚硝酸盐自由基清除作用的研究[J].中医学报,2013,28(5):693-695.
[18] 马永全,刘福瑜,于新.南药五味子提取物清除自由基活性的研究[J].食品工业,2010(3):1-3.
[19] Stratil P,Klejdus B,Kuban V.Determination of phenolic compounds and their antioxidant activity in fruits and cereals[J].Talanta,2006,8(12):1-12.
[20] Scholz H.Highly molassed sugar beet pulp in ruminant's nutrition.II.Concentrate with high rations of highly molassed dried sugar beet pulp in the feeding of lactating cows(author's transl)[J].DTW.1981,88(7):269-274.
[21] 王文婷.甜菜粕膳食纤维的提取与性质研究[D].广州:华南理工大学,2010.
[22] 孙元琳.当归多糖的制备、结构分析和抗辐射效应研究[D].无锡:江南大学,2006.

