重组木聚糖酶酶解玉米芯制备低聚木糖*
杨然,朱培华,姚君,李秀婷
1(北京工商大学食品质量与安全北京实验室,北京,10048)
2(北京工商大学食品添加剂与配料北京高校工程研究中心,北京,100048)
3(北京工商大学北京市食品风味化学重点实验室,北京,100048)
低聚木糖又称木寡糖,由2~7个木糖以β-1,4-糖苷键连接而成,以木二糖、木三糖为主,具有显著的双歧杆菌增殖能力,还具有不被消化性、无龋齿性及促进人体对钙的吸收等特性[1]。在我国,玉米作为重要的粮食经济作物,每年会产生大量的农业废弃物玉米芯,而玉米芯中木聚糖的含量高达35% ~40%[2]。采用适宜的提取方式获得丰富的玉米芯木聚糖资源,并应用酶解技术制备功能性低聚木糖,势必可以解决环境问题,同时变废为宝,创造经济附加值。
1 材料与方法
1.1 材料
1.1.1 原料、菌种与试剂
玉米芯原料,山东龙力公司馈赠;重组木聚糖酶,实验室制备重组毕赤酵母GS115发酵所得;木糖、木二糖、木三糖、木四糖、木五糖标品,购自Sigma公司;其他化学试剂均为国产分析纯。
1.1.2 培养基
YPD培养基:葡萄糖2%,胰蛋白胨2%,酵母提取物1%,琼脂1.5%;BMGY培养基:胰蛋白胨2%,酵母提取物 1%,甘油 1%,YNB 1.34%,生物素0.05%,KH2PO41.2%,KH2PO40.3%;BMMY培养基:胰蛋白胨2%,酵母提取物1%,甲醇0.5%,YNB 1.34%,生物素 0.05%,KH2PO41.2%,KH2PO40.3%。
1.2 实验方法
1.2.1 木聚糖酶活力的测定
木聚糖酶活力的测定参照DNS法[3]。取0.1 mL适当稀释的酶溶液,加入到0.9 mL用0.05 mol/L、pH 4.8的醋酸缓冲液配制的10 g/L榉木木聚糖底物溶液中,55℃反应5 min,用DNS法测定释放的还原糖量,利用木糖做标准曲线。木聚糖酶活力单位定义为:在上述条件下,每分钟水解木聚糖生成1 μmol还原糖所需要的酶量。
1.2.2 酶解还原糖含量的测定及组成分析
还原糖含量的测定采用DNS比色法[4]。分别取0.1 mL木聚糖酶水解液加入DNS试剂0.9 mL,沸水浴中煮沸5 min后显色,迅速冷却,用蒸馏水定容至刻度摇匀,540 nm波长处测定吸光度。以木糖为标准曲线计算水解液中还原糖含量。
酶解产物组成分析采用薄层层析法。展层剂:V(正丁醇)∶V(乙酸)∶V(高纯水)=2∶1∶1,展层 1 次。显色剂:V(甲醇)∶V(浓 H2SO4)=95∶5,130 ℃烘烤显色,同时用木糖~木五糖作标准样品。
1.2.3 玉米芯木聚糖含量的测定
本试验改进Hashimoto等[5]用地衣酚-盐酸法测定面粉中总戊聚糖含量的方法,用于玉米芯中木聚糖含量的测定。
称取1.875 g FeCl3和0.5 g地衣酚,将两者混合预溶于10 mL重蒸水中,后用30%HCl定容至250 mL备用。取0.5 g待测样品于研钵中,加入72%的H2SO45 mL,研磨样品1 h至样品完全成均匀乳状,将乳状物转入250 mL容量瓶中定容,充分混匀,滤纸过滤,上清液用地衣酚-盐酸法测总糖含量(mg/L)。

1.3 玉米芯木聚糖的制备
1.3.1 碱法提取玉米芯木聚糖
称取玉米芯100 g,按料液比1∶10添加去离子水1 000 mL,煮沸1 h,过滤,弃去上清液,以减少杂质对木聚糖得率的影响。再按料液比为1∶10添加10%的NaOH溶液,煮沸2 h,过滤,弃去滤渣,滤液用HCl中和至pH 7,8 000 r/min离心处理15 min,所得沉淀经多次洗涤即为玉米芯粗木聚糖,60℃烘干,待测得率。
1.3.2 蒸煮解法提取玉米芯木聚糖
称取玉米芯100 g,按料液比1∶10添加浓度为0.1% 的H2SO4溶液1 000 mL,60℃水浴12 h,过滤,弃去上清液,加水1 000 mL,121℃密封蒸煮2 h,过滤,弃去滤渣,调节pH值至7,醇沉,8 000 r/min离心处理15 min,取固体,透析,60℃烘干,待测得率。
1.4 酶解法制备玉米芯低聚木糖
1.4.1 单因素试验
利用重组毕赤酵母GS115发酵制备木聚糖酶XynA,并对碱法提取的玉米芯木聚糖进行酶解以制备低聚木糖。分别考察不同加酶量(5、10、15、20、25 U/mL;其他酶解条件为底物浓度2%,酶解温度50℃,酶解时间 4 h);不同底物浓度(0.5%、1%、1.5%、2%、2.5%);不同酶解时间(0.5、1、2、4、6、8 h);不同酶解温度(40、45、50、55、60 ℃)等条件对还原糖得率的影响。
1.4.2 响应面优化试验
根据单因素试验确定影响酶解的关键因素,利用Design-Expert软件设计组合试验,并采用 Box-Benhnken中心组合设计原理设计3因素3水平共17个试验点的响应面分析试验,以确定最佳酶解条件。
1.5 玉米芯木聚糖及低聚木糖制备得率的计算方法
玉米芯木聚糖得率计算公式:
玉米芯低聚木糖(还原糖)得率计算公式:
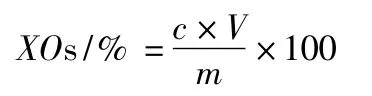
式中,Xm:玉米芯木聚糖得率,%;XOs:玉米芯低聚木糖(还原糖)得率,%;m:玉米芯粗木聚糖质量,g;M:玉米芯的质量,g;Y:玉米芯中木聚糖含量;Y`:玉米芯粗木聚糖含量;c:酶解液还原糖浓度,g/mL;V:酶解液体积,mL。
2 结果与讨论
2.1 玉米芯木聚糖的提取
低聚木糖的生产分为木聚糖的提取与水解,要获得低聚木二糖、木三糖较高的低聚木糖,木聚糖的提取十分关键[6]。根据半纤维素提取所使用的溶剂的不同,提取方法可归纳为三大类,即酸水解、碱水解和热水解法[7]。其基本原理都是破坏半纤维素与纤维素、木质素及其他成分间的结合键,从而使半纤维素游离出来[8]。本文分别考察了蒸煮法及碱提法对玉米芯粗木聚糖提取效果的影响,结果如图1所示。采用碱提法提取得到的玉米芯粗木聚糖得率为36.7%,此试验结果高于邵佩兰等人[9]采用同样方法提取的玉米芯粗木聚糖得率。而另一种木聚糖提取方法-蒸煮法,相对于碱提法对环境表现温和,但所得玉米芯粗木聚糖得率较低。
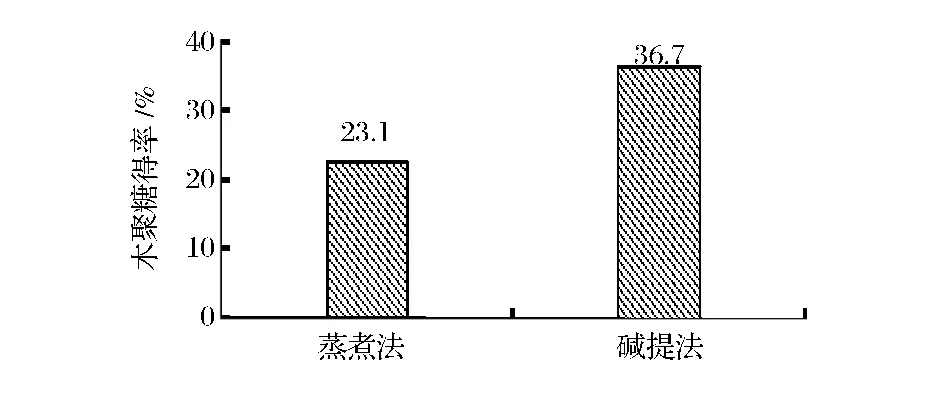
图1 不同提取方法对玉米芯粗木聚糖得率的影响Fig.1 The effect of different extraction methods on the yield of corn cob xylan
为进一步确定2种提取方法所得木聚糖原料对酶解制备低聚木糖的影响,将2种方法所得粗木聚糖经木聚糖酶酶解,产物经薄层层析展开,结果如图2所示。蒸煮法和碱提法所得木聚糖原料经木聚糖酶酶解后均可得到以木二糖、木三糖、木四糖及木五糖为主要产物的低聚木糖。然而,蒸煮法所得木聚糖在酶解过程中产生了部分木糖和糖醛类物质[10],这些产物的生成不利于低聚木糖的生产制备及分离纯化。因此,后续试验以碱提法获得的玉米芯粗木聚糖为底物制备低聚木糖。
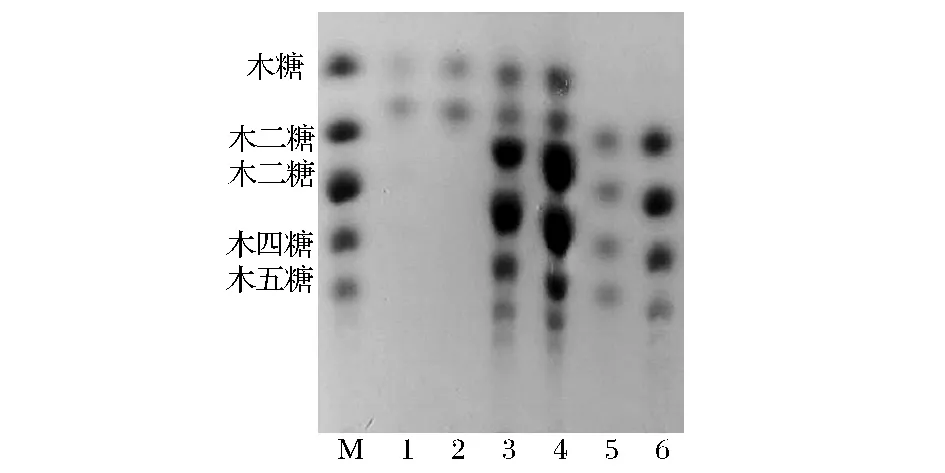
图2 不同方法提取玉米芯木聚糖酶解产物TLC分析图Fig.2 TLC analysis of hydrolyzate from corn cob xylan extraction by different menthods
2.2 酶解碱法提取玉米芯粗木聚糖制备低聚木糖
2.2.1 加酶量对还原糖得率的影响
本试验选择重组毕赤酵母GS115发酵制备的重组木聚糖酶XynA为酶解实验用酶。该重组菌株经BMGY培养基富集培养48 h后,无菌重悬至BMMY培养基中。每24 h添加0.5%甲醇诱导培养,至216 h后得到酶活力约为2 235 U/mL的木聚糖酶XynA。经测定,该重组木聚糖酶的最适反应温度为55℃,最适反应pH值为4.8,有较好的温度稳定性及耐酸性,适宜低聚木糖的生产应用。分别选择5、10、15、20、25 U/mL的木聚糖酶添加到酶解试验体系中,以确定酶解法制备玉米芯低聚木糖的最适加酶量,试验结果如图3所示。当加酶量在5~15 U/mL,玉米芯木聚糖的还原糖得率增幅缓慢,继续提高加酶量至20 U/mL时,还原糖得率最高为13.5%,继续增加加酶量,还原糖得率没有明显提高。

图3 加酶量对还原糖得率的影响Fig.3 The effects of the dosage of XynA on the yield of reducing suger
2.2.2 底物浓度对还原糖得率的影响
底物浓度对还原糖得率的影响结果如图4所示,当玉米芯粗木聚糖浓度为1%时,酶解所得还原糖得率最高,而继续增加底物浓度还原糖的得率明显降低。张金永等人同样以玉米芯为原料酶法制备低聚木糖,最适底物浓度为3%[11]。实际生产中,较高的底物浓度有利于生产成本的降低,然而底物浓度的提高往往会导致产品得率的下降。在高底物浓度环境下,体系黏度较大,影响了酶、底物和产物的扩散以及酶与底物的接触,从而降低了木聚糖酶的酶解效率[12]。
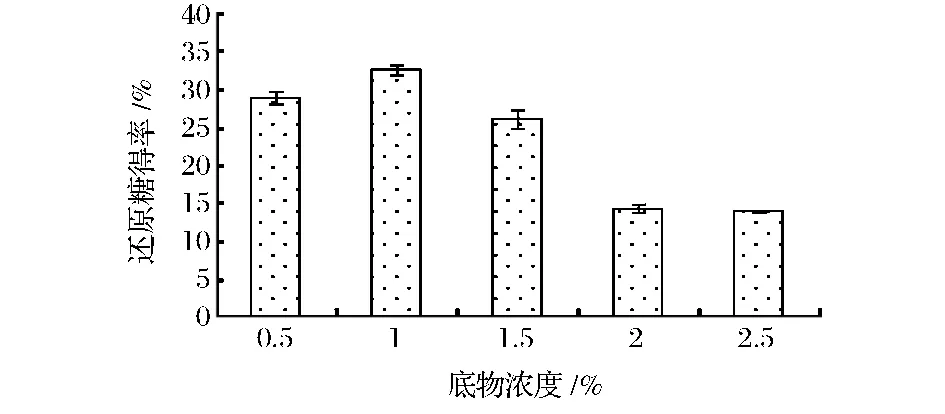
图4 底物浓度对还原糖得率的影响Fig.4 The effects of the substrate concentration on the yield of reducing suger
2.2.3 酶解温度对还原糖得率的影响
酶解温度对还原糖得率的影响如图5所示。随着酶解温度的升高,还原糖得率直线上升,至50℃时达到最大值约33%;继续升高酶解温度,还原糖得率反而降低,60℃时得率仅为峰值的41.2%。本试验所用木聚糖酶为重组酶,前期试验结果显示该酶的最适反应温度为55℃,在50℃左右该酶能保持良好的热稳定性和水解效果。韩玉洁等人研究以小麦麸皮为底物制备低聚木糖,其研究结果表明该酶解反应的最适温度为40℃[13]。一般来说,反应温度对酶解效果的影响是多方面的,在一定范围内,升高温度可以加快酶-底物中间体分解转化为产物的速度,然而温度过高会降低酶的稳定性,使其失去活性,最终影响酶的酶解效果[14]。
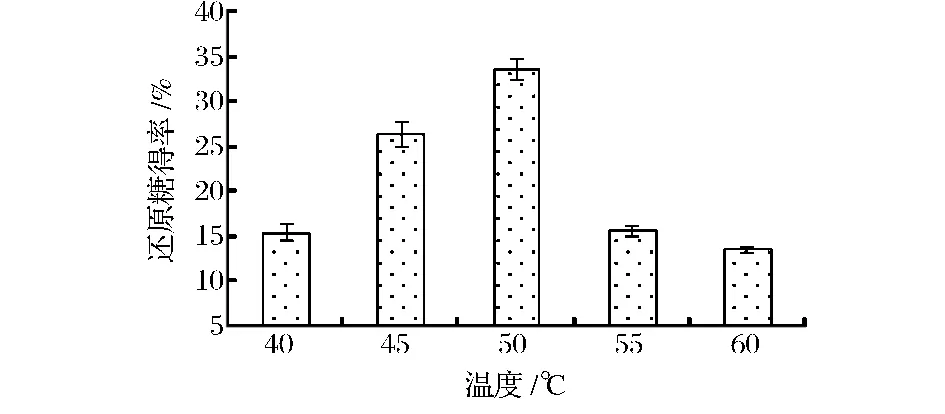
图5 酶解温度对还原糖得率的影响Fig.5 The effects of temperature on the yield of reducing suger
2.2.4 酶解时间对还原糖得率的影响
酶解时间对还原糖得率的影响如图6所示。随着酶解时间的延长还原糖得率逐渐上升。酶解0.5 h到4 h阶段还原糖得率上升速度较快(增长了3.3倍);4 h后反应体系中还原糖的浓度基本保持不变。随着反应时间的延长,木聚糖酶的活性逐渐降低,酶解效率下降;另一方面,底物的减少和酶解产物引发的反馈抑制效应进一步影响了木聚糖酶的酶解效力[15]。
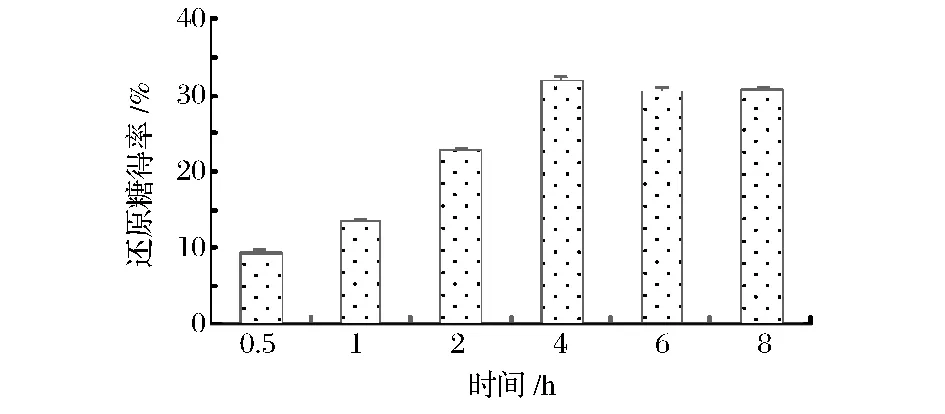
图6 酶解时间对还原糖得率的影响Fig.6 The effects of hydrolysis time on the yield of reducing suger
2.2.5 酶解条件的响应面优化
根据Design Expert 8.0.1的中心组合试验设计原理,依据酶解条件单因素试验结果选择对酶解影响最为显著的3个因素,即木聚糖底物浓度(A)、酶解温度(B)和酶解时间(C),以酶解产生还原糖得率为响应值,设计响应面优化试验,经软件设计共有17组组合试验,按各个组合试验因素要求完成了玉米芯木聚糖的酶解试验,各组合试验结果如表1所示。
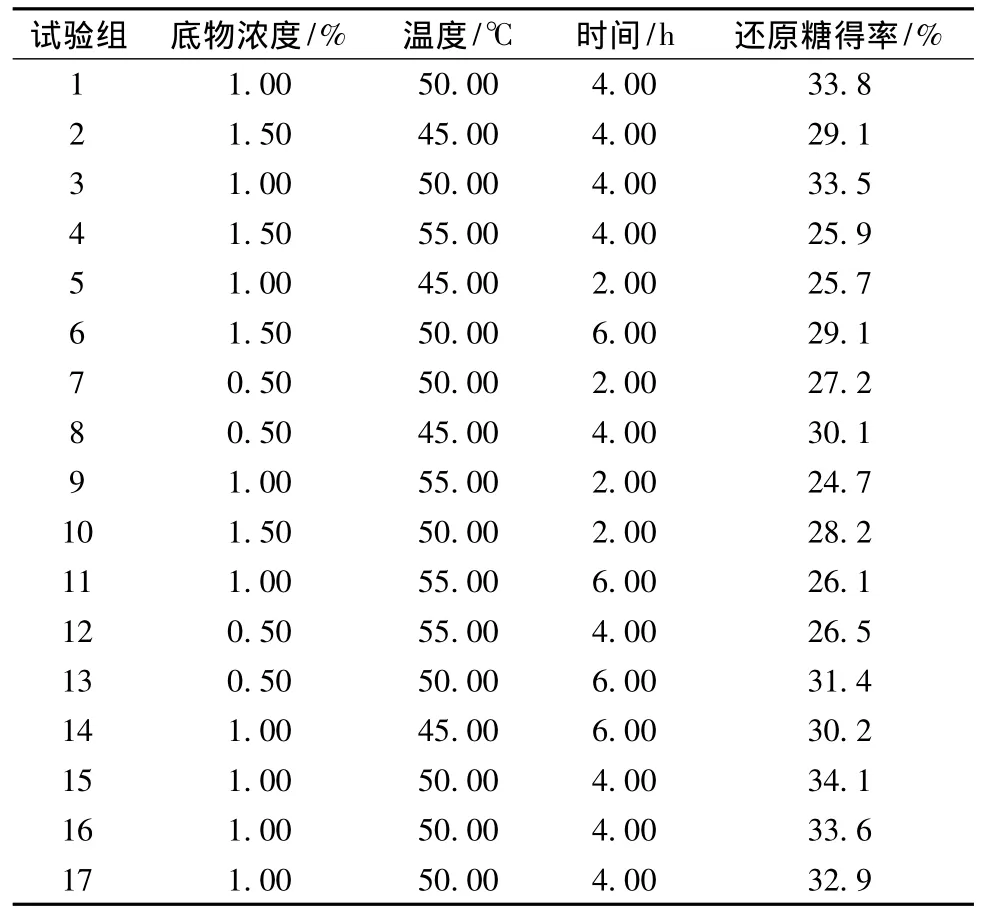
表1 Box-Behnken实验设计与结果Table 1 Design and results of Box-Behnken experiment
表2是本试验模型可信度统计分析结果,经分析可知预测相关系数(Pred-R-Squared)0.912 6与修正相关系数(Adj.R-square)0.971 9数值相近,说明此模型可信度较高。当噪音值大于4时,说明响应面模型拟合度理想,而本试验中噪音比数值为21.399,进一步说明此模型可操作性强,可用此模型对试验进行预测和分析。

表2 模型可信度分析表Table 2 Analysis of model reliability
利用Design-Expert软件对数据(表3)进行二次多项回归拟合,获得还原糖得率对底物浓度、酶解温度及酶解时间的二次多项回归方程:还原糖得率=33.58-0.19 A-1.50B+1.19C+0.100 A B-0.98AC-0.80BC-1.60 A2-4.08 B2-2.85 C2

表3 回归方程的方差分析Table 3 Test and results of significance for simulated regression coefficient
在影响还原糖得率的因素中,一次项B、C及二次项 AC、BC、A2、B2、C2即木聚糖底物浓度、酶解温度和酶解时间对木聚糖酶解效率的影响都非常显著。由此可知,各个具体试验因素对响应值的影响不是简单的一次线性关系,而符合曲线规律,如回归方程所示。方差试验结果分析中,失拟项F值为2.09,而P>F值为0.244 9,说明本模型可操作性较强,不易引起系统误差。
图7为底物浓度与酶解温度对还原糖得率的影响。当底物浓度为0.5% ~1.1%,酶解温度为45~51℃范围时,两者存在着显著的增效作用,玉米芯还原糖的得率随着底物浓度和酶解温度的增加而增加;而随着底物浓度和酶解时间的进一步增加,还原糖的得率反而降低。分析响应面曲面可知,底物浓度和酶解温度对玉米芯还原糖得率的交互影响显著,而温度因素的曲面弯曲度较大,说明该因素对还原糖得率的影响更为显著[17]。
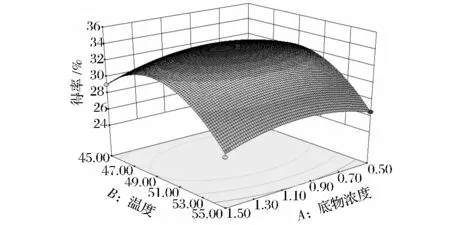
图7 底物浓度与酶解温度对还原糖得率的影响Fig.7 The effect of substrate concentration and temperature on the yield of reducing suger
图8为酶解温度和酶解时间对玉米芯还原糖得率的影响。当酶解温度在50℃左右,酶解时间在4 h左右时,响应面曲面出现峰值,说明酶解温度和酶解时间两因素对还原糖得率影响显著,且二者呈现明显的交互作用。
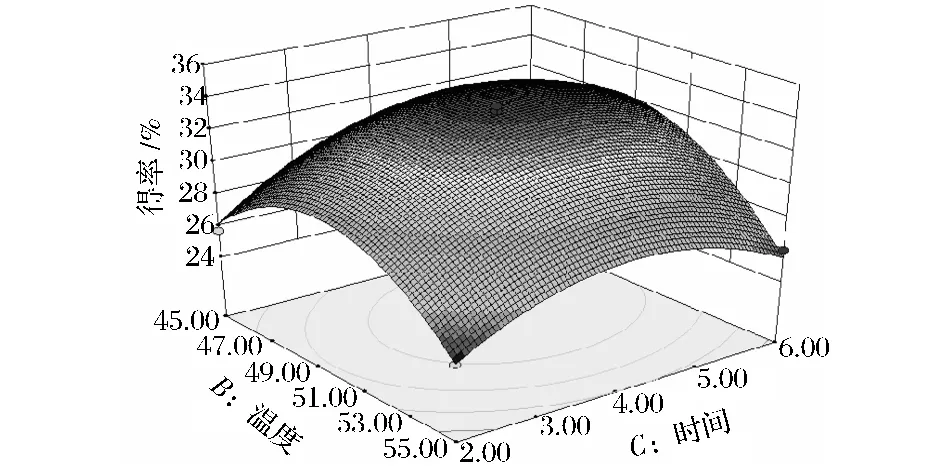
图8 酶解温度与酶解时间对还原糖得率的影响Fig.8 The effect of temperature and hydrolysis time on the yield of reducing suger
利用Design-Expert软件优化最佳酶解条件为木聚糖底物浓度0.9%、酶解温度49℃、酶解时间4.5 h,在此条件下得到实际还原糖可达33.9%,较单因素试验结果提高了约1.1%。欧阳嘉等人研究了重组木聚糖酶C0602生产低聚木糖的制备工艺,还原糖产率为29.76%,低于本试验研究结果[18]。
2.3 酶解产物组成分析
功能性低聚木糖是由2~7个D-木糖以β-1,4-木糖苷键结合而成的,由于低聚合度的糖具有独特的生理功能和良好的工艺性能,成为了低聚糖的主要功效成分,因此聚合度在2~4之间的低聚木糖在食品行业中的应用较为广泛[19]。本文按照优化实验条件酶解碱法提取玉米芯木聚糖,采用TLC分析其酶解产物大致组成。分析结果如图9所示,毕赤酵母所产重组木聚糖酶XynA酶解玉米芯木聚糖所得酶解产物主要为木二糖、木三糖,无木糖产生。酶解初始阶段,随着酶解时间的增加,木二糖、木三糖含量增加,且有少量木四糖、木五糖产生;8 h后木五糖及木四糖又逐渐酶解转化为木三糖及木二糖。由此可见,利用重组木聚糖酶XynA酶解玉米芯木聚糖生产低聚木糖具有良好的研究价值和应用前景。近年来,利用木聚糖酶酶解木聚糖制备低聚木糖的研究越来越普遍。汪辉等人利用木聚糖酶酶解豆皮制备低聚木糖,通过离子色谱检测酶解液中的糖分组成,发现酶解液中含有大量单糖[20];朱浩拥等人采用响应面法优化玉米芯木聚糖酶解制备低聚木糖的酶解条件,并利用TLC法分析酶解液中产物组成主要为木二糖、木三糖及木四糖且以木二糖、木三糖含量为主[21],与本试验结果分析基本一致。
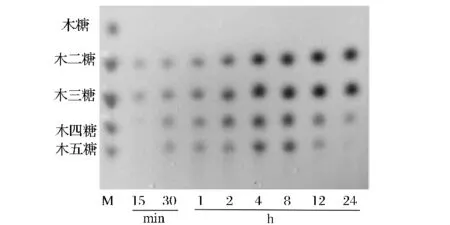
图9 碱法提取玉米芯木聚糖酶解产物TLC分析图Fig.9 TLC analysis of hydrolyzate of corn cob xylan by recombinant xylanases from Pichia pastoris
3 结论
(1)本试验考察了蒸煮法和碱提法对玉米芯木聚糖得率的影响,试验结果显示,以碱提法得到的木聚糖得率较高为36.7%,且分析二者酶解产物组成可知,碱提法所得木聚糖经酶解制备获得的低聚糖以木二糖-木五糖为主,无木糖及糖醛类物质产生,适宜作为酶解底物制备低聚木糖。
(2)通过单因素、响应面试验确定以碱提玉米芯木聚糖为原料制备低聚木糖的最佳条件:底物浓度0.9%,酶解温度49℃,酶解时间4.5 h,在此条件下得到实际还原糖量可达33.9%。另外,对酶解液的成分进行TLC分析,结果表明酶解碱提玉米芯木聚糖可产生以木二糖及木三糖为主要成分的低聚木糖溶液。
[1] 薛业敏,毛忠贵,邵蔚蓝.利用玉米芯木聚糖酶法制备低聚木糖的研究[J].中国酿造,2003(6):7-9.
[2] 唐伟,王立东,张丽萍.超声波前处理去麸皮中木聚糖提取率的影响[J].食品科技,2010,35(5):191-194.
[3] Bailey M J,Biely P,Poutanen K.Interlaboratory testing of methods for assay of xylanase activity[J].Journal of Biotechnology,1992,23(3):257-270.
[4] 李秀婷,孙宝国,宋焕禄.玉米芯水不溶性木聚糖的碱法提取及酶解分析[J].中国食品学报,2010,10(5):171-176.
[5] Hashimoto S,Shogren M D,Pomeranz Y.Cereal pentosans:Their Es2 timation and significance I.pentosans in wheat and milled wheat products[J].Cereal Chemistry,1987,64(1):30-34.
[6] 杨瑞金,许时婴,王璋.用于低聚木糖生产的玉米芯木聚糖的蒸煮法提取[J].无锡轻工业大学学报,1998,17(4):50-53.
[7] Benko Z,Andersson A,Szengyel Z,et al.Heat extraction of corn fiber hemicellulose[J].Applied of Biochemical Biotechnolgy,2007,137-140(1-12):253-265.
[8] 王俊丽,聂国兴,臧明夏,等.玉米芯木聚糖的碱法提取及其酶解产物研究[J].河南农业科学,2012,41(3):157-160.
[9] 邵佩兰,徐明,李海峰,等.碱法提取玉米芯木聚糖的研究[J].宁夏农学院学报,2000,21(4):47-49.
[10] 罗晓风.玉米芯酶法制取低聚木糖的研究[D].武汉:华中农业大学,2005.
[11] 张金永,丁兴红,夏黎明.以玉米芯为原料酶法制备低聚木糖的研究[J].食品与发酵工业,2006,32(2):71-73.
[12] 黄家骥.酶法水解玉米芯木聚糖制备低聚木糖[D].无锡:江南大学,2004.
[13] 韩玉洁,徐冬,徐忠.酶法制备低聚木糖的研究[J].哈尔滨商业大学学报(自然科学版),2007,23(3):268-272.
[14] 张帆,李敏康,宋宏新.两种酶法制备麦麸低聚木糖的比较[J].陕西科技大学学报,2013,31(4):105-109.
[15] Chapla D,Pandit P,Shaha A.Production of xylooligosaccharides from corncob xylan by fungal xylanase and their utilization by probiotics[J].Bioresource Technology,2011(115):215-221.
[16] 姚笛,马萍,王颖,等.响应面法优化玉米芯中木聚糖的提取工艺[J].食品科学,2011,32(2):111-115.
[17] 宋娜,丁长河,李里特.响应面分析法优化微波处理玉米芯酶法制备低聚木糖工艺[J].食品科技,2006(12):169-173.
[18] 欧阳嘉,刘明,李鑫,等.重组木聚糖酶生产低聚木糖的实验研究[J].林产化学与工业,2011,31(2):38-42.
[19] Loo J V,Cummings J,Delzenne N,et al.Functional food properties of non-digestible oligosaccharidesa consensus report from the ENDO project(DGXII-AIRIICT94-1095)[J].British Journal of Nutrition,1999,81(2):121-132.
[20] 汪辉,李爱军,欧仕益,等.酶法制备豆皮低聚木糖的工艺研究[J].食品科学,2010,31(8):51-55.
[21] 朱浩拥,王俊丽,吴春,等.酶法制备玉米芯低聚木糖工艺条件的研究[J].粮食与饲料工业,2011(12):54-57.

