黑果枸杞内生真菌RER4化学成分研究
杨秀芳,王鹏飞,马养民(陕西科技大学化学与化工学院教育部轻化工助剂化学与技术重点实验室,陕西西安 710021)
黑果枸杞内生真菌RER4化学成分研究
杨秀芳,王鹏飞,马养民
(陕西科技大学化学与化工学院教育部轻化工助剂化学与技术重点实验室,陕西西安 710021)
摘 要:根据形态学特征和ITS序列对分离自黑果枸杞根部的内生真菌RER4进行鉴定,结果该真菌鉴定为米曲霉(Aspergillus oryzae).采用大米固体培养基对RER4进行发酵,利用多种色谱方法从乙酸乙酯提取物中分离纯化得到8个化合物,借助ESI-MS、NMR等波谱技术鉴定其结构分别为:麦角甾醇(1)、尿黑酸内酯(2)、6-柠檬酸甲酯(3)、琥珀酸(4)、1,5-柠檬酸二甲酯(5)、赤薛醇(6)、甘露醇(7)、阿拉伯糖醇(8).其中化合物尿黑酸内酯首次从米曲霉发酵物中分离得到.
关键词:黑果枸杞;内生真菌;米曲霉;化学成分;结构鉴定
0 引言
黑果枸杞(Lycium ruthenicum)为茄科枸杞属植物[1],是我国西北荒漠地区一种特有的野生植物资源[2].据《四部药典》、《晶珠本草》等藏药经典记载,其味甘,性平,用于治疗心热病,心脏病,月经不调,停经等病症,属于传统藏药[3].
植物内生真菌是一个多样性十分丰富的生物类群,其物种丰富,数量庞大,可产种类繁多、结构新颖的次生代谢产物[4].现代研究表明,一些内生真菌的次生代谢产物具有与宿主植物代谢产物相同或相似的化学结构和生物活性,而有些则是具有药用生物活性的其它代谢产物,且极有可能是未被开发的新化合物[5].因此,对这类相对未被开发的微生物资源进行化学成分研究,从中分离具有药用价值的次生代谢产物及潜在生物活性的化合物不仅能够丰富人类的药物宝库,还能够缓解由于过度开采药用植物带来的资源危机.因而引起人们的广泛关注,成为目前研究的热点之一.
对黑果枸杞内生真菌研究仅限于本课题组,分离得到81株内生真菌[6],其中对内生真菌E21、R43已进行分离研究[7,8].本研究以一株分离自黑果枸杞根部的真菌米曲霉(Aspergillus oryza,编号RER4)为研究对象,对其发酵产物进行分离,得到8个化合物.本研究完善了对黑果枸杞内生真菌的研究,为进一步开发利用黑果枸杞内生真菌奠定了一定的工作基础.
1 材料与方法
1.1 菌株
菌株RER4分离自甘肃省靖远县的黑果枸杞植物的根部,经纯化培养后以PDA斜面培养基4℃保存于本实验室.四株活性测试细菌大肠杆菌、绿脓杆菌、金黄色葡萄球菌和枯草芽孢杆菌由本实验室保存.
1.2 仪器、培养基及试剂
AVANCEIII-400超导核磁波谱,瑞士布鲁克拜厄斯宾有限公司;Bruker-avanceⅢ-400Hz,德国布鲁克公司;SGWX-4显微熔测定仪,北京市科仪电光仪器厂;200-300目柱色谱硅胶,青岛海洋化工厂;薄层色谱硅胶,青岛海浪硅胶干燥剂厂;SephadexLH-20柱色谱凝胶,上海浩然生物技术有限公司.
PDA培养基:马铃薯(去皮)200.0g,葡萄糖20g,琼脂18g,水1 000mL.察氏培养基:琼脂1.5 ~2.0g,蔗糖3g,NaNO30.3g,K2HPO40.1g,KCl 0.05g,FeSO40.001g,MgSO4·7H2O 0.05 g,蒸馏水100mL,pH7.0~7.2.以上所用试剂均为国产分析纯试剂.
1.3 内生真菌的分离与纯化
取黑果枸杞根部样品,用自来水洗净表面并晾干,用无菌水冲洗3遍,75%酒精浸泡2min,之后于2%的次氯酸溶液浸泡1min,随后用75%酒精浸泡1min,再用无菌水清洗,用滤纸吸干表面水分备用.将组织切块,置于PDA培养基中,28℃恒温培养.待菌丝长出后,挑取尖端菌丝转接至新的培养基上,几次纯化后得到共附生真菌并转接到试管斜面上保存备用.
1.4 菌种鉴定
1.4.1 形态学鉴定
将供试菌株RER4接种于PDA平板上,置于28℃培养3~7d,观察记录菌落、菌丝生长状态、培养基基底有无染色和孢子形态等特征,以其作为依据进行鉴定[9].
1.4.2 分子生物学鉴定
将活性菌株RER4接种于察氏液体培养基中,28℃、120rpm培养3d后过滤,过滤后得到菌丝体.利用CTAB法提取菌丝体基因组DNA,采用1%琼脂糖凝胶电泳检测其纯度和浓度.以提取到的基因组DNA为模板,通过引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)以及ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行扩增目标菌株18SrDNA区域.
PCR反应体系为:Template(基因组DNA)0.5μL,5×Buffer(with Mg2+)2.5μL,dNTP(各2.5 mM)1μL,ITS1(10μM)0.5μL,ITS4(10μM)0.5 μL,加双蒸馏水至25mL.
PCR循环程序为:98℃进行预变性3min,后在98℃下变性25s,在55℃下退火25s,72℃延伸1 min,持续30个循环后,72℃修复延伸10 min,4℃下终止反应保存待用.
取5.0μLPCR扩增产物,用EB(Ethidium bromide,溴化乙锭)染色,在1%琼脂糖溶液中电泳,150V、100mA条件下观察20min,记录电泳结果.将PCR产物电泳条带切割后,用PCR引物进行测序.将得到的ITS序列在Genban(http://ncbi.nlm.nih.gov/blast)中进行Blast分析,用MEGA5.0(邻接法Neighbor-Joining)构建系统发育树.对分离菌株与数据库中登陆的近源菌株系统发育树关系进行分析[10].
1.5 发酵和代谢产物分离
1.5.1 内生真菌的发酵
将活化后的菌株RER4接种在PDA培养基上,28℃下培养,待长满培养基后,用打孔器制成直径为6mm的菌饼,按每100mL察氏培养基中接种1个菌饼的量,接种2L,在28℃、120rpm的摇床中振荡6d.将上述种子液按培养基10%的量加入灭菌后的大米培养基中,在室温下静置培养28d.
1.5.2 代谢产物的提取
将风干的固体发酵物用乙酸乙酯萃取后减压浓缩得240g提取物,提取物采用硅胶柱色谱分离,以石油醚、石油醚/乙酸乙酯、乙酸乙酯/甲醇、甲醇为溶剂进行梯度洗脱,得到5个组分(Fr.1-Fr.5).
1.5.3 各组分抑菌试验
采用滤纸片法对上述5个组分进行抑菌活性测试,结合化学成分预实验,确定分离纯化的组分,分离代谢产物.
1.5.4 代谢产物的分离及结构鉴定
在活性测试的基础上,对活性高的组分以石油醚/乙酸乙酯、乙酸乙酯/甲醇梯度洗脱,各组分多次使用硅胶柱层析、凝胶柱层析、重结晶等手段获得单体纯品化合物,所有化合物经1H-NMR和13CNMR分析,并与文献数据对比,确定其结构.
2 结果与讨论
2.1 菌株RER4的鉴定
首先对RER4进行形态学鉴定.其菌落外观为黑褐色,边缘为白色菌丝,在PDA培养基中无色素产生.显微镜下观察,RER4菌丝发达多枝,具有大而饱满的孢子囊,孢子密集而且易散落,因此初步确定内生真菌为曲霉属真菌(如图1所示).其次对其进行分子生物学鉴定,经PCR扩增后得到的ITS序列长576bp,该序列与米曲霉(Aspergillus oryzae)序列(HQ285587.1)的同源性为99%,进化树(图2)显示,RER4与米曲霉聚在一支,支持率为100%.综合形态学特征和ITS序列分析结果,最终确定RER4为米曲霉(Aspergillus oryzae),Genbank登录号为KF198066.
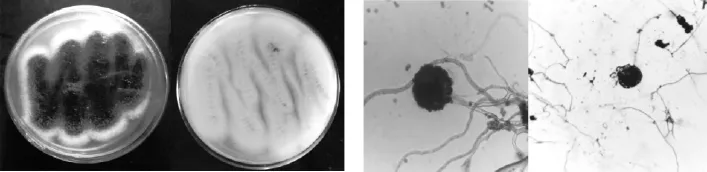
图1 内生真菌RER4形态学特征
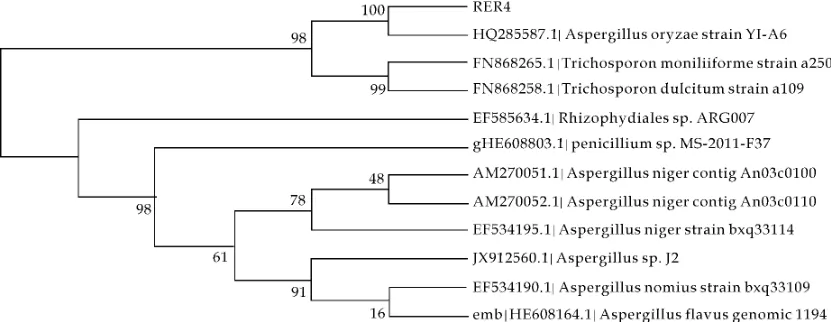
图2 基于18SrDNA-ITS序列的菌株RER4系统进化树

表1 RER4代谢产物不同组分抑菌活性
2.2 发酵提取物的抑菌活性
采用滤纸片法,将5个组分对4株细菌进行抑菌活性测试,测试结果见表1.测试结果表明:5个组分对4株细菌生长表现出不同程度的抑制作用,其中Fr.2、Fr.3以及Fr.4对于4株细菌生长抑制作用较强.结合化学成分分析结果,确定Fr.2、Fr.3 和Fr.4为分离对象.
2.3 代谢产物的结构鉴定
从黑果枸杞内生真菌RER4发酵物的乙酸乙酯萃取物Fr.2、Fr.4中共分离出8个单体化合物(Fr.3分离的化合物另行报道),利用波谱技术结合理化性质对这8个化合物进行了结构鉴定,结果如下:
(1)化合物1
白色针状结晶(甲醇),mp:127.4℃~128.1℃,Lieberman-Burchard反应为阳性,1H-NMR (400 MHz,CDCl3)δ:3.66(1H,m,H-3),5.59 (1H,d,J=3.2Hz,H-6),5.40(1H,t,J=2.0Hz,H-7),0.65(3H,s,H-18),0.95(3H,s,H-19),1.05 (3H,d,J=6.5 Hz,H-21),5.21(2H,m,H-22,23),0.85(6H,t,J=6.4Hz,H-26,27),0.93(3H,d,J=6.9Hz,H-28);13C-NMR(100MHz,CDCl3)δ:38.38(C-1),31.99(C-2),70.47(C-3),40.79(C-4),139.79(C-5),119.59(C-6),116.29(C-7),141.40(C-8),46.23(C-9),37.03(C-10),21.12(C-11),39.07(C-12),42.82(C-13),54.56(C-14),23.01(C-15),28.32(C-16),55.70(C-17),12.06(C-18),17.63(C-19),40.47(C-20),21.12(C-21),135.58(C-22),131.97(C-23),42.82(C-24),33.09(C-25),9.67(C-26),19.98(C-27),16.29(C-28).以上数据与文献[11]报道的基本一致,故确定化合物1为麦角甾醇.结构式如图3所示.
(1)化合物2
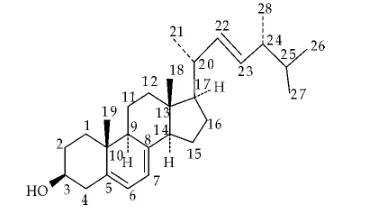
图3 麦角甾醇
橘色针状晶体(甲醇),mp:137.2℃~139.5℃,负源HRESI-MS:m/z,[M-H]-=149.023 9,提示化合物的分子量为150.031 6,推测化合物的分子式为C8H6O3,不饱和度为6.1H-NMR(400 MHz,DMSO-d6)δ:3.85(2H,s,H-3),6.76(1H,d,J=3.2 Hz,H-6),5.40(1H,t,J=2.0 Hz,H-7),0.65(3H,s,H-18),0.95(3H,d,J=2.4Hz,H-5),9.35(1H,s,6-OH),6.66(1H,dd,J=8.6,2.4 Hz,H-7),6.97(1H,d,J=8.6Hz,H-8);13C-NMR (100 MHz,DMSO-d6)δ:33.73(C-2),112.26(C-3),147.18(C-4),114.60(C-5),110.99(C-6),154.32(C-7),125.57(C-8).以上数据与文献[12]报道基本一致,结合HMBC确定化合物2为尿黑酸内酯,其结构如图4所示.

图4 尿黑酸内酯
(3)化合物3
无色晶体(甲醇),mp:144.8~146.1℃,负源HRESI-MS:m/z,[M-H]-=205.034 1,化合物的分子量为206.041 9,分子式为C7H10O7.1H-NMR (400 MHz,DMSO-d6)δ12.35(2H,brs,-COOH),5.53(1H,s,-OH),3.62(3H,s,-CH3O),2.78(2H,d,J=15.2Hz,H-4),2.64(2H,d,J=15.2Hz,H-2).13C-NMR(100MHz,DMSO-d6)δ:171.59(C-1),43.46(C-2),73.37(C-3),43.46 (C-4),171.59(C-5),173.89(C-6),52.45(C-7).以上数据与文献[13,14]基本一致,故确定化合物3为6-柠檬酸甲酯,结构如图5所示.
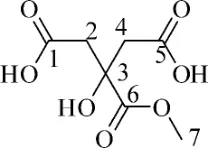
图5 6-柠檬酸甲酯
(4)化合物4
无色晶体(甲醇),mp:184.9℃~186.0℃,1H-NMR(400MHz,DMSO-d6):δ12.16(1H,s,-COOH),2.42(2H,s,H-2,H-3);13C-NMR (100MHz,DMSO-d6):δ174.08(C-1,C-4),29.22 (C-2,C-3),化合物4的核磁数据与文献报道[15,16]的基本一致,故确定化合物4为琥珀酸,结构如图6所示.

图6 琥珀酸
(5)化合物5
无色晶体(甲醇),mp:95.2℃~96.8℃.和化合物3的核磁谱图区别在于1H-NMR(400 MHz,DMSO-d6)在δ3.57(6H,s)处给出了两个甲氧基质子信号.以上核磁数据与文献[17,18]报道的基本一致,确定化合物5为1,5-柠檬酸二甲酯,其结构如图7所示.

图7 1,5-柠檬酸二甲酯
(6)化合物6
无色晶体(甲醇),mp:125.2℃~126.5℃.1HNMR(400 MHz,DMSO-d6)δ4.38(4H,s,-OH),3.53(2H,m,H-2,H-3),3.36(4H,m,H-1,H-4);13C-NMR(100 MHz,DMSO-d6)δ72.51(C-2,C-3),63.28(C-1,C-4).化合物6核磁数据与文献[19]报道的赤薛醇基本一致,结构如图8所示.

图8 赤薛醇
(7)化合物7
白色粉末,mp:166.2℃~167.9℃.1H-NMR (400MHz,DMSO-d6)δ4.33(2H,t,J=5.2 Hz,OH-1,6),4.41(2H,d,J=5.2Hz,OH-2,5),4.14 (2H,d,J=7.1Hz,OH-3,4),3.61(2H,m,H-2,H-5),3.54(2H,t,J=7.7Hz,H-3,H-4),3.42(4H,m,H-1,H-6);13C-NMR(100 MHz,DMSO-d6)δ63.82(C-1,C-6),69.66(C-2,C-5),71.29(C-3,C-4).化合物7的核磁数据与文献[20]报道的甘露醇基本一致,故确定化合物7为甘露醇,结构如图9所示.
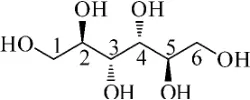
图9 甘露醇
(8)化合物8
无色晶体(甲醇),mp:101.3℃~102.8℃.1HNMR(400MHz,DMSO-d6):δ4.19(1H,d,J=5.6 Hz,1-OH),4.42(1H,d,J=5.6Hz,2-OH),4.45(1H,d,J=5.6Hz,3-OH),4.32(1H,t,J=5.6Hz,4-OH),4.12(1H,d,J=6.8Hz,5-OH),3.66(1H,m,H-2),3.59(1H,m,H-3,),3.45(1H,m,H-4),3.29(H-1),3.41(H-5).13C-NMR(100 MHz,DMSO-d6):δ62.86(C-1),70.47(C-2),71.40(C-3),70.11(C-4),63.68(C-5).以上核磁数据与文献[21]报道的阿拉伯糖醇基本一致,故确定化合物8为阿拉伯糖醇,结构如图10所示.
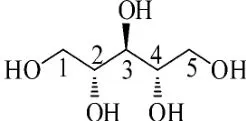
图10 阿拉伯糖醇
3 结论
根据形态学特征和ITS序列分析结果,把分离自黑果枸杞根部的内生真菌RER4鉴定为米曲霉(Aspergillus oryzae).从其固体发酵产物乙酸乙酯萃取相中得到5个组分,抑菌试验表明,Fr.2、Fr.3以及Fr.4对于细菌生长有较强抑制作用;从Fr.2及Fr.4中分离得到8个化合物,其中尿黑酸内酯首次从米曲霉发酵物中分离得到,这一化学成分的获得,表明植物内生真菌具有丰富多样的次生代谢产物,是开发新型药物的重要来源,这对进一步开发与利用黑果枸杞植物资源奠定了基础.
参考文献
[1]白红进,汪河滨,褚志强,等.不同方法提取黑果枸杞多糖的研究[J].食品工业科技,2007,28(3):145-146.
[2]陈红军,侯旭杰,白红进,等.黑果枸杞中的几种营养成分的分析[J].中国野生植物资源,2002,21(2):55.
[3]甘青梅,骆桂法,李普衍.藏药黑果枸杞开发利用的研究[J].青海科技,1997,4(1):17-19.
[4]杨春平,陈华保,吴文君,等.植物内生真菌次生代谢产物的多样性及潜在应用价值[J].西北农业学报,2005,14 (2):126-132.
[5]颜日明,李希茜,汪 涯.蛇足石杉内生真菌Shiraia sp.Slf14化学成分及其抑菌活性研究[J].天然产物研究与开发,2014,26(9):1 393-1 397.
[6]王 维,马养民,张弘弛,等.藏药黑果枸杞内生真菌的分离鉴定及抑菌活性研究[J].中国药学杂志,2013,48(4):23-27.
[7]王 维,马养民,张弘弛,等.黑果枸杞内生真菌E21菌株次生代谢产物的研究[J].中国新药杂志,2013,22(4):461-464.
[8]李 婷,马养民,马聪聪,等.黑果枸杞内生真菌R43的代谢产物的研究[J].中国新药杂志,2014,23(19):2 298-2 303.
[9]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,
1979:129-136.
[10]董庆霖,陈 博,邢向英,等.一株蓝藻内生真菌的鉴定及其产物抑菌活性[J].化工学报,2011,62(6):1 656-1 661.
[11]许明峰,沈莲清,王奎武.雷丸化学成分的研究[J].中草
Chemical constituents of endophytic fungi RER4fromLycium ruthenicum
YANG Xiu-fang,WANG Peng-fei,MA Yang-min
(College of Chemistry and Chemical Engineering,Key Laboratory of Auxiliary Chemistry &Technology for Chemical Industry,Ministry of Education,Shaanxi University of Science &Technology,Xi′an 710021,China)
Abstract:The fungus strain RER4isolated from the root of Lycium ruthenicum.Was identified as Aspergillus oryzae by its morphological characteristics and internal transcrised spacer (ITS)sequence analyses.Solid state fermentation was used to culture the endophytic fungi RER4on the rice medium,8compounds were isolated and purified from the eyhyl acetate extract of endophytic fungi RER4by various chromatographic methods and their structures were ergosterol,5-hydroxy-benzofuran-2(3H)(-)one,3-hydroxy-3(-)(methoxycarb onyl)pentanedi-oic acid,succinic acid,2-hydroxy-4-methoxy-2(-)(2-meth oxy-2-oxoethyl)(-)4-oxobutanoic acid,erythritol,mannitol,adonitol by ESI-MS and NMR.Among compound 5-hydroxybenzofuran-2(3H)(-)one was firstly isolated from the medium of Aspergillus oryzae.
Key words:Lycium ruthenicum;endophytic fungi;Aspergillus oryzae;chemical constituents;structural elucidation
作者简介:杨秀芳(1963-),女,陕西铜川人,教授,研究方向:天然产物加工
基金项目:教育部高等学校博士学科点专项基金项目(20116125110001)
收稿日期:2015-03-21
文章编号:1000-5811(2015)04-0121-06
文献标志码:A
中图分类号:R932

