联合常规核型分析和FISH在儿童急性淋巴细胞白血病中的应用价值
陈万紫,黄慧芳,陈加弟,林晓岚,傅 蔷(福建医科大学附属协和医院福建省血液病研究所,福建省血液病学重点实验室,福州 350001;通讯作者,E-mail:huanghuif@126.com)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是最常见的儿童白血病类型。细胞遗传学特征是目前公认的具有独立预后价值的指标[1],在形态学检查与免疫表型分析的基础上,检测患者遗传学异常对于指导儿童ALL危险度分层、判断预后及“量身定制”治疗方案具有重要作用。本研究采用间期荧光原位杂交((fluorescence in situ hybridization,FISH)技术,6组特异性 DNA探针检测189例儿童ALL骨髓标本的遗传学异常,并与常规染色体核型分析结果相比较,旨在探讨核型分析联合FISH技术检测儿童ALL遗传学异常的临床价值。
1 对象与方法
1.1 病例
189例ALL患儿2013-01~2014-12在福建医科大学附属协和医院血液科就诊住院,符合ALL的WHO标准[2]。其中男105例,女84例;年龄16-156个月,中位年龄为63个月。
1.2 R显带技术核型分析
采用直接法和短期培养法制备骨髓染色体标本,并采用常规R显带技术进行核型分析。染色体核型依《人类细胞遗传学国际命名体制(ISCN2013)》的规定进行描述。剩余细胞悬液保存于-20℃备用。
1.3 组合FISH检测
1.3.1 标记探针 探针选择 TEL/AML1,BCR/ABL,MLL,CSF4,CSP10 与 CSP17(北京金菩嘉医疗科技有限公司)。
1.3.2 FISH检测 将骨髓细胞悬液滴片,严格按照探针试剂盒提供的FISH操作说明书操作。
1.3.3 荧光显微镜检测及结果判断 用Olympus BX51荧光显微镜,油镜下通过 DAPI、FITC与RHOD滤光片计数300个细胞内荧光杂交信号,不计数重叠细胞。
1.4 统计分析
使用统计软件SPSS17.0进行统计分析,计数资料以率表示,率的比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 常规染色体R显带核型分析结果
189例患儿骨髓标本中培养成功的有151例(79.89%),检出异常核型 58 例(38.41%),其中仅染色体结构异常者23例,仅数目异常的18例,同时合并染色体数目和结构异常17例。染色体结构异常涉及的染色体依次为9号(18/40),14号(9/40),6号(8/40),8 号(7/40),22 号(7/40),19号(6/40)等。
本研究共检出高超二倍体(染色体数目>50)19例(12.58%),低超二倍体(染色体数目47-50)7 例(4.64%),假二倍体 3 例(1.99%),亚二倍体 7例(4.64%)。常见增多的染色体按检出率从大到小依次为 21号,10号,4号,17号,18,14号,8号,6号,22号,11号,12号及X染色体等。本研究检测到的染色体易位见表1。

表1 ALL儿童检测到的染色体易位分布Table 1 Incidence of various types of chromosome translocation in 189 children with ALL
2.2 FISH检测结果
189例标本均进行组合FISH检测,129例检测出异常(68.25%),60 例未检出异常(31.75%)。在检出的异常中常见的有+17(92/129,71.13%),+10(90/129,69.77%),+4(56/129,43.14%),AML1信号扩增(57/129,44.19%),BCR 信号扩增(30/129,23.26%),TEL/AML1 融合(39/129,30.23%),MLL 断裂(21/129,16.28%),ABL 信号扩增(17/129,13.18%),TEL 信号扩增(18/129,13.95%),BCR/ABL融合(10/129,7.75%)。38例骨髓标本未培养成功的患者中FISH检出异常的有23例(60.52%),93例正常核型经FISH检测出异常的有67 例(72.04%)。
本研究中,39例(39/189,20.63%)FISH 检出TEL/AML1融合基因,10 例(10/189,5.29%)检出BCR/ABL融合基因,TEL/AML1检出率明显高于BCR/ABL(χ2=18.38,P <0.05)。
2.3 常规核型分析与FISH检测的方法学比较
表2结果显示,189例标本中有148例检出遗传学异常,单独FISH检出129例,而染色体核型分析仅检出58例。可见,FISH检测儿童ALL遗传学异常阳性率明显高于常规染色体核型分析(χ2=46.25,P <0.005)。
染色体核型正常的标本通过FISH检测出异常的67例(67/93,72.04%),在染色体制备失败的38例标本中 FISH检出异常的有23例(23/38,60.53%),两者无统计学差异(χ2=0.18,P >0.05)。
本研究中,有 19例(19/189,10.05%)标本FISH未检出异常,但通过常规核型分析检出了染色体数目和/或结构异常。
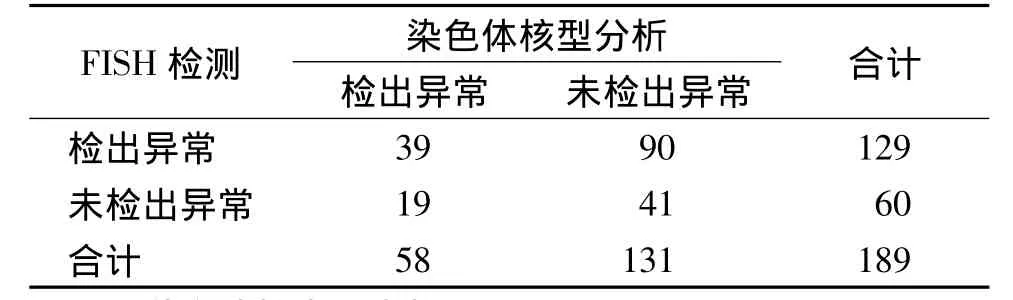
表2 染色体核型分析与FISH检出遗传学异常的比较 (例)Table 2 Comparison of chromosomal abnormalities detected by CCA and FISH (cases)
3 讨论
常规核型分析主要检测染色体数目和结构异常,对白血病的预后判断与指导临床治疗至关重要。细胞遗传学特征是目前公认的具有独立预后价值的指标[1],但遗传学异常的检出率有较多的影响因素,本组资料显示联合常规核型分析和组合FISH检测可将儿童ALL的遗传学异常检出率提高至78.31%,与文献报道相近[3]。在常规核型分析方面,儿童 ALL染色体制备成功率不高,本研究为79.89%,略高于刘青等的报道[4],但异常检出率(38.41%)低于文献报道[4-5]。本研究中 151 例骨髓培养成功的标本中高超二倍体占12.58%,低超二倍体占4.64%,亚二倍体占 4.64%,假二倍体占1.99%,与郭哗等[6]的报道相近。Sutcliffe 等[7]研究表明4、10或17号染色体三体提示预后较好,在本研究有129例标本FISH检测出不同程度的遗传学异常(68.25%),且主要数目异常为 +17,+10,+4等。本组FISH检测出主要的融合基因为TEL/AML1(20.63%),这与 Rubnitz 等[8]的研究相近。1994年Romana等[9]用FISH方法发现儿童ALL的隐匿性重现型易位t(12;21)。该易位产生的融合基因 TEL/AML1被证实是其发病的关键[10],但t(12;21)用染色体核型分析检出率不足0.05%[11]。本研究R显带分析未能检出t(12;21),这与其只能分析大于1条带即相对分子量>104×103的异常,而且无法检出亚显微水平的染色缺失或重排有关[12]。儿童 ALL常见另一个融合基因是 BCR/ABL,研究表明Ph染色体对儿童ALL具有独立的预后价值[13],在本组研究中,确定的有Ph染色体的患儿10 例(5.29%),与文献报道相近[14]。
FISH技术能对间期和中期细胞进行分析,扩大了可检测的细胞群体,其采用原位杂交技术,定位至小片段基因,能分辨较小的染色体易位或缺失区域(相对分子质量50×103左右)等[15],这在一定程度上弥补了核型分析的不足,提高了异常检出率。在本研究中染色体核型正常或染色体制备失败的141例标本中通过FISH检测出异常的有90例。显然,与核型分析相比,采用组合探针的FISH检测更为敏感。但是,在60例FISH未检出异常的标本中,有19例通过核型分析检测到染色体数目和/或结构异常;另外,在FISH和核型分析均检出一定程度遗传学异常的39例标本中,有31例的核型分析能在FISH检出染色体异常的基础上,检出了其他的染色体数目和/或结构异常。因此,R显带分析能更全面、详细地了解白血病细胞的遗传学信息,仍是白血病遗传学的研究基础。本研究189例儿童ALL患者通过R显带分析和FISH共检出细胞遗传学异常者148例(78.31%),均显著高于单用FISH检测或单用核型分析的检出率;由此可见,组合FISH技术与R显带技术能显著提高儿童ALL染色体异常的检出率。
总之,常规染色体核型分析仍是检测儿童ALL的染色体数目和结构异常必不可少的手段,FISH则是其重要的补充,二者联合应用,可提高儿童ALL染色体异常检出率,获得更多、更精细、全面的儿童ALL的遗传学信息,提高遗传学检测在儿童ALL的预后评估以及追踪白血病微小残留等方面的作用。
[1]Carroll WL,Bhojwani D,Min DJ,et al.Childhood acute lymphoblastic leukemia in the age of genomics[J].Pediatr Blood Cancer,2006,46(5):570-578.
[2]Sabattini E,Bacci F,Sagramoso C,et al.WHO classification of tumours of haematopoietic and lymphoid tissues in 2008:an overview[J].Pathologica,2010,102(3):83-87.
[3]McGrattan P,Campbell S,Cuthbert R,et al.Integration of conventional cytogen-etics,comparative genomic hybridisation and interphase fluorescence in situ hyb-ridisation for the detection of genomic rearangements in acute leukaemia[J].Clin Pathol,2008,61(8):903-908.
[4]朱美君,孔炜,宋磊,等.儿童急性淋巴细胞白血病193例遗传学异常分析[J].现代中西医结合杂志,2014,23(17),1869-1870.
[5]刘青,蒋慧,孙恒娟,等.儿童急性淋巴细胞白血病细胞遗传学特征分析[J].中华血液学,2012,33(4):282-285.
[6]郭哗,陈玉梅,邹尧,等.688例儿童急性白血病群体生物学特征现况调查-单中心小样本研究[J].中国当代儿科杂志,2009,11(10):793-796.
[7]Sutcliffe MJ,Shuster JJ,Sather HN,et al.High concordance from independent studies by the Children’s Cancer Group(CCG)and Podiatric Oncology Group(POG)associating favorable prognosis with combined trisomies 4,10,and 17 in children with NCI standard-risk B-precursor acute lymphoblastic leukemia:a Children’s Oncology Group(COG)initiative[J].Leukemia,2005,19(5):734-740.
[8]Rubnitz JE,Wichlan D,Devidas M,et al.Prospective analysis of TEL gene rearrangements in childhood acute lymphoblastic leukemia:a Children’s Oncology Group study[J].J Clin Oncol,2008,26(13):2186-2191.
[9]Romana SP,Le Coniat M,Berger R.t(12:21):A new recurrent translocation in acute lymplloblastic leukemia[J].Genes Chromosomes Caner,1994,9(3):l86-19l.
[10]Golub TR,Barker GF,Bohlander SK,et al.Fusion of the TEL gene on12p13 to the AML1 gene on 21q22 in acute lymphoblastic leukemia[J].Proc Natl Acad Sci USA,1995,92(11):4917-4921.
[11]Raimondi SC.Current status of cytogenetic research in childhood acute lymphoblastic leukemia[J].Blood,1993,81(9):2237-2251.
[12]Kearney L,Horsley SW.Molecular cytogenetics in haematological malignancy:current technology and future prospects[J].Chromsoma,2005,114:286-294.
[13]帖利军,顾龙君,陈静,等.儿童急性淋巴细胞白血病的细胞遗传学表现与预后的关系[J].中华血液学杂志,2006,27(5):339-343.
[14]De Braekeleer E,Douer-Guilbert N,Morel F,et al,Philadelphia chromosome-positive acute lymphoblastic leukemia:a cytogenetic study of 33 patients diagnosed between 1981 and 2008[J].Anticancer Res,2010,30(2):569-573.
[15]Baldwin EL,Lee JY,Blake DM,et al.Enhanced detection of clinically relevant genomic imbalances using a targeted plus whole genome oligonucleotide microarray[J].Genet Med,2008,10:415-429.

