Wnt信号通路中β-catenin、GSK3β及Lef-1在卵巢癌中的表达及其意义
郭玉霞,马利国,陈递林,李明娥,石丽云,叶芷芬,郑绘霞(暨南大学第二临床医学院,深圳市人民医院妇科,深圳 5800;山西医科大学第一医院病理科)
卵巢癌是妇科常见的恶性肿瘤,近几年来死亡率已位居女性生殖系统肿瘤的首位。卵巢癌的发病机制至今尚不明确,多数研究认为其可能与多种作用机制有关。近期研究发现,Wnt通路中信号成分的改变在卵巢癌的发生过程中起着重要作用。本研究主要检测Wnt信号转导通路中β-catenin、GSK3β及Lef-1在卵巢上皮性肿瘤中的表达及三指标在卵巢肿瘤中的相互作用关系,探讨Wnt信号通路在卵巢癌发病的作用机制,为卵巢癌的发生、发展、预后及治疗提供依据。
1 材料与方法
1.1 组织标本
收集暨南大学第二临床医学院(深圳市人民医院妇科)及山西医科大学第一医院病理科2003-02~2014-08正常卵巢上皮组织、卵巢良性肿瘤以及卵巢癌组织标本共218例,其中正常组织30例,卵巢浆液性囊腺瘤45例,黏液性囊腺瘤49例,浆液性囊腺癌51例,黏液性囊腺癌43例,年龄29-76岁,平均年龄53岁。所有标本经过两位经验丰富的高级职称病理专家诊断。
1.2 药物与试剂
兔抗人 β-catenin多克隆抗体(工作浓度1∶100),鼠抗人 GSK3β 单克隆抗体(工作浓度1∶100),鼠抗人 Lef-1单克隆抗体(工作浓度1∶100)和DAB显色剂均购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学
采用EnVision法检测β-catenin、GSK3β及Lef-1的表达。所有石蜡标本4 μm连续切片,DAB显色。卵巢癌组织染色设阳性对照和阴性对照,阴性对照采用PBS液代替一抗。
结果判定:β-catenin在细胞膜阳性,胞质或核中可出现阳性表达;GSK3β在细胞质呈棕黄色颗粒为阳性染色;Lef-1则以细胞核中出现棕黄色散在颗粒为阳性。高倍显微镜(400×)下随机观察5个视野,每个视野计数100个细胞,计算百分比,1分为阳性细胞1%-25%,2分为26%-50%,3分为51%-75%,4分为76%-100%。染色强度分为无(0分),弱阳性(1分),中等阳性(2分),强阳性(3分)。二者相乘>3分为阳性,≤3分为阴性。
1.4 统计学分析
采用SPSS 15.0软件进行统计学处理,数据比较行χ2检验,P<0.05为有统计学意义。
2 结果
2.1 β-catenin在卵巢组织及卵巢肿瘤中的表达
β-catenin在腺癌中的表达(见图1)明显高于正常卵巢组织和卵巢良性腺瘤,差异有显著性意义(P<0.05);β-catenin的表达与腺癌的类型无关(P>0.05),无论是浆液性还是黏液性腺癌,β-catenin表达只与淋巴结转移及FIGO分期有关(P<0.05),而与肿瘤分级无关(P >0.05,见表1,2)。
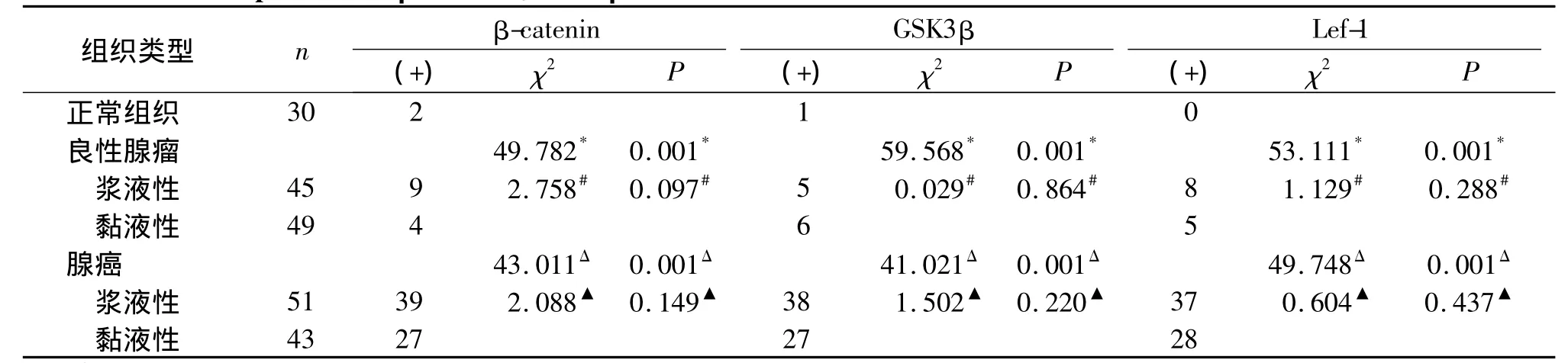
表1 β-catenin、GSK3β及Lef-1在组织中的表达情况Table 1 The expression of β-catenin,GSK3β and Lef-1 in different ovian tissues

表2 β-catenin、GSK3β及Lef-1在癌组织中与临床参数的比较Table 2 Relationship between expression of β-catenin,GSK3β and Lef-1 and clinicopathological parameters in cancer tissues
2.2 GSK3β在卵巢组织及卵巢肿瘤中的表达
GSK3β同样在腺癌中的表达(见图2)明显高于其他良性腺瘤及正常卵巢组织,差异统计学意义(P<0.05);GSK3β表达与腺癌的类型无关(P>0.05),与肿瘤分级、淋巴结转移及FIGO分期有关(P <0.05,见表1,2)。
2.3 Lef-1在卵巢组织及卵巢肿瘤中的表达情况
Lef-1在腺癌中的表达(见图3)明显高于正常卵巢组织和卵巢良性腺瘤(P<0.05);Lef-1中的表达与腺癌的类型无关(P>0.05),不论是浆液性还是黏液性腺癌,Lef-1表达只与淋巴结转移及FIGO分期有关(P <0.05),与肿瘤分级无关(P >0.05,见表1,2)。
2.4 β-catenin与GSK3β及Lef-1在卵巢癌中的相关性比较
由表3可见,相关性分析显示,β-catenin与GSK3β 存在正相关(r=0.623,P=0.001),与 Lef-1之间同样存在正相关(r=0.421,P=0.001)。
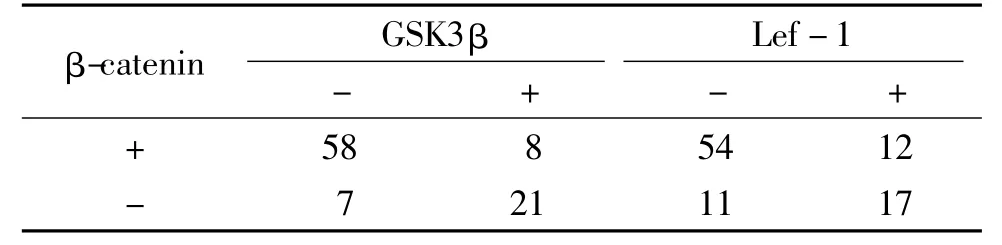
表3 β-catenin与GSK3β及Lef-1在卵巢癌中的相关性比较 (例)Table 3 Correlation between β-catenin,GSK3β and Lef-1 in human ovarian carcinoma (cases)
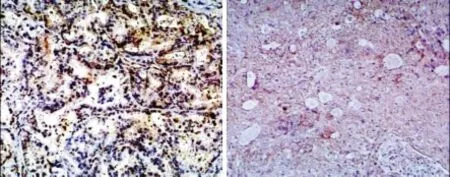
图1 β-catenin在浆液性及黏液性腺癌中的表达(EnVision,×100)Figure 1 Expression of β-catenin in serous and mucous adenocarcinoma(EnVision,×100)
3 讨论

图2 GSK3-β在浆液性腺癌及黏液性腺癌中的表达(EnVision,×100)Figure 2 Expression of GSK3-βin serous and mucous adenocarcinoma(EnVision,×100)

图3 Lef-1在浆液性及黏液性腺癌中的表达(EnVision,×100)Figure 3 Expression of Lef-1 in serous and mucous adenocarcinoma(EnVision,×100)
Wnt信号通路是一条较为复杂且保守的信号转导通路,在调控胚胎发育、参与细胞增殖分化及肿瘤的发生发展中都起着重要的作用[1]。研究发现Wnt信号通路中某些成分的改变在卵巢癌的发生过程中起着重要的作用。β-catenin是Wnt信号通路的核心分子,参与了多种基因的转录调控[2,3]。Wnt信号通路的异常激活是导致肿瘤发生发展的重要原因,而β-catenin在胞质内的大量积聚是Wnt信号通路被异常激活的关键因素,β-catenin的蓄积是肿瘤形成的重要原因。GSK3β是β-catenin的上游调节因子,可与APC和Axin形成复合体,从而使β-catenin发生磷酸化,最终β-catenin被降解,进入胞质及胞核,并参与转录过程,引发细胞周期的的失控,最后导致肿瘤细胞的增殖,从而促进肿瘤的进展[4-6]。
在肝细胞癌的研究中通过干扰及转染实验证实,Wnt/β-catenin信号通路可通过调节 GSK3β的表达来参与肝癌的发生发展[7]。在子宫内膜癌的研究中发现,β-catenin和GSK3β二者在癌组织中的表达明显高于正常子宫内膜组织,且与内膜癌的类型无关,而与组织学分级、临床分期、肌层浸润及淋巴结转移有关,二者表达之间有显著相关性,且二者过表达与子宫内膜癌的发生发展及转移有关[8]。
本研究表明,β-catenin及GSK3β蛋白在卵巢肿瘤中的表达明显高于正常卵巢组织,但在良性腺瘤中的表达低于腺癌中的表达,即正常组织、腺瘤组织、癌组织中表达顺序为逐渐增高,癌组织中最高,β-catenin和GSK3β蛋白三者间比较均有统计学差异。在癌组织中的比较发现,β-catenin及GSK3β蛋白表达与腺癌的类型无关,β-catenin与肿瘤分级无关,与淋巴结转移及FIGO分期有关,发生淋巴结转移及FIGO分期高者表达增高;GSK3β则与三者均有关,高级别、淋巴结有转移及FIGO分期高的病例GSK3β高表达。相关性分析显示,β-catenin与GSK3β之间存在正相关,表明 β-catenin和 GSK3β在卵巢癌的发生发展过程中起着一定的作用,且二者对肿瘤的发展存在正调节作用,二者的高表达可能是肿瘤恶性进展的标志。
Lef-1是淋巴增强因子家族成员,是 Wnt/βcatenin信号通路关键的核内转录因子,Lef-1在胚胎发育过程中起着重要的作用,其表达及功能异常是导致胚胎发育畸形的重要因素,Lef-1表达于多种组织细胞,其表达增高与恶性肿瘤有关[9,10]。但 βcatenin本身并不能与DNA结合,而是需要与DNA结合蛋白作用包括Lef-1的参与,在细胞核内共同完成调控靶基因的表达[11],因此二者在肿瘤中的作用值得关注。
在宫颈癌细胞的研究中发现,LEF-1被成功转染并稳定表达β-catenin依赖的细胞株,细胞增殖能力及速度增强,凋亡水平降低,表明二者在宫颈癌的发生发展中起了重要的作用[12]。本研究结果显示,LEF-1在癌组织中的表达明显高于良性腺瘤及正常组织,且与腺癌的类型无关,只与淋巴结转移及FIGO分期有关,可见LEF-1在卵巢癌的发生发展过程中有一定的作用,并且可能是其恶性进展的标志。相关性分析显示,β-catenin与LEF-1表达之间存在正相关,表明二者能够持续Wnt信号通路,从而激活一系列靶基因引起细胞的持续增殖及恶性进展。
Wnt信号通路本身是一个复杂的基因网络,βcatenin在其中参与着重要的作用,我们的研究证实β-catenin、GSK3β及LEF-1在卵巢癌的发生发展过程中起着重要的作用,可能是其恶性进展的标志,是判断卵巢癌生物学行为的重要指标,但具体的作用机制还需要进一步研究。
[1]Sokol SY.Spatial and temporal aspects of Wnt signaling and planar cell polarity during vertebrate embryonic development[J].Semin Cell Dev Biol,2015:Epub ahead of print.
[2]Badiglian Filho L,Oshima CT,De Oliveira Lima F,et al.Canonical and noncanonical Wnt pathway:a comparison among normal ovary,benign ovarian tumor and ovarian cancer[J].Oncol Reports,2009,21(2):313-320.
[3]Bodnar L,Stanczak A,Cierniak S,et al.Wnt/β-catenin pathway as a potential prognostic and predictive marker in patients with advanced ovarian cancer[J].J Ovarian Res,2014,7:16.
[4]李康,旦增.Wnt/β-catenin信号与胃癌防治研究进展[J].南方医科大学学报,2014,34(12):1852-1856.
[5]Enzo MV,Rastrelli M,Rossi CR,et al.The Wnt/β-catenin pathway in human fibrotic-like diseases and its eligibility as a therapeutic target[J].Mol Cell Ther,2015,3:1.
[6]Vanhollebeke B,Stone OA,Bostaille N,et al.Tip cell-specific requirement for an atypical Gpr124-and Reck-dependent Wnt/β-catenin pathway during brain angiogenesis[J].Elife,2015,4:06489.
[7]王新红,孙逊,孟祥伟,等.Wnt/β-连环素信号通路对肝细胞癌信号分子的调节作用及其意义[J].中华肝脏病杂志,2010,18(9):672-675.
[8]张智慧.P-GSK3β和β-catenin蛋白在子宫内膜癌中的表达及临床意义[J].河北医药,2012,34(14):2091-2093.
[9]He L1,Lu N,Dai Q,et al.Wogonin induced G1 cell cycle arrest by regulating Wnt/β-catenin signaling pathway and inactivating CDK8 in human colorectal cancer carcinoma cells[J].Toxicology,2013,312:36-47.
[10]Jayaraj P,Sen S,Sharma A,et al.Eyelid sebaceous carcinoma:a novel mutation in lymphoid enhancer-binding factor 1(LEF1)[J].Br J Dermatol,2015:Epub ahead of print.
[11]Behrens J,Lustjg B.The wnt connection to tumorigenesis[J].Int J Dev Biol,2004,48(5-6):477-487.
[12]王淑红,南克俊,田涛,等.β-catenin依赖性LEF-1亚型对宫颈癌HeLa细胞生物行为学的影响[J].西安交通大学学报:医学版,2010,31(3):313-317.

