前列腺癌中NUCB2和caspase-3的表达及其相关性
马敦惠,张晨丽,张 煦(兰州大学基础医学院病理学研究所,兰州 730000;通讯作者,E-mail:zhangxu64@163.com)
前列腺癌(prostate cancer,PC)是一种男性泌尿生殖系统常见的恶性肿瘤。在我国前列腺癌的发病率呈现明显持续增长趋势,成为严重影响到我国男性健康的泌尿系恶性肿瘤。血清前列腺特异性抗原(prostate-specific antigen,PSA)是目前临床上广泛应用的筛查指标,但对检测前列腺癌的敏感性和特异性较低。
20世纪90年代,Kanai等[1]在小鼠及人细胞中发现了一种EF手型钙结合蛋白,并将其命名为核组蛋白(nucleobindin-2,NUCB2)。目前发现NUCB2具有特殊的结构功能,并且是一种癌症相关基因,该基因在胃癌、乳腺癌、前列腺癌、肾透明细胞癌中被相继报道。caspase-3是caspases基因家族成员之一,是细胞凋亡过程中的关键激酶,凋亡执行的效应分子,在不同的肿瘤组织中表达也不同。NUCB2和caspase-3在前列腺癌中的表达及相关性研究报道甚少。本实验应用免疫组化SP法检测前列腺癌组织中NUCB2和caspase-3的表达,探讨二者表达的意义,进行相关性分析。
1 材料与方法
1.1 材料
收集解放军第一医院病理科2007-01~2013-12存档前列腺石蜡标本,其中前列腺癌49例、前列腺上皮内瘤变33例[低级别上皮内瘤变(LGPIN)14例、高级别上皮内瘤变(HGPIN)19例]、良性前列腺增生15例。两位资深病理医师严格复审所有标本。前列腺癌病例组患者年龄61-86岁,平均年龄75.6岁,≥76岁者26例,<76岁者23例。前列腺癌病例组患者术前血清前列腺特异性抗原(PSA)水平2.06-89.62 ng/L,平均值为 29.26 ng/L。所有患者术前均未行放疗、化疗。前列腺癌病例组进行Gleason评分,其中Gleason评分为≤5分(高分化)12例,Gleason评分为6-7分(中分化)16例,Gleason评分为8-10分(低分化)21例。对前列腺癌病例组进行随访,5年内死亡19例,5年以上存活30例。所有标本均经10%福尔马林固定,石蜡包埋后3 nm连续切片。
1.2 主要试剂
兔抗人NUCB2(nucleobindin2)多克隆抗体购自美国SANTA CRUZ生物技术公司;小鼠抗人CPP32(caspase-3)单克隆抗体,SP免疫组化染色试剂盒购自北京中杉金桥生物技术公司,DAB显色试剂购自福建迈新生物技术公司。
1.3 方法
采用免疫组化SP法,操作步骤严格按试剂盒说明书进行。对于NUCB2及caspase-3抗体抗原修复分别采用柠檬酸缓冲液(pH6.0)高压锅热修复和EDTA(pH8.0)高压锅热修复。兔抗人NUCB2多克隆抗体,稀释度为1∶50。DAB显色,苏木精复染,经酒精、二甲苯脱水透明,最后中性树胶封片。
1.4 结果判定
NUCB2和caspase-3蛋白阳性细胞染色表现为细胞胞质内棕黄色或棕褐色颗粒。根据每张切片的阳性细胞染色深度和阳性细胞率分别进行分级计分。不着色为0分,浅棕黄色为1分,棕黄色为2分,深棕色为3分。阳性细胞数<5%为0分,6%-25%为1分,26%-50%为2分,51%-75%为3分,>75%为4分。然后将染色深度和阳性细胞数两者得分相乘,0分为阴性(-),≥1分为阳性(+)。
1.5 统计学分析
采用 SPSS17.0统计软件进行统计学分析。NUCB2和caspase-3在前列腺癌、前列腺上皮内瘤变及良性前列腺增生组织中的表达差异采用χ2检验,NUCB2和caspase-3在前列腺癌组织中的表达相关性采用Spearman相关分析。以α=0.05为显著性检验水准,P<0.05为差异有统计学意义。采用Kaplan-Meier法分析NUCB2表达与生存期的关系。
2 结果
2.1 NUCB2、caspase-3在前列腺癌、前列腺上皮内瘤变及良性前列腺增生组织中的表达
NUCB2主要表达于腺上皮细胞胞质内,呈棕黄色至棕褐色(见图1)。NUCB2在BPH、LGPIN、HGPIN 及PC 组阳性率分别为 13.3%,14.3%,15.8%及73.5%。NUCB2在PC组中的阳性率明显高于BPH组、LGPIN组和HGPIN组,差异有统计学意义(P <0.05,见表 1)。
caspase-3主要表达于腺上皮细胞胞质内或基底层细胞胞质内,呈棕黄色至棕褐色颗粒状,也有个别表达于胞核上(见图2)。caspase-3在BPH、LGPIN、HGPIN 及PC 组阳性率分别为77.3%,64.3%,42.1%及32.7%。caspase-3在PC组中的阳性率明显低于BPH组、LGPIN组和HGPIN组,差异有统计学意义(P <0.05,见表1)。
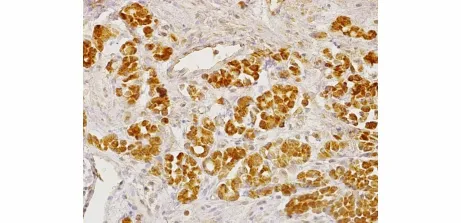
图1 NUCB2在前列腺癌中的表达(SP,×200)Figure 1 NUCB2 expression in prostate cancer(SP,×200)
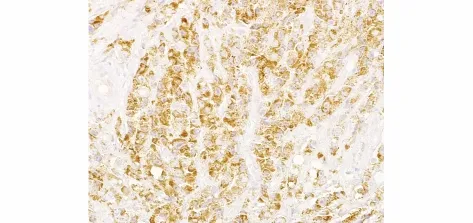
图2 Caspase-3在前列腺癌中的表达(SP,×200)Figure 2 Caspase-3 expression in prostate cancer(SP,×200)
2.2 NUCB2和caspase-3的表达与前列腺癌临床病理参数的关系
在前列腺癌组织中,NUCB2表达与患者年龄无关(P>0.05);与Gleason评分和术前血清PSA值有关,随着Gleason评分的增高,NUCB2的表达率也增高,同样随着术前血清PSA值的增加,NUCB2的表达率也增高,差异有统计学意义(P<0.05)。<5年生存期病例的NUCB2表达阳性率高于≥5年生存期病例,差异有统计学意义(P<0.05,见表2)。caspase-3表达与患者年龄、Gleason评分及术前血清PSA值均无关,差异无统计学意义(P>0.05)。<5年生存期病例的caspase-3表达阳性率低于≥5年生存期病例,但差异无统计学意义(P>0.05,见表2)。
2.3 NUCB2与caspase-3在高级别上皮内瘤变组和高分化前列腺癌组中的表达
NUCB2在高分化PC组中阳性表达率高于HGPIN组,差异有统计学意义(P<0.05,见表3)。
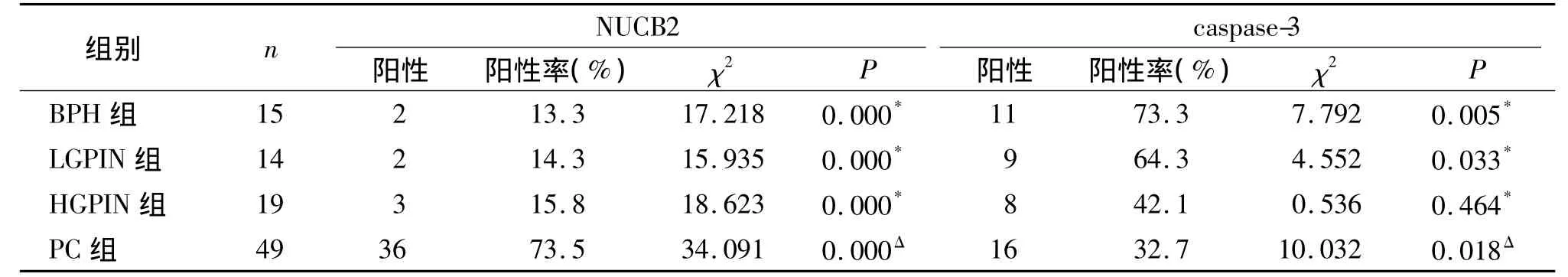
表1 NUCB2与caspase-3在各组中的表达 例(%)Table 1 Expression of NUCB2 and caspase-3 in each group cases(%)

表2 NUCB2与caspase-3的表达与PC临床病理参数的关系Table 2 Relationship of expression of NUCB2 and caspase-3 with the clinicopathological factors in prostate cancer

表3 NUCB2与caspase-3在HGPIN组和高分化PC组中的表达Table 3 Expression of NUCB2 and caspase-3 in patients with HGPIN and high differentiation of prostate cancer
2.4 NUCB2表达与PC预后的关系
预后分析显示,本组NUCB2阳性表达36例,阴性表达13例,阳性和阴性患者间术后生存差异有统计学意义(P=0.001,见图3)。本组caspase-3阳性表达16例,阴性表达33例,阳性和阴性患者间术后生存差异无统计学意义(P>0.05,见图4)。
2.5 前列腺癌中NUCB2与caspase-3表达的相关性
NUCB2、caspase-3在前列腺癌组织中的表达呈负相关性(P <0.001,见表4)。
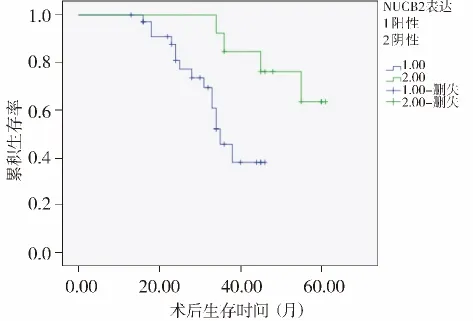
图3 NUCB2表达与PC术后生存曲线Figure 3 NUCB2 expression and postoperative survival curves of PC patients
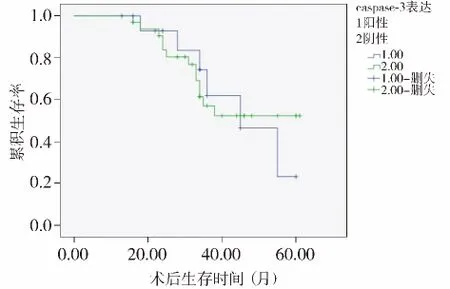
图4 caspase-3表达与PC术后生存曲线Figure 4 caspase-3 expression and postoperative survival curves of PC patients

表4 NUCB2、caspase-3在前列腺癌组织中表达的关系Table 4 Correlation between the expression of NUCB2 and caspase-3 in prostate cancer
3 讨论
前列腺癌是男性常见的恶性肿瘤之一,随着我国人口老龄化、饮食结构的改变及前列腺癌诊治水平的提高等因素的影响,在我国前列腺癌的发病率逐年上升。因此,对于前列腺癌的发生、发展以及诊治已经成为一个重要的课题。
NUCB2基因是一种新的肿瘤相关基因,在胃癌、乳腺癌、前列腺癌及肾透明细胞癌中被相继报道[3-6]。Kalnina 等[3]采用 RT-PCR 检测结果显示胃癌组织中NUCB2 mRNA水平下调。Suzuki等[4]研究发现NUCB2与乳腺癌的复发和不良预后密切相关,被认为是一种有效的预后因素。Qi等[6]发现肾透明细胞癌组织中NUCB2表达水平明显高于相邻的非癌变组织。有研究发现NUCB2在前列腺癌中有高表达,通过逆转录酶聚合酶连反应,发现前列腺癌组织中NUCB2 mRNA明显增高[5]。
本组实验结果显示NUCB2在前列腺癌组中的表达明显高于良性前列腺增生组和前列腺上皮内瘤变组,差异有统计学意义(P<0.05),NUCB2在前列腺癌组织中的高表达与Zhang等[7]的研究结果一致。本实验显示,在PC组中NUCB2表达与年龄无关,与肿瘤的Gleason分级、术前血清PSA相关,差异有统计学意义(P<0.05),血清PSA是用于前列腺癌的常用筛查指标,随着术前血清PSA值的增加,NUCB2蛋白的表达率增高。Gleason评分能反应出前列腺癌的分化程度及生物学行为,随着Gleason分级的增加,前列腺癌分化越差,NUCB2表达率越高,提示NUCB2表达可能与PC的进展、分化有关。NUCB2在<5年与≥5年生存期病例中的表达差异,提示NUCB2的异常表达可能与前列腺癌的预后有关。HGPIN目前认为是一种癌前病变,其组织学形态与生物学行为与PC相似并有关联,尤其是与高分化前列腺癌。本组实验显示在高分化PC组中NUCB2阳性表达率高于HGPIN组,差异有统计学意义,提示其可能可以用于二者的鉴别诊断。
细胞凋亡即程序性细胞死亡,是一种自然死亡过程,目前研究认为,许多恶性肿瘤的发生与凋亡失衡密切相关。天冬氨酸特异的半胱氨酸蛋白酶(caspases)在细胞凋亡中起重要的作用,其中caspase-3是细胞凋亡过程中的关键激酶以及主要的效应分子。近年来,研究发现在人类癌症患者中,caspase-3 与肿瘤的复发和死亡相关[8]。Sohn 等[9]研究发现在前列腺癌组织中caspase-3的阳性表达率为27.5%,并且caspase-3的阳性表达与 Gleason分级无相关性。
本研究结果显示,caspase-3蛋白主要在细胞胞质表达,呈颗粒状,仅个别在细胞核表达。caspase-3在前列腺癌组中的表达明显低于良性前列腺增生组和前列腺上皮内瘤变组,差异有统计学意义(P<0.05)。caspase-3 在 PC 组阳性率为 32.7%,但caspase-3在PC中的表达与患者年龄、Gleason分级、术前血清PSA水平均无关,提示caspase-3可能与PC的发生有关,caspase-3在前列腺癌组织中的表达明显低于非癌性前列腺组织,提示caspase-3在前列腺癌细胞凋亡机制中有重要作用。这与一些研究结果相似,O’Neill等[10]研究结果显示caspase-3在前列腺增生组织中的表达明显高于前列腺癌组织,并提出caspase-3的表达改变是雄激素阻断的一种凋亡抵抗机制。
NUCB2是一种新近发现的与恶性肿瘤相关的生物学指标,并且具有其独特的结构域及相应的功能;caspase-3作为caspases家族中的重要成员在人体细胞凋亡中起着至关重要的作用。Valencia等[11]研究发现,NUCB1与NUCB2是与Ca2+相互作用的多功能蛋白。凋亡发生过程中重要的效应分子半胱氨酸蛋白酶(caspases)能对Nucleobindins(包括nucb1和nucb2)进行裂解,并且caspases切割位点准确定位于其中的一个钙离子结合EF-hand结构。并通过进一步实验合成斑马鱼NUCB2,发现其能有效地、明确地被斑马鱼 caspase-3裂解,也能被人csapase-3裂解。本实验采用Spearman相关分析显示,在前列腺癌组织中NUCB2表达与caspase-3表达呈负相关,NUCB2随着前列腺癌的发生表达增强,caspase-3随着前列腺癌的发生表达降低,由此可以提示NUCB2的高表达引起caspase-3的减少,影响细胞凋亡失衡,NUCB2与caspase-3两者间存在一种相互作用机制在前列腺癌中发挥作用。目前NUCB2与caspase-3之间的相互关系以及生物学功能方面的研究还比较少,尤其是在肿瘤中的相互作用机制,仍需要大量病例展开进一步的研究。
[1]Kanai Y,Tanuma S.Purifiaction of a novel B cell growth and differentiation factor associated with lupus syndrome[J].Immunol Lett,1992,32(1):43-48.
[2]Kroll KA,Otte S,Hirchfeld G,et al.Heterologous overexpression of human NEFA and studies on the two EF-hand calcium-binding sites[J].Biochem Biophys Res Commun,1999,260:1-8.
[3]Kalnina Z,Silina K,Bruvere R,et al.Molecular characterisation and expression analysis of SEREX-defined antigen NUCB2 in gastric epithelium,gastritis and gastric cancer[J].Eur J Histochem,2009,53:7-18.
[4]Suzuki S,Takagi K,Miki Y,et al.Nucleobindin 2 in human breast carcinoma as a potent prognostic factor[J].Cancer Sci,2012,103:136-143.
[5]Zhang Hong-tuan,Qi Can,Li Liang,et al.Clinical significance of NUCB2 mRNA expression in prostate cancer[J].J Exp Clin Cancer Res,2013,32(1):56.
[6]Qi C,Ma H,Zhang HT,et al.Nucleobindin2 expression is an independent prognostic factor for clear cell renal cell carcinoma[J].Histopathology,2015,66(5):650- 657.
[7]Zhang Hong-tuan,Qi Can,Wang An-di,et al.Prognostication of prostate cancer based on NUCB2 protein assessment:NUCB2 in prostate cancer[J].J Exp Clin Cancer Res,2013,32:77.
[8]Huang Qian,Li Fang,Liu Xin-jian,et al.caspase 3-mediated stimulation of tumor cell repopulation during cancer radiotherapy[J].Nat Med,2012,17(7):860-866.
[9]Sohn JH,Kim DH,Choi NG,et al.Caspase-3/CPP32 immunoreactivity and its correlation with frequency of apoptotic bodies in human prostatic carcinomas and?benign?nodular hyperplasias[J].Histopathology,2000,37(6):555-560.
[10]O’Neill AJ,Boran SA,O’Keane C,et al.Caspase3 expression in benign prostatic hyperplasia and prostate carcinoma[J].Prostate,2001,47(3):183-188.
[11]Valencia CA,Cotton SW,Duan J,et al.Modulation of nucleobindin-1 and nucleobindin-2 by caspases[J].FEBS Lett,2008,582:286-290.

