白细胞计数对新发非酒精性脂肪肝的影响
朱 峰,季春鹏,施继红,杜 鑫,邢爱君,林黎明,贾浩洋,吴寿岭(开滦总医院赵各庄医院消化内科,唐山 06000;开滦总医院心内科;北京中医药大学东方学院;通讯作者,E-mail:drwusl@6.com)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种以无过量饮酒史的肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征。近20年,随着肥胖症和代谢综合征的广泛流行,NAFLD患病率迅速增长且呈低龄化发病趋势,估计普通人群中患病率为20%-33%,其中约10%发展为非酒精性脂肪性肝炎,并使心血管死亡风险和肝病相关死亡风险明显增高[1-3],标志着NAFLD本身已经成为主要的公共健康问题。有研究[4,5]显示,氧化应激与慢性炎症反应在NAFLD的发生、发展过程中起着重要作用。也有研究[6,7]显示,作为非特异性炎症反应标记物,白细胞计数与NAFLD密切相关,但目前国内外对二者的研究较少,且多为横断面研究,鲜有关于白细胞计数对新发NAFLD影响的研究报道。为此,本研究依据开滦研究资料(注册号:ChiCTR-TNC-11001489,注册网址:http://www.chictr.org/cn/proj/show.aspx?proj=1441)分析了白细胞计数对新发NAFLD影响。
1 对象与方法
1.1 研究对象
2006-07~2007-10由开滦医院、开滦林西医院、开滦赵各庄医院、开滦唐家庄医院、开滦范各庄医院、开滦吕家坨医院、开滦荆各庄医院、开滦林南仓医院、开滦钱家营医院、开滦马家沟医院、开滦医院分院11家医院参加,对开滦在职及离退休职工进行健康体检,共有101 510名职工(男81 110例,女20 400例)参加本次健康体检。2010-07~2011-10由上述各医院对同一人群再次进行健康体检,体检项目均与第一次相同。研究对象的入选标准:①参加2006-2007年度健康体检且经超声检查无脂肪肝者;②无饮酒史者;③白细胞计数资料完整者;④同意参加本研究并签署知情同意书者。排除标准:①2006-2007年度体检时有下述病史者:既往有心肌梗死病史者,既往有脑卒中病史者,恶性肿瘤患者,乙肝表面抗原阳性者,已诊断为肝硬化者;②WBC计数>10×109/L或者C-反应蛋白>10 mg/L被认为存在潜在急性炎症、感染或急性创伤者;③未参加2010-2011年度健康体检者。根据以上标准共纳入研究对象25 252例。
1.2 研究方法
1.2.1 一般资料 流行病学调查及人体测量方法见本课题组已发表的文献[8]。心肌梗死病史、脑卒中史、恶性肿瘤史定义为既往有二级甲等及以上医院诊的诊断依据。
1.2.2 实验室检查 研究对象于体检当日上午7∶00-9∶00抽取空腹肘静脉血 5 ml于 EDTA 真空管内,在室温下经3 000×g离心10 min后取上层血清在4 h内进行测量,生化指标的测量见本课题组已发表的文献[8]。
1.2.3 NAFLD的诊断 由从事超声工作5年以上且经过统一培训的超声医生对研究对象进行检查。采用PHILIPS公司HD-15彩色超声诊断仪,探头频率2.5-3.5 MHz。研究对象于上午空腹进行腹部超声检查,取仰卧位及左侧卧位,充分暴露右上腹部,多切面扫查肝脏。观察肝脏的形态、大小、被膜、边界、内部回声光点强弱及其分布均匀与否、肝脏轮廓显示清晰与否、肝内管状结构显示情况。一人操机,一人记录,两人核对后详细记录检查结果。
根据2006年中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的“NAFLD临床诊断标准”[3],具备以下3项腹部超声表现中的两项者可诊断为脂肪肝:①肝脏近场回声弥漫性增强,回声强于肾脏;②肝内管道结构显示不清;③肝脏远场回声逐渐衰减。明确NAFLD的诊断需符合以下3项条件:①无饮酒史或饮酒折合乙醇量小于140 g/周(女性<70 g/周);②除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;③肝活检组织学改变符合脂肪性肝病的病理学诊断标准或者肝脏影像学表现符合脂肪肝的诊断标准且无其他原因可解释。
1.2.4 白细胞计数的测定及分组 采用日本F-800全自动血细胞分析仪进行白细胞计数测定,批间和批内变异系数均小于10%。根据国外相关研究[7]的做法,将将研究对象按白细胞计数四分位数分为四组:第一分位组(≤5.2×109/L),第二分位组[(5.3-6.1)×109/L],第三分位组[(6.2-7.1)×109/L],第四分位组(≥7.2×109/L)。
1.3 统计学分析
2006-2007年度健康体检数据由各医院终端录入,通过网络上传至开滦医院计算机室服务器,形成oracle 10.2g数据库。由程序导出形成DBF格式文件,采用SPSS 13.0软件进行统计分析。所有正态分布的计量资料以±s表示,多组间比较采单因素方差分析(两两比较用LSD法)。因C-反应蛋白呈偏态分布,经对数转换后再用方差分析进行组间比较,并用M(Q1-Q3)表示。计数资料用百分率表示,组间比较应用χ2检验。采用多因素logistic回归分析不同白细胞计数水平对新发NAFLD的影响。以P<0.05(双侧检验)为差异有统计学意义。
2 结果
2.1 一般资料
参加2006-2007年度健康体检的研究对象共101 510例,其中男性81 110例,女性20 400例,已诊断为NAFLD者22 027例(参照2006年修订的NAFLD诊断标准),白细胞计数资料缺失者2 694例,饮酒者15 029例,按入选标准共入选61 760例。然后排除:既往心肌梗死病史者357例,既往脑卒中病史者445例,恶性肿瘤者105例,白细胞计数>10×109/L者1 275例,C反应蛋白>10 mg/L者1 562例,乙肝表面抗原阳性者2 456例,肝硬化者43例,未参加2010-2011年健康体检者30 265例,最终纳入统计学分析的研究对象共25 252例,其中男性15 565例,女性9 687例。
2.2 不同白细胞计数组基线资料的比较
随着白细胞计数四分位数分组的增加,年龄、收缩压、舒张压、C-反应蛋白、空腹血糖、总胆固醇、血尿酸水平、男性所占比例呈递增趋势(P<0.001,见表1),且随着白细胞计数四分位数分组的增加,高中及以上文化程度者所占比例、经常体育锻炼者所占比例逐渐降低,而每天吸烟者所占比例呈递增趋势(P<0.001)。
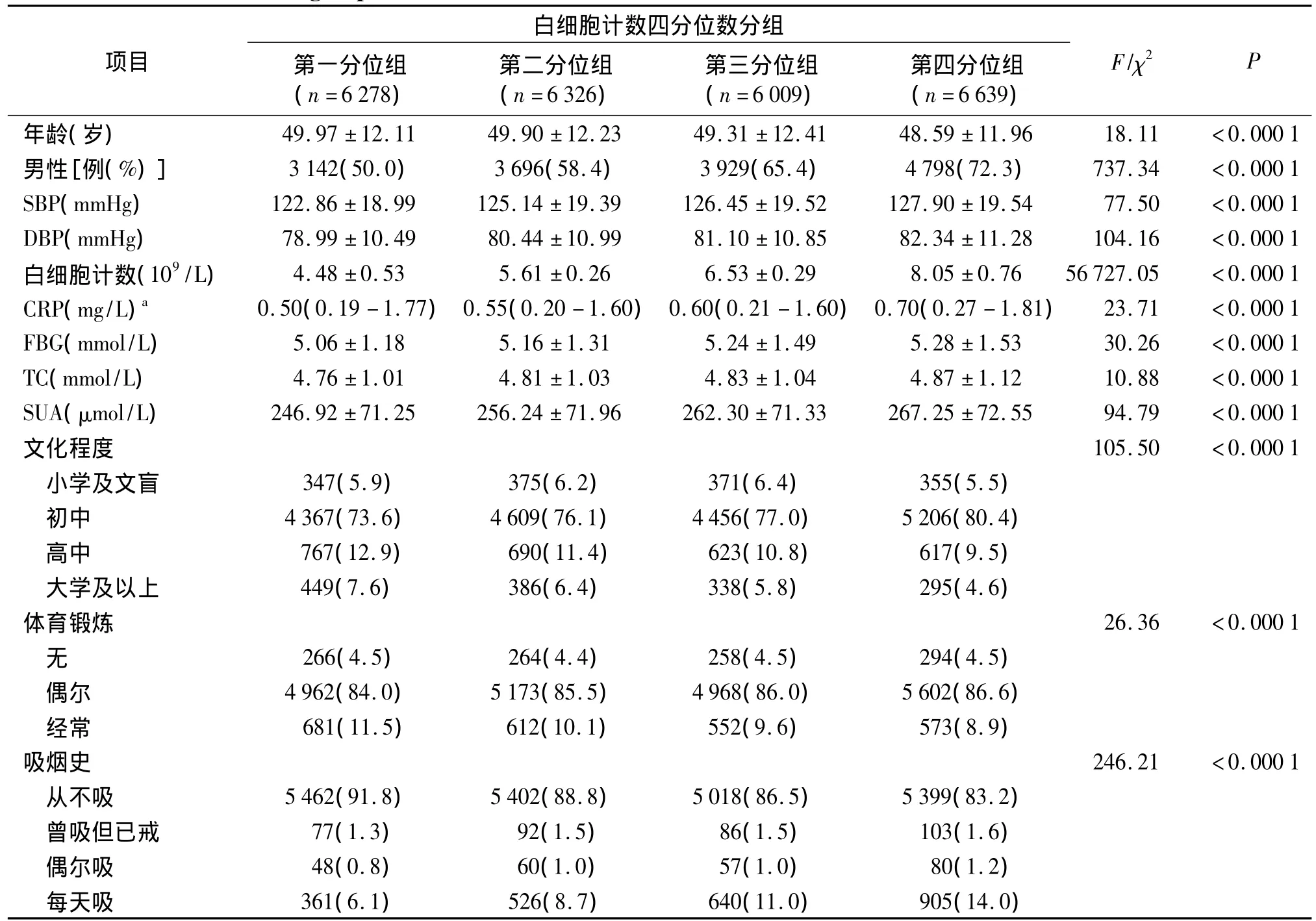
表1 不同白细胞计数组基线资料的比较Table 1 Baseline data in groups of different white blood cell counts
2.3 不同白细胞计数组NAFLD发病情况
随着白细胞计数水平的增加,新发NAFLD的检出率逐渐增高,在全人群中,白细胞计数第一、二、三、四分位组 NAFLD的检出率分别为 21.0%,23.5%,24.8%和28.0%,呈递增趋势(χ2=89.19,P<0.000 1),且无性别差异。在女性中,NAFLD的检出率分别为 18.5%,22.0%,23.9%和 26.2%(χ2=46.12,P < 0.000 1),在男性中,NAFLD 检出率分别为 23.6%,24.6%,25.3% 和 28.7%(χ2=32.71,P <0.000 1,见表2)。
2.4 不同白细胞计数水平对新发NAFLD的影响
在纳入统计分析的人群(25 252例)中,我们以2010-2011年度体检时是否发生NAFLD作为因变量,以基线白细胞计数四分位数分组、年龄、性别、收缩压、吸烟史、体育锻炼、文化程度、C-反应蛋白、空腹血糖、总胆固醇、血尿酸为自变量进行多因素Logistic回归分析,结果显示:随白细胞计数水平的增加,NAFLD的发病风险呈递增趋势,此趋势在男性和女性人群中均存在(见表3)。

表2 不同白细胞计数组不同性别的NAFLD检出率 例(%)Table 2 The detection rate of NAFLD in different groups of blood cell counts between women and men cases(%)
3 讨论
在中国和一些西方国家,作为慢性肝病的主要病因,NAFLD患病率已高达30%并仍有增长趋势[9],且大量研究证实,NAFLD与远期不良结局(包括糖尿病、心血管疾病、肿瘤、慢性肾病等)密切相关[10-14]。鉴于此,识别NAFLD危险因素并降低其发病风险成为我国乃至世界极为迫切的任务。研究显示,在NAFLD的发病机制中,炎症反应扮演了关键角色[4,5]。那么,作为非特异性炎症反应标记物的白细胞计数是否对NAFLD的发病有影响呢?目前国外仅有的几项研究均显示,二者存在关联[6,7],但这些研究均为横断面研究,并且缺乏针对中国人群的前瞻性研究报道。
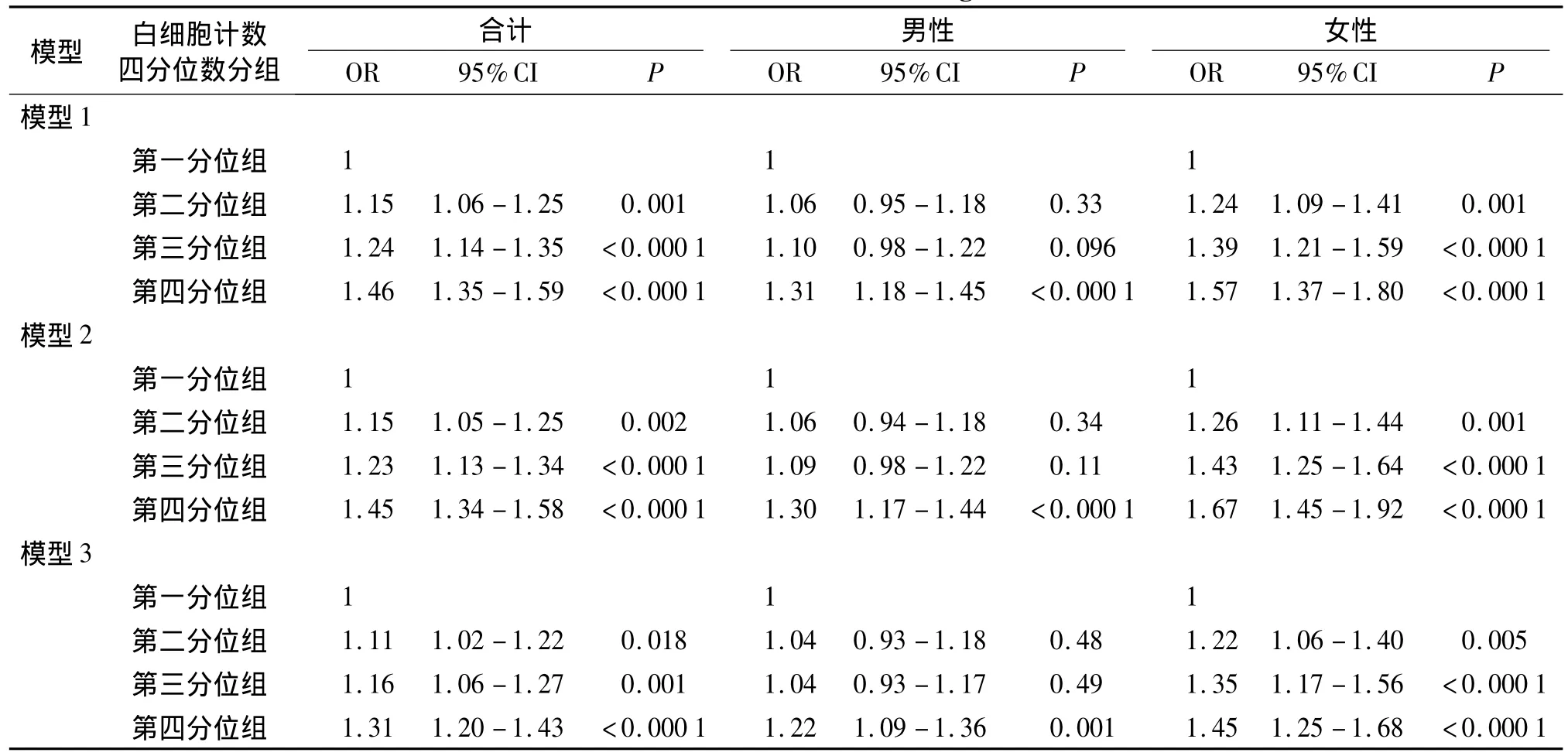
表3 不同白细胞计数水平对不同性别人群新发NAFLD的影响Table 3 The effect of white blood cell counts on NAFLD incidence among women and men
本研究结果显示,随着白细胞计数四分位数分组的增加,新发NAFLD检出率呈递增趋势,白细胞计数第一、二、三、四分位组NAFLD的检出率分别为21.0%,23.5%,24.8% 和 28.0%(χ2=89.19,P <0.000 1)。在校正基线年龄、性别、文化程度等混杂因素后,随着白细胞计数水平的增加,NAFLD的发病风险逐渐增高,其中白细胞计数第四分位组(≥7.2×109/L)发生NAFLD的风险是第一分位组(≤5.2 ×109/L)的 1.31 倍(95%CI 1.20-1.43,P <0.000 1)。Lee等[7]对参加年度健康体检的 3 681例研究对象(男性2 066例,女性1 615例)的横断面研究结果显示,随着白细胞计数四分位数分组的增加,NAFLD的患病率逐渐增高,分别为22.4%,29.7%,33.7%和 43.1%,且在校正年龄、吸烟史、体育锻炼水平等混杂因素后,随白细胞计数四分位数分组的增加,NAFLD的患病风险逐渐增高,白细胞计数第二、三、四分位组的OR(95%CI)值分别为1.48(1.10-1.98),1.59(1.18- 2.14)、1.84(1.35-2.51)。Kuppan等[6]的研究结果显示,NAFLD 组的白细胞计数水平显著高于健康对照组,分别为(7.8±1.4)×109/L 和 (6.9 ±0.9)×109/L(P <0.001),在校正混杂因素后,白细胞计数水平仍与NAFLD患病有关(OR=1.29,95%CI为 1.07-1.56,P=0.008)。以上结果均提示,白细胞计数水平是NAFLD的独立危险因素。
本研究也发现,随着白细胞计数水平的增加,多种传统心血管危险因素出现聚集现象,收缩压、舒张压、C-反应蛋白、空腹血糖、总胆固醇、血尿酸水平均呈递增趋势(P <0.000 1)。大量研究[15,16]也已证实,包括胰岛素抵抗、肥胖、脂代谢紊乱、高血压等在内的代谢综合征与NAFLD发病密切相关。由于NAFLD发病的多因素性及各种危险因素的相互作用,使NAFLD的病因及发病机制尚未完全明确,关于慢性炎症导致NAFLD的机制目前主要认为是:①长期慢性低度炎症易引起胰岛素抵抗及代谢综合征,致使脂代谢紊乱(高脂血症和外周脂肪动员增加),引起转运至肝脏的游离脂肪酸增多,最终导致NAFLD的发生;②NAFLD患者肝细胞内过量的游离脂肪酸可产生大量的活性氧,使肝细胞脂质过氧化并产生大量的细胞因子,再次促使白细胞计数、CRP等炎症因子的升高。以上两个过程形成一个闭合的炎症-NAFLD事件链,最终将进展为非酒精性脂肪性肝炎以及肝硬化[7,17,18]。因此,作为临床工作者,在大力倡导患者控制体重、戒烟限酒、合理膳食、适当锻炼等健康的生活行为方式的同时,还应及时发现并减轻患者体内炎症状态,使患者在临床治疗效果之外享受更多的获益。
本研究有一定的局限性:①研究对象仅限于开滦集团公司在岗及离退休职工,且以男性为主,限制了结果的外延,但我们研究的样本量大,并且对男、女性分别进行分析,因此本研究的结果仍具有一定的参考价值;②超声检查不能识别阈值(30%)以下的肝脏脂肪浸润,这可能导致我们低估了NAFLD的发病率;③由于引起NAFLD、白细胞计数升高的原因有很多(包括炎症性疾病、胃肠道疾病、风湿免疫性疾病及药物等),我们不能完全排除这些因素的干扰。
[1]Bhatia LS,Curzen NP,Calder PC,et al.Non-alcoholic fatty liver disease:a new and important cardiovascular risk factor[J].Eur Heart J,2012,33(10):1190-1200.
[2]Vijay LM,Mouen K,Naga C.Non-alcoholic fatty liver disease and cardiovascular risk[J].Curr Gastroenterol Rep,2009,11(1):50-55.
[3]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2006年修订版)[J].现代消化及介入治疗,2007,12(4):266-268.
[4]Mikolasevic I,Lukenda V,Racki S,et al.Nonalcoholic fatty liver disease(NAFLD)-a new factor that interplays between inflammation,malnutrition,and atherosclerosis in elderly hemodialysis patients[J].Clin Interv Aging,2014,9(8):1295-1303.
[5]Fierbinteanu-Braticevici C,Baicus C,Tribus L,et al.Predictive factors for nonalcoholic steatohepatitis(NASH)in patients with nonalcoholic fatty liver disease(NAFLD)[J].J Gastrointestin Liver Dis,2011,20(2):153-9.
[6]Kuppan G,Anjana RM,Deepa M,et al.Inflammatory markers in relation to nonalcoholic fatty liver disease in urban South Indians[J].Diabetes Technol Ther,2012,14(2):152-158.
[7]Lee YJ,Lee HR,Shim JY,et al.Relationship between white blood cell count and nonalcoholic fatty liver disease[J].Dig Liver Dis,2010,42(12):846-847.
[8]Jia Z,Zhou Y,Liu X,et al.Comparison of different anthropometric measures as predictors of diabetes incidence in a Chinese population[J].Diabetes Res Clin Pract,2011,92(2):265- 271.
[9]Lazo M,Clark JM.The epidemiology of nonalcoholic fatty liver disease:a global perspective[J].Semin Liver Dis,2008,28:339-50.
[10]Byrne CD,Targher G.NAFLD:A multisystem disease[J].J Hepatol,2015,62(1S):S47- S64.
[11]Musso G,Gambino R,Cassader M,et al.Meta-analysis:natural history of non-alcoholic fatty liver disease(NAFLD)and diagnostic accuracy of noninvasive tests for liver disease severity[J].Ann Med,2011,43:617-649.
[12]Musso G,Gambino R,Tabibian JH,et al.Association of non-alcoholic fatty liver disease with chronic kidney disease:a systematic review and meta-analysis[J].PLoS Med,2014,11:e1001680.
[13]Musso G,Cassader M,Olivetti C,et al.Association of obstructive sleep apnoea with the presence and severity of non-alcoholic fatty liver disease.A systematic review and meta-analysis[J].Obes Rev,2013,14:417-431.
[14]Gaggini M,Morelli M,Buzzigoli E,et al.Non-alcoholic fatty liver disease(NAFLD)and its connection with insulin resistance,dyslipidemia,atherosclerosis and coronary heart disease[J].Nutrients,2013,5:1544-1560.
[15]Fan JG,Saibara T,Chitturi S,et al.What are the risk factors and settings for non-alcoholic fatty liver disease in Asia-Pacific[J].J Gastroenterol Hepatol,2007,22(6):794 –800.
[16]Gaggini M,Morelli M,Buzzigoli E,et al.Non-alcoholic fatty liver disease(NAFLD)and its connection with insulin resistance,dyslipidemia,atherosclerosis and coronary heart disease[J].Nutrients,2013,5(5):1544-1560.
[17]Schwenger KJ,Allard JP.Clinical approaches to non-alcoholic fatty liver disease[J].World J Gastroenterol,2014,20(7):1712-1723.
[18]Riley P,O’Donohue J,Crook M.A growing burden:the pathogenesis,investigation and management of non-alcoholic fatty liver disease[J].J Clin Pathol,2007,60(12):1384-1391.

